【連載】基礎から応用までよくわかる組織透明化技術 「第1回 透明化技術 Scale 法を知る、そして使う」
本記事は、和光純薬時報 Vol.87 No.2(2019年6月号)において、国立研究開発法人理化学研究所 脳神経科学研究センター 細胞機能探索技術研究チーム 濱 裕様、星田 哲志様、宮脇 敦史様に執筆いただいたものです。

はじめに
固定組織の透明化技術(以下、単に透明化技術と表記する)は、従来二次元を主体として行われてきた組織学を三次元に大幅に拡張し組織学における新たな視野を得るための方法の一つである。そして近年、透明化技術は動物だけでなく植物の研究領域にも利用されるようになり、基礎生物学の分野をはじめ製薬などの応用分野で技術導入が少しずつ広がりを見せている。
ScaleA2法1)とScaleS法2)(これらを総称してScale法と呼ぶ)は筆者らが開発した透明化技術である。また、筆者らはAbScale法という透明化技術にマッチした三次元免疫染色法を開発した。これら二つの技術を組み合わせることで、マウス全脳や脳半球、あるいは厚みのある脳スライス内部の詳細な構造をとらえることができる。図1にそれらの画像を示す。
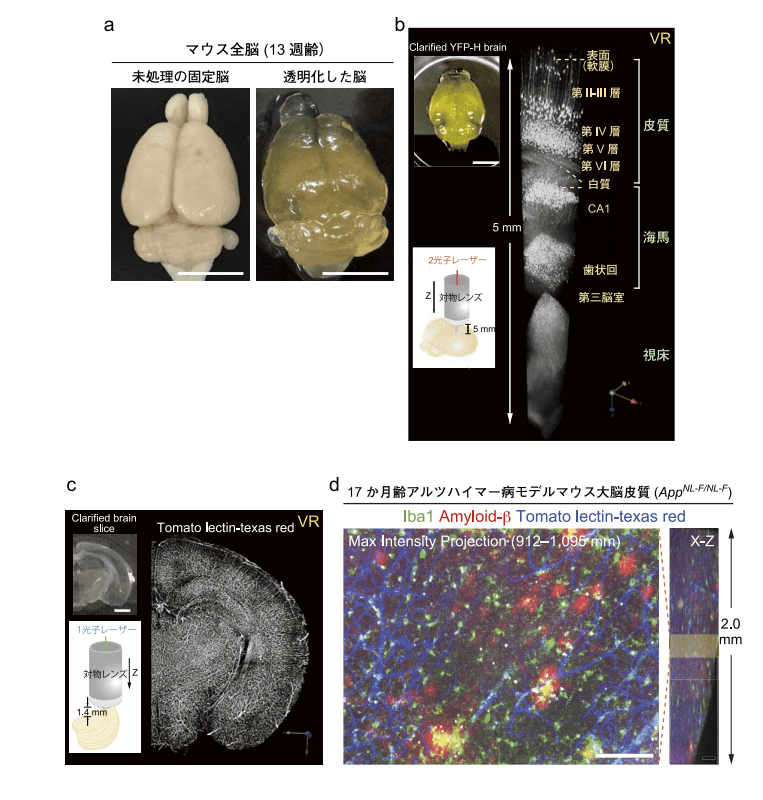
図1.ScaleS法による透明化とAbScale法による染色例
a. 未処理マウス全脳(左)および透明化を行ったマウス全脳(右)。いずれも固定したC57BL6/Jオスマウス(13適齢)由来。b. 透明化を行ったYFP-Hマウス(14週齢、オス)全脳(左上)のうち大脳を表面から視床まで2光子レーザー励起(正立型)顕微鏡で観察(左下)を行い三次元に再構築した画像(VR)(右)。c. Tomato lectin-texas redで血管染色を行った新生仔マウス(C57BL6/J、生後10.5日)大脳の冠状断スライス(厚さ1.2 mm)(左上)を透明化し、正立共焦点レーザー走査型顕微鏡(CLSM)で観察(左下)したVR画像(右)。d. Tomato lectin-texas redで血管染色(図中、青)を行ったアルツハイマー病モデルマウス(AppNL-F/NL-F、17か月齢、オス)大脳の冠状断スライス(厚さ約2 mm)をAbScale法で免疫染色を行い透明化後に観察した画像。赤色蛍光色素635結合Iba1ポリクローナル抗体(富士フイルム和光純薬 013-26471、図中、緑)およびAlexa Fluor 488結合 amyloid-β モノクローナル抗体(図中、赤)を染色に用いた。皮質部を正立型CLSMで観察した。左は薄黄色の長方形の領域10枚分のX-Y面(Z-ステップ = 7 µm、右の薄黄色の長方形の領域に相当)を重ねた画像(max intensity projection)。右は高さ2 mmの角柱状の観察領域のX-Z面を示す。スケールバーはそれぞれ、5 mm (a、b、および c)ならびに100 µm (d)Scale法に用いる試薬溶液はすでに富士フイルム和光純薬から一連のSCALEVIEW試薬として市販されている。以後本稿では透明化のプロセスに用いるScale試薬にSCALEVIEWが付いた試薬の名称を用いる。前出のScaleA2法およびScaleS法はそれぞれ、SCALEVIEW-A2、そしてSCALEVIEW-Sシリーズの試薬を用いる方法である。これらの試薬を用いた透明化の手順と三次元免疫染色の手順が富士フイルム和光純薬のホームページに紹介されているのでご覧いただけたらと思う。
本稿では透明化技術の現状とその基礎についてScale法を中心に概説する。また、実験解説書としての役割を持たせ透明化した組織を顕微鏡観察する際に気をつけるべき点などについて述べる。
透明化技術の現状
透明化技術は主に神経科学の分野で使われてきた。特に蛍光タンパク質遺伝子を導入した神経細胞を観察する際に力を発揮する技術である。蛍光タンパク質遺伝子を組み込んだウイルス(例えばアデノ随伴ウイルス、AAV)を脳の特定の領域に感染させることで神経細胞を限定的に標識することができる。その組織を固定・透明化することで目的の神経細胞の軸索がどこまで伸びているかを顕微鏡観察により追跡することができる。透明化を用いた神経回路の解析に関してEconomoら3)やYeら4)は興味深い方向性を示している。
過去約10年の間、世界中の研究者によって多様な透明化技術の開発が行われ報告されてきた。発表された透明化技術はどれも開発者の特徴ある工夫が盛り込まれている。それらの特徴についてはTainakaら(2016)5)や日置ら(2017)6)の総説に体系的にしかもわかりやすくまとめられているので参照していただきたい。
また、最近注目されている透明化技術の応用として挙げられるのは生物発光イメージング(BLI)技術との組合せである。すなわち、まずウイルスベクターを使ってルシフェラーゼ遺伝子と蛍光タンパク質遺伝子とを同一の神経細胞に同時に発現させ、その活動を生物発光シグナルとしてライブで非侵襲的に検出する。その後に脳を固定、透明化し蛍光タンパク質のシグナルを確認する。これによりその神経活動がどの細胞に由来するものであったかを確認することが可能である。特に筆者らの研究室で開発されたAkaBLIシステムは極めて感度が高く、体内に標識した細胞がたった一つしか存在しない場合でもそのシグナルを追跡することが可能である7)。BLI技術と透明化技術とのコンビネーションの応用は神経科学の分野だけでなく、がん、免疫、幹細胞の研究分野にも応用可能であると考えられる。
以上のin vivoを中心とした研究に加え、もう一つ透明化技術の応用範囲として注目すべき分野がある。スフェロイドやオルガノイドなどの組織を模した三次元細胞培養を用いたin vitroでの研究である。近年、それらの細胞塊は基礎生物学的な研究から薬剤のスクリーニングなどの実用的な研究に多用されている。このような細胞塊を詳細に観察するために透明化技術が有効であると考えられる。本稿の終盤にScale法の応用としてニューロスフェロイド(Nsp)の例を挙げ解説を行う。
Scale法による透明化の基本原理
ご存じの通り、多くの生体組織は透明ではなく濁って見える。組織を構成する成分によって光が散乱し直進しにくいからである。このことは顕微鏡観察にとって大きな障害になる。散乱の原因となる物質は主として細胞膜を構成する脂質、そして細胞外基質とそれらが集合した結合組織(例えばコラーゲン繊維など)である。透明化技術の多くはこうした生物組織に由来する光散乱をできる限り低減化するために、高濃度の界面活性剤や有機溶媒を用いて積極的に組織中の脂質成分を除くという工夫をしている。
これとは異なったアプローチが筆者らの尿素を主成分とした試薬溶液を用いるScale法である。尿素はタンパク質変性剤であると同時に水を抱え込む性質がある。この性質により組織を親水化(hydration)することで散乱を低減化すると筆者らは考えている。つまり、尿素が結合組織を構成する繊維を柔軟化させながら水を滲み込ませ、同時に細胞の形質膜の脂質分子間にも水を運びこむということがScale法による透明化の主たるメカニズムであると推測している。
また、筆者らがScaleA2法の後に開発したScaleS法(SCALEVIEW-Sシリーズの試薬を用いる方法)では試薬溶液に尿素とともに糖アルコールの一つであるソルビトールが含まれている。ソルビトールも尿素と同様に高い保水能力を持つ物質である。これが組織中に水を配位する上で尿素と相乗的に作用し組織の光散乱をより低減化するように働くと考えられる。
ScaleS法に用いる溶液には低濃度のTritonX-100 [0.1-0.2 %(w/v)濃度]が含まれている。この濃度範囲ではTritonX-100による脂質の抽出効果はかなりマイルドである。そのため、細胞膜のダメージが比較的軽微である。このことは、ScaleS法で一度透明化したマウス脳組織をPBS(-)で脱透明化し、同組織から作成した超薄切片を透過型電子顕微鏡で観察することにより検証された。その結果は神経細胞の形質膜や興奮性シナプス周辺部の膜構造の超微細構造が良好な状態で保持されていることを示しており、ScaleS法がマイルドに作用することが確認された2)。
Scale法で透明化したサンプルの観察で気をつけるべき点
透明化組織の観察時のトラブルとして「透明化を行ったが像がぼやけてはっきり見えない」あるいは「像が暗い」など、観察がうまくいかないという話を聞くことが多い。個別に詳しい話を聞くと、サンプルを浸けた浸漬液(マウント液)の屈折率や対物レンズに関する情報や理解が十分でないことが大半の原因である。
共焦点レーザー走査型顕微鏡や2光子励起蛍光顕微鏡を使って透明化した厚みのある組織の深部をしっかりと観察するために特に気をつけなければならないことがある。それは対物レンズと組織の間、加えて組織とマウント液との間の屈折率のマッチングである。対物レンズと組織の間、そして組織とマウント液との間に屈折率の差がある(ミスマッチ)と組織内部で焦点がタイトでなくなり、組織の深さ方向(Z方向)に伸びて滲んだ不鮮明な観察像になったり内部の観察像が暗くなったりする。
SCALEVIEW-S試薬を含め、近年次々と開発されている透明化技術は概して高屈折率(1.43~1.56)のマウント液を用いる傾向にある。Scale法の場合、透明化した組織はマウント液であるSCALEVIEW-S4(屈折率1.47)、あるいはより高い透明性を得ることができるマウント液のSCALEVIEW-SMt(屈折率1.49)で十分に平衡化されていると考えてよい。
つまり、注意すべきポイントはマウント液と対物レンズとの間の屈折率である。これらの液の屈折率に対応する対物レンズを使って観察することが望ましい。もし、高屈折率のマウント液に対応したレンズがない場合、SCALEVIEW-S4までの試薬で透明化した後にマウント液をSCALEVIEW-A2(屈折率1.38)に置換して数時間37 ℃で平衡化し、水浸用の対物レンズで1~2 mmの深さまで観察を行うことも可能である。ただし、SCALEVIEW-S4からSCALEVIEW-A2に置換した場合、組織がやや膨潤することに留意していただきたいと思う。この詳細はProtocol Exchange で公開している8)。
観察時のトラブルを防ぐための対策として、使用するマウント液の特性や屈折率に関する情報を集め自分の対物レンズで対応可能かどうか、またレンズの作動距離についての情報もあわせて知っておく必要がある。これらの情報を観察の前に必ず確認していただきたいと思う。不明な場合は試薬メーカーと対物レンズのメーカー各社に問合わせ、目的とするサンプルの観察に適した方法について相談していただくのがベストである。以上の内容はScale法の場合だけでなく他の透明化技術を用いた場合にも共通して言えることである。
ニューロスフェロイドへのScale法の応用
固定したスフェロイド内部を顕微鏡観察することは簡単ではない。スフェロイドは細胞外基質が発達しており、細胞同士がタイトにパックされているため特に中心部分の濁りが強いからである。これまで細胞塊の内部を観察するために物理的に切断した厚さ数十 µmの切片を作製する必要があったが、小さな細胞塊から切片を作るという煩雑さと困難とを回避するためには透明化技術が有効である。アダルト海馬由来の神経幹細胞から調製したNspをAbScale法によって染色し透明化するための操作手順が富士フイルム和光純薬のホームページに紹介されている。本稿ではその手順をベースとしてやや改変を行った方法について解説する。
Nspを4 %PFA/PBS(-)で固定した後、SCALEVIEW試薬を用いてS0→A2→8 M urea solution (自作する必要がある) →A2 の順に前処理を行う。この処理を含め、以後のすべての液交換はNspが浮遊している溶液をマイルドに遠心分離(500 x g、15分間、常温)した後に、上清をできる限りピペットアウトしてから次のステップの溶液を加えて行う。前処理の過程は、Nspを一旦膨らませることで細胞間に存在する細胞外基質の柔軟性を上げる効果がある。この過程はNsp内への抗体の浸透を助長するため、そして染色後のNspの透明化を促進するために重要である。
次にdeScaleの過程でNspは再度不透明になる。この過程は後に続く免疫染色のための抗原性の再賦活化と膨らんだ組織を元のサイズに戻すという二つの意味で重要な過程である。
deScaleの後にブロッキングを行い、蛍光標識した1次抗体を用いる直接法あるいは1次抗体の後に蛍光標識化2次抗体を用いた間接法で染色を行う。間接法を行う場合は、2次抗体の反応時間および反応温度、そして洗浄法の条件は1次抗体の場合と同じである。続く染色後の再固定は反応させた抗体が離脱するのを防ぐ。スフェロイドはサイズが小さいためAbScale法の前処理により抗体が内部によく浸透する。ただし、抗体の中には浸透しにくいものがあるので、可能であれば同一の抗原に対して複数の抗体を使ってテストをしていただけたらと思う。
ここで紹介する変法では、Nspの透明化をSCALEVIEW-A2試薬によって行う。SCALEVIEW-S4による透明化をこの変法で行わない理由は、SCALEVIEW-S4は密度が高くNspが液中で浮遊しやすいからである(SCALEVIEW-A2液中にある透明化Nspは遠心分離で簡単に沈降することができる)。
AbScale法による染色、これに次ぐ透明化、そして観察という一連の操作の中で特に工夫を要するのは顕微鏡観察のためのマウントのしかたである。筆者らが通常行っているアガロースを用いたマウントのフローを図2にまとめた。このマウントの方法は主として倒立顕微鏡による観察用であるが、正立顕微鏡を用いた観察にも転用することができる。
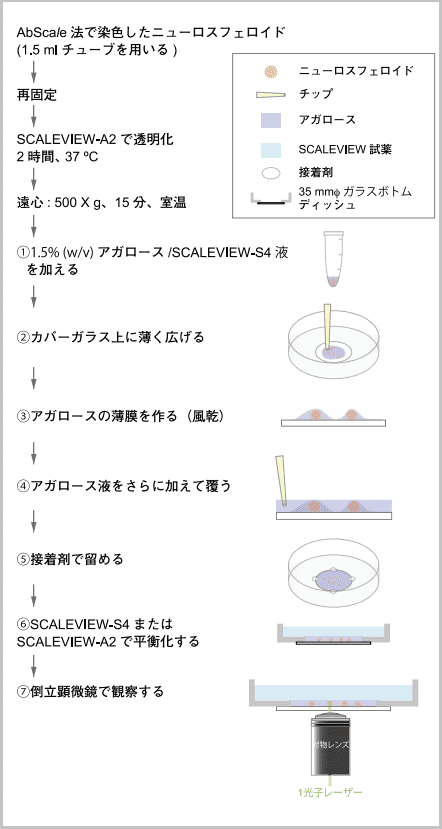
図の手順の詳細を以下に述べる。
①37~40 ℃に温度を下げた1.5 %(w/v) アガロース/SCALEVIEW-S4溶液を75 µL加える。
②ニューロスフェロイド(以下、Nspと記する)とアガロースの懸濁液をカバーガラス上に移す。次いでピペットの先端でゲルを薄く広げる。
③風乾(10分、室温)することでNspの表面にアガロースの薄膜を作る。
④風乾後にカバーグラスを貼り付けてある穴をおおう量(110 µL)の1.5 % (w/v) アガロース/SCALEVIEW-S4液 (37~40 ℃に温度を下げておく)を加えて再び風乾(10分、室温)。次いで冷蔵庫(4~8 ℃)内でアガロースを固める。
⑤アガロースゲルがはがれないように(ゲルとディッシュ底面をまたぐように)少量の瞬間接着剤をドット状に留める。接着剤を十分に固化させる。
⑥ディッシュにSCALEVIEW-S4またはSCALEVIEW-A2 を2 mL加えた後、振とうして平衡化する(1~2時間、常温)。
⑦カバーガラスに近接したNspを観察する。
(補足)
i) シリコンコートしたチップおよびチューブを使用することが望ましい(内壁にNspが付着することによるロスを防ぐ)。
ii) 1.5 %(w/v) アガロース/SCALEVIEW-S4液を溶融させる場合は、電子レンジで熱した(500W、4~5分間)後、気泡が入らないように均一に混ぜる。37~40 ℃になるように流水でボトルを冷却する。
iii) 風乾を行っても30~40 分以内であればNspが乾燥することはない。
図2.三次元免疫染色後のニューロスフェロイドを観察するためのマウントの一例
AbScale法で免疫染色および透明化したNspを上述のマウント法で不動化した。その観察像を図3に示す。また、この実験例の場合、サンプルのマウント液にSCALEVIEW-A2を用い、空浸の10倍対物レンズを備えた倒立顕微鏡で観察を行った。その結果、直径約500 µmのNsp全体をその内部も含めて問題なく観察することができた。特に、Nspのほぼ中間に位置する最大直径の部分で良好な免疫染色像およびpropidium iodide による核染色像が得られたことから、Nsp全体に抗体と蛍光色素が十分に浸透していたことがわかる。
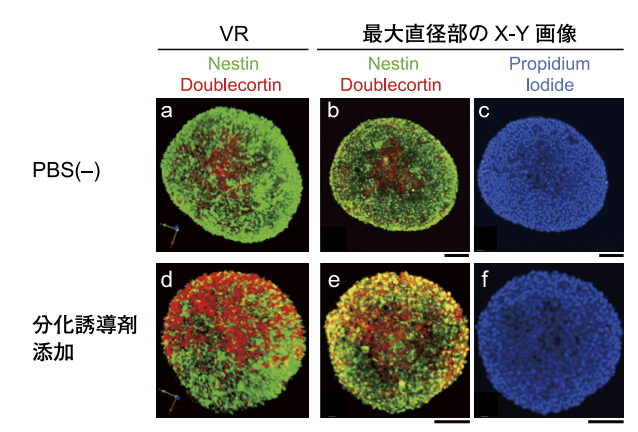
図3.三次元免疫染色後のニューロスフェロイドの観察像
a. アダルトラット海馬由来の神経幹細胞ストックからニューロスフェロイド(Nsp)を調製。培養後5日目で分化誘導剤を加えてから2日後にAbScale法で染色ならびに透明化を行い、図2に示した方法によるマウント後に倒立顕微鏡で観察した。免疫染色にはnestin (図中、緑)およびdoublecortin (図中、赤)に対する抗体を用いた。また、この実験では透明化および観察時の浸液にSCALCEVIEW-A2を用いた。a.-c. はPBS(-)を添加したコントロールNspの画像、またd.-f. は分化誘導剤を添加したNspの画像である。a. およびd. は免疫染色の三次元再構築像をpropidium iodideで核染色した(図中、青) (蛍光色素による染色を筆者らはChemScaleと呼んでいる)。c. およびf. はNspの最大直径部のX-Y面のpropidium iodideの画像である。スケールバーは100 µm (b, c, e. およびf)。以上のような使い方をすることでScale法とAbScale法がスフェロイドの観察および解析に貢献し得る技術になると考えている。
おわりに
透明化技術は現在、研究を効率的に進めるための観察を含めた一連の実用的な系を構築する段階に入っているといえる。こうした観点からBoutinら9)のScale法によるスフェロイドのハイスループット解析に関する報告はScale法の興味深い応用例を提案している。
Scale法とAbScale法はともにマウスだけでなく、ヒトの正常組織や病理組織に応用可能な技術である。組織を扱う多くの研究者の方々にぜひトライしていただきたいと筆者らは考えている。そのために本稿が何らかの助けになれば幸いである。また、Scale法による組織透明化のより詳しい内容については筆者らの総説10, 11)を参考にしていただけたら幸いである。
参考文献
- Hama, H. et al. : Nat. Neurosci., 14, 1481-1488 (2011). DOI: 10.1038/nn.2928
- Hama, H. et al. : Nat. Neurosci., 18, 1518-1529 (2015). DOI: 10.1038/nn.4107
- Economo, M. N. et al. : eLife, 5, e10566 (2016). DOI: 10.7554/eLife.10566
- Ye, L. et al. : Cell, 165, 1776-1788 (2016). DOI: 10.1016/j.cell.2016.05.010
- Tainaka, K. et al. : Annu. Rev. Cell Dev. Biol., 32, 713-741 (2016). DOI: 10.1146/annurev-cellbio-111315-125001
- 日置寛之ら:「透明化技術の現状と今後の発展-ScaleS法に焦点を当てて」, 日薬理誌 149, 173-179 (2017).
- Iwano, S. et al. : Science, 359, 935-939 (2018). DOI: 10.1126/science.aaq1067
- Hama, H. et al. : Protocol Exchange, (2016). doi : 10.1038/protex.2016.019
- Boutin, M. E. et al. : Sci Rep.,
8, 11135 (2018). DOI: 10.1038/s41598-018-29169-0 - 濱 裕ら:「組織の透明化技術」, 生体の科学, 68, 85-93 (2017). DOI: 10.11477/mf.2425200582
- 濱 裕, 宮脇 敦史:「顕微鏡観察における組織透明化技術」, 生体の科学, 64, 595-601 (2013). DOI: 10.11477/mf.2425101559
透明化技術 シリーズ開始にあたって
この度、多くの先生方のご協力により「透明化技術」に関する最新情報の連載を開始しました。ご協力いただきました先生方には、この場を借りて感謝申し上げます。
生体組織を透明化する歴史を遡ると100年以上も前になりますが、日本ではさまざまな透明化技術が近年報告されています。蛍光タンパク質観察及び抗体観察の普及と共に顕微鏡技術革新と同時に透明化技術開発も進み、目的に合わせた透明化技術を選択することが可能となってきました。今後、透明化技術を応用した生命科学研究へのアプローチが期待されています。
本シリーズは、透明化技術開発及び透明化技術の応用研究分野でご活躍されている先生方に最新の研究内容をご紹介いただきます。ぜひ、ご期待下さい。









