【連載】ペプチド医薬合成基礎講座 「第2回 ペプチド合成の基礎と近年の進歩」
本記事は、和光純薬時報 Vol.87 No.3(2019年7月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。
本連載の第1回で述べたように、近年ペプチドを基本骨格とした医薬が脚光を浴びている。今回は、液相法・固相法によるペプチド合成の基礎と、近年の進歩について述べてゆく。
ペプチド合成の概要
ペプチドの構成単位であるα-アミノ酸は、アミノ基とカルボキシ基、そして側鎖に各種の官能基を持っている。狙った構造のペプチドを作り上げるためには、これら官能基を適切に保護し、反応性を抑えておく必要がある。ペプチド合成は、保護アミノ酸同士を結合させ、脱保護して反応点を露出させ、またカップリングを行い......という工程を繰り返し、最後に全体を脱保護することで完成する。
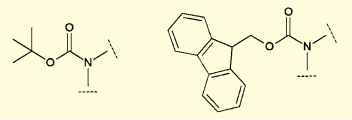
図1.Boc基(左)とFmoc基(右)
アミノ基の保護基としては、多くの場合tert-ブトキシカルボニル基(Boc基)や9-フルオレニルメチルオキシカルボニル基(Fmoc基)をはじめとしたカルバマート系の保護基が用いられる。Boc基はトリフルオロ酢酸(TFA)などによる酸処理、Fmoc基はピペリジンなどの二級アミンによってすばやく脱保護される。またカルボキシ基は、メチルエステルなどの形で保護し、最後に加水分解によって脱保護を行う。
また、アミノ酸の側鎖も、事前に適切に保護しておく必要がある。合成戦略により、保護すべき官能基は変わってくる。特殊なものでない限りは、多くの保護アミノ酸が市販されているので、入手は容易である。たとえば液相法による合成では、多くの場合α-アミノ基の保護にBoc基を用い、酸処理に耐える保護基(ベンジル基など)で側鎖を保護する戦略が採られることが多い。
ペプチド鎖の伸長は、C端側からN端側へ、すなわちカルボキシ側を保護したままの状態で、アミノ基の保護基の切断、カップリングを繰り返していく戦略が一般的である。これは、アミノ基をカルバマート型保護基で保護したアミノ酸は、カップリングの際にα位の不斉点のエピ化が起こりにくいためである。
アミノ酸の不斉炭素のエピ化は、カップリング反応や脱保護の際に必ずつきまとう問題であり、ペプチド合成の歴史はエピ化との戦いの歴史であったといってもよい。たとえば、長いペプチド鎖同士を縮合させる「収束的合成」は効率の点で優れているが、カップリングの際にエピ化が起こりやすい。このため、カップリング試薬を用いたペプチド合成では、N端側へひとつひとつアミノ酸を継ぎ足してゆく方式が基本となる。
ただし、ネイティブケミカルライゲーションという手法により、エピ化なしに長いペプチド鎖同士を結合させる手法が開発され、長鎖ペプチドの合成に威力を発揮している。これについてはこちらの記事を参照されたい。
固相法
初期のペプチド合成では、通常の有機合成と同様に、溶媒に基質と試薬を溶かす形で上記の過程を行っていた。しかしこの方法では、一段階ごとに後処理と精製を必要とし、時間と手間、熟練を必要とする。そこで、固体の担体にペプチド鎖を結合させ、その上で必要なだけペプチド鎖を伸長し、最後に担体から切り出す「固相合成法」が考案された。操作の簡便さなどから、現在ではこちらが一般的な手法となっている。
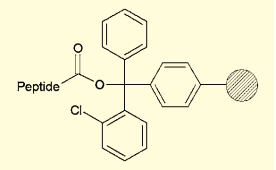
図2.リンカーの例(2-クロロトリチルリンカー)
マイルドな酸処理でペプチド切り出せる担体としては、ポリスチレンをベースとした合成樹脂がよく用いられる。樹脂に「リンカー」と呼ばれる原子団を導入したものが市販されており、ここに最初のアミノ酸のカルボキシ基を結合させる。リンカーは種類によって切断されやすさが異なるので、目的に合ったものを選択することができる。以下、ペプチド鎖N端の脱保護と、アミノ酸とのカップリングを繰り返して、ペプチド鎖を伸長させてゆく。
固相合成法では、α-アミノ基の保護基としてFmoc基を用い、酸で切除できる保護基で側鎖官能基を保護するケースが多い。最終段階で酸処理し、側鎖の脱保護と樹脂からの切り出しを同時に行う戦略が用いられる。
固相法は単純なステップの繰り返しでペプチド合成ができるため、有機合成に習熟していない者でも実施できる。機械化も可能であり、自動合成装置も市販されている。ただし、担体にペプチド鎖を縛りつけたままで最後まで合成を進めるため、途中で精製操作は一切できないという大きな制約がある。このため、各ステップの収率をできる限り向上させなければならない。
この目的のため、カップリングの際には保護アミノ酸と縮合剤を大過剰(3当量程度)用いて、完全に反応を進行させる必要がある。また、各ステップの後に徹底的に洗浄を行い、残留試薬を除去することも重要である。
ペプチド合成試薬
溶媒としては、液相法・固相法ともに、N, N-ジメチルホルムアミド(DMF)がよく用いられる。ペプチドや保護アミノ酸の溶解力が高く、固相法で用いる樹脂をよく膨潤させるためである。ただし、DMFが分解してできるジメチルアミンが残存していると、目的とするペプチドの収率低下につながる。事前に蒸留精製するか、高グレードなものを新鮮なうちに用いることが望ましい。
アミド結合を生成させるカップリング試薬には、これまで多くの研究が積み重ねられてきた。古典的なWSCD-HOBt法も液相法では十分に有用であり、通常のアミノ酸のカップリングではほぼこれで問題なく合成が行える。
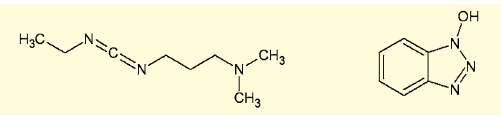
図3.水溶性カルボジイミド(WSCD、左)と1-ヒドロキシベンゾトリアゾール(HOBt、右)
固相合成の場合や、α-二置換アミノ酸のような立体障害の大きなアミノ酸をカップリングに用いたいケースでは、1-[ビス(ジメチルアミノ)メチレン]-1H-ベンゾトリアゾリウム3-オキシドヘキサフルオロホスファート(HBTU)などのカップリング試薬が多用される。
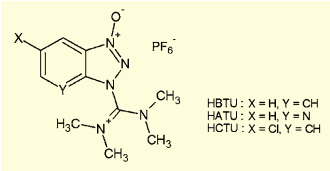
図4.HBTUとその誘導体
その他、カップリングの効率改善、エピ化の抑制を目指して、多くのバリエーションが作り出されている。ベンゾトリアゾール部分に窒素原子を導入したHATU、塩素原子が置換しているHCTUなどは活性が高く、HBTUに代わる試薬としてよく用いられるようになっている。これら縮合剤について詳細は、総説を参照されたい1)。
疎水性タグの利用
これまで見てきたように、液相法と固相法はペプチド合成における二大流派として発展を続けてきた。しかし近年、これら両者の長所を取り入れた、新たな考え方の合成法が発展しつつある。
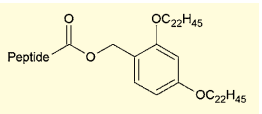
図5.Molecular hiving に用いられる疎水性タグ
東京農工大の千葉らは、Molecular hiving と称する手法を発表している2)。ペプチドのC末端に疎水性タグ(2,4-ビス(ドデシルオキシ)ベンジル基)を取り付けた上で、通常の液相法のようにペプチド合成を進めるというものだ。この状態のペプチドは、テトラヒドロフラン(THF)には問題なく溶解するが、アセトニトリルを加えると不溶性の沈殿となる。つまり、カップリング反応をTHF溶媒で行い、アセトニトリルで沈殿させた上で洗浄することにより、高速かつ簡便に不純物や余剰試薬の除去が可能になる。
この手法により、1日で5残基以上の伸長が可能になる。必要なだけペプチド鎖を伸ばしたら、10 % TFA-CH2Cl2などの酸で処理することで、容易に疎水性タグを切除できる。溶解状態で反応を行えるため、反応効率は高く、固相法のように高価な試薬を過剰量用いる樹脂に比べて疎水性タグはずっと安価であるため、全体として非常に低コストでペプチド合成が可能となっている。
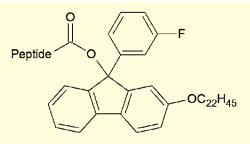
図6.AJIPHASE法で用いられる疎水性タグ
味の素社の研究陣も、同様の手法を開発しており、AJIPHASE法と名付けられている3)。こちらはタグとして長鎖アルコキシ基のついた9-フェニルフルオレニル基を用いる手法で、これを結合させたペプチドは、塩化メチレンなど塩素系溶媒には溶けるがメタノールには不溶であり、沈殿精製が可能になっている。
また最近、長鎖アルキル基を枝分かれのあるアルキル基に変えることで、溶媒抽出を行いやすくする改良法も登場した4)。これにより、ワンポットで20残基のペプチドを高純度で合成することに成功している。これらは、液相法と固相法の長所を併せ持った手法であり、低コストで大量のペプチドを合成する道を拓く。今後のペプチド医薬の発展にも、大きな影響を与えることだろう。
参考文献
- El-Faham, A. and Albericio, F. : Chem. Rev., 111, 6557 (2011). DOI: 10.1021/cr100048w
- Okada, Y. et al. : J. Org. Chem., 78, 320 (2013). DOI: 10.1021/jo302127d
- Takahashi, D. and Yamamoto, T. : Tetrahedron Lett., 53, 1936 (2012). DOI: 10.1016/j.tetlet.2012.02.006
- Takahashi, D. et al. : Angew. Chem. Int. Ed., 56, 7803 (2017). DOI: 10.1002/anie.201702931
関連記事









