【連載】ペプチド医薬合成基礎講座 「第3回 ペプチド合成の新展開 山本法とNCL」
本記事は、和光純薬時報 Vol.87 No.4(2019年10月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。
ルイス酸触媒によるペプチド合成
ペプチド合成の新しい手法について紹介する本シリーズであるが、ごく最近中部大学の山本尚・村松渉らのグループから、全く新しいアプローチのペプチド合成法1)が発表されたので、こちらをまず紹介したい。
これまでのペプチド合成におけるアミド縮合反応は、全てカルボキシ基側を何らかの形(酸ハロゲン化物、酸アジド、活性エステルなど)に変換して活性化し、ここにアミノ基が攻撃してくるという形で結合形成が行われていた。しかしこの方法では、アミノ酸α位のエピ化を起こしやすい。tert -ブチルオキシカルボニル基(Boc基)などのカルバマート系保護基で保護されたアミノ酸を結合させる場合にはこの問題は小さいが、長鎖フラグメント同士を結合させる場合には顕著となる。
このため、ペプチド鎖を伸ばしていく際には、液相法でも固相法でも、N端へ向けて一アミノ酸ずつ結合させていくことがほとんどだ。必然、ペプチド合成の工程数は長くなり、総収率は低下し、分離困難な欠陥ペプチド(途中のアミノ酸が抜けたもの)が生成するといった、種々の問題を引き起こしていた。
これに対し、山本らの方法ではN-保護アミノ酸のメチルエステルなど、活性化されていないアミノ酸誘導体を用いる。これを無溶媒でアミノ基無保護のアミノ酸tert-ブチルエステルと混合し、触媒としてルイス酸性のタンタル(Ⅴ)メトキシド(Ta(OMe)5)を加えて加熱することで、アミド結合が生成するというものだ。アミノ酸はどちらか一方を2 ~ 2 . 5 当量、Ta(OMe)5は10 mol%を用いて、40 ~70℃、72 時間程度で反応は完結する。
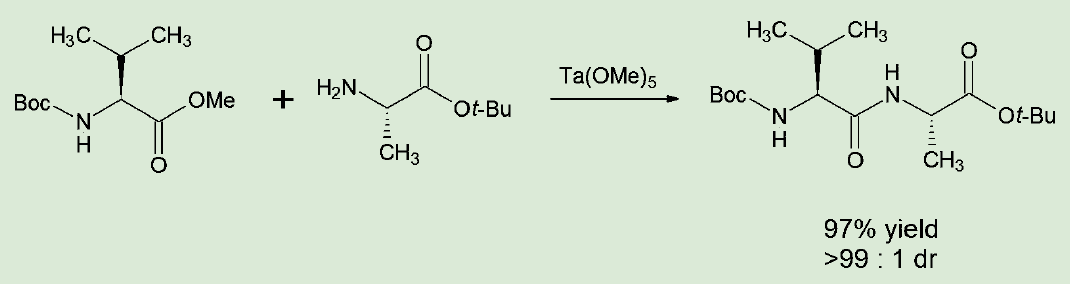
図1.タンタル触媒によるアミノ酸縮合反応
アミノ酸誘導体同士を無溶媒で混合するというのは意外な条件だが、ジクロロメタンやN,N-ジメチルホルムアミド(DMF)などの溶媒を用いると、収率は低下もしくは全く生成物が得られなくなる。無溶媒であるので、反応終了後は適当な溶媒を加え、そのままシリカゲルカラムで精製を行うという簡便な操作で目的物が得られる。
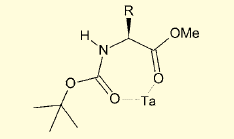
図2. タンタル触媒の配位
N端側のアミノ基保護基としては、Boc、ベンジルオキシカルボニル基(Z)、アリルオキシカルボニル基(Alloc)、2, 2, 2-トリクロロエトキシカルボニル基(Troc)、p-トルエンスルホニル基(Ts)などが利用可能で、触媒となるタンタルは、この保護基のカルボニル基酸素と、エステルカルボニル基の酸素にキレートされる形で、反応を触媒するものと考えられる。ただし9-フルオレニルメチルオキシカルボニル基(Fmoc)やフタロイル基(Pht)は、タンタルのルイス酸性のため脱保護されてしまい、この反応には適用できない。
タンパク質を構成する20種のアミノ酸のほとんどで、良好な収率でジペプチドが得られている。ただしtert-ロイシンなど、立体障害の大きいアミノ酸では収率の低下が見られた。また特筆すべきこととして、ジペプチド合成の際にアミノ酸α位のエピ化はほとんど起こらない。
さらに山本・村松らは、この手法をフラグメント同士の結合に展開している。検討の結果、こちらの場合はチタン(Ⅳ)イソプロポキシド(Ti(OPr)4)が触媒として好適であることが示されている。たとえばBoc-Ala-Met-Ala-OHとH-Gly-Ala-Ala-Ot -Buをクロロホルム溶媒中で結合させ、収率98%でほとんどエピ化なしに目的のヘキサペプチドが得られている。
今までのペプチド合成では、当量の高価な縮合試薬を用いて、一残基ずつ延長していくことになるため、極めて高コストであった。しかし今回の方法では、シンプルなタンタルまたはチタン化合物を触媒量用いるだけであり、溶媒も不要であるので、低コストかつ環境負荷も小さい。また、収束的合成によって合成工程を大幅に減らすことも可能となっており、従来に比べて1000 分の1 以下の価格でペプチドを供給できると山本は述べている。触媒として用いられるタンタルやチタンは毒性が低い元素であり、使用や廃棄に特別の配慮は不要であることもメリットだろう。
反応時間など課題もあるものの、全体として非常にポテンシャルの高い方法であることは間違いなく、今後の進展が待たれる。この後に述べるNCL法との組み合わせなどにより、さらに効率的に複雑なペプチドを作れる可能性もあるだろう。今まで供給面に難のあったペプチド医薬はもちろん、繊維材料や化粧品など広く影響を与えそうだ。
NCL 法の展開
NCL法は、無保護のペプチド鎖同士を結合させる手法で、1994年にKentらによって発表された2 - 4)。チオールエステルとシステインの持つメルカプト基とのエステル交換反応を利用し、分子内でアシル基が転位することで目的のペプチドが得られる。
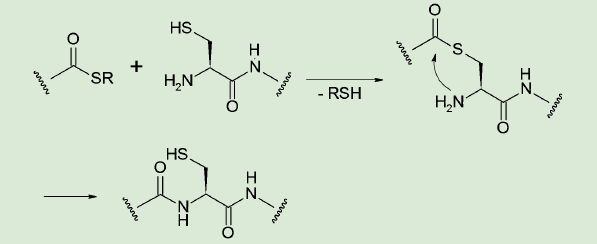
図3. NCL 法によるアミド結合生成
この方法は、結合生成できるのがシステイン残基の位置のみに限られるが、特殊な試薬などが必要ないというメリットがある。類似の方法として、アジドとホスフィンの反応(Staudinger 反応)を利用する方法、α-ケト酸とヒドロキシルアミンの反応を利用するKAHA法などが考案されているが、簡便なNCL法が最もよく使われている。NCL法は発表から四半世紀を経てさまざまな応用展開がなされており、その一部は以前に富士フイルム和光純薬㈱発行Organic Square Vol. 53で紹介しているので、そちらも参照していただきたい。
チオエステル部分は、S-アルキル型よりS-アリール型の方が置換反応が速いが、安定性などの問題もあるため、場合によって使い分けられる。チオグリコール酸メチルなどは、水溶性が高いために除去しやすい。
NCL法に必要なチオールエステルの合成法も、種々開発されている。たとえばペプチドのC末端をヒドラジドとし、ここに亜硝酸塩を作用させてアジドに変えた上で、チオールとの置換を行う方法がある4)。
また最近、ペプチドヒドラジドにアセチルアセトンを作用させてN-アシルピラゾールとし、ここにチオールを作用させる方法が報告された5)。酸化剤などを使用せずマイルドで、ワンポットでチオールエステルへの変換が行えるため、今後使用が増えそうだ。
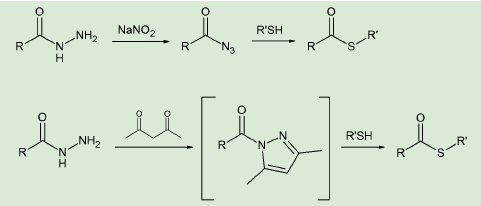
図4. チオールエステルの合成
その他、固相法で合成したペプチド鎖を、チオールエステルの形で切り出す方法もいくつも発表されている。これらは総説3 a)にまとめられているので、参考にされたい。
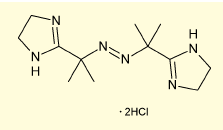
図5. VA-044
NCL法の最も大きなネックとなるのは、システイン残基のある位置でしかペプチド鎖同士の接合を行えない点だ。そこで、NCLを行った後にシステインを脱硫し、アラニンに変える方法が広く用いられている。アラニンはタンパク質内に最も多く存在するアミノ酸なので、これによって合成戦略の自由度が大幅に上がった。脱硫方法としては、Raneyニッケルがよく用いられていたが、効率などの点で問題がある。近年では、水溶性のラジカル開始剤VA- 044とホスフィン類の組み合わせによって脱硫を行うケースが多い。
こうした手法の組み合わせにより、以前では考えられなかったサイズのポリペプチドが化学合成できるようになっている。さらに近年では、遺伝子組み換えの手法で生産したペプチド鎖に、NCLで合成ペプチド鎖を導入する合成法も行われるようになっている。この方法によれば、遺伝子組み換え法だけでは不可能な糖タンパク質や、蛍光タグでラベルしたタンパク質の合成も可能になる。たとえばPrattらは、140残基から成り、87番目のセリンに糖が結合したタンパク質である、α-シヌクレインの全合成に成功している6)。
またCamareroらは、18残基から成る環状ペプチドθ-ディフェンシン1の合成を行っている7)。遺伝子組み換え法で作ったペプチド鎖をペプチダーゼで処理し、NCLの手法でN端とC端を結合させ、環化に成功している。環状ペプチドは医薬の骨格として有望であるから、NCLの応用として注目すべきアプローチといえるだろう。
参考文献
- Muramatsu, W. et al. : J. Am. Chem. Soc., 141, 12288 (2019). DOI: 10.1021/jacs.9b03850
- Dawson, P. E. et al. : Science, 266, 776 (1994). DOI: 10.1126/science.7973629
- NCL の総説:a) Agouridas, V. et al. : Chem. Rev., 119, 7328 (2019). DOI: 10.1021/acs.chemrev.8b00712 ; b) Conibear, A. C. et al. : Chem. Soc. Rev., 47, 9046 (2018). DOI: 10.1039/C8CS00573G
- Fang, G. et al. : Angew. Chem. Int. Ed., 50, 7645 (2011). DOI: 10.1002/anie.201100996
- Flood, D. T. et al. : Angew. Chem. Int. Ed., 57, 11634 (2018). DOI: 10.1002/anie.201805191
- Lewis, Y. E. et al. : ACS Chem. Biol., 12, 1020 (2017). DOI: 10.1021/acschembio.7b00113
- Gould, A. et al. : Mol. BioSyst., 8, 1359 (2012). DOI: 10.1039/C2MB05451E
関連記事









