【連載】核酸医薬合成基礎講座 「第1回 オリゴヌクレオチド合成」
本記事は、和光純薬時報 Vol.86 No.1(2018年1月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

タンパク質・核酸・糖鎖の 3 つは、生体において重要な役割を担う高分子としてよく知られる。タンパク質は 20 種のアミノ酸、核酸は 4 種のヌクレオチド、糖鎖は数種の糖が連結したものであり、その組み合わせと配列が機能を決定する。従って、望みの配列の生体高分子を作り出す手法は、生化学にとって鍵というべき技術であり、古くから多くの努力がなされてきた。結果、現在ではそれぞれ多くの知見が蓄積されており、複雑長大な生体高分子の化学合成がいくつも実現している。
核酸合成の技術も、もちろん古くから研究されている。この分野の先鞭をつけたのは、遺伝暗号の解読でノーベル生理学・医学賞を受賞した H. G. Khorana で、1950 年代後半のことであった。その後も核酸合成の手法には多くの改良が重ねられ、DNA のプライマー合成などに欠かせない技術となっている。本稿では 4 回にわたり、核酸(オリゴヌクレオチド)合成の基礎について述べてゆく。
核酸の基礎
はじめに、核酸について基礎事項をおさらいしておこう。核酸はデオキシリボ核酸(DNA)とリボ核酸(RNA)の総称であり、前者は主に遺伝情報の貯蔵、後者は情報の伝達やタンパク質合成などの役割を担う。
両者はいずれも、5 炭糖に核酸塩基が結合した「ヌクレオシド」を単位としてできている。この糖を成す炭素原子には、アノマー炭素から順に 1' 位から 5' 位までの番号が振られている。結合の「腕」となるのは 3' 位と 5' 位のヒドロキシ基で、これらがリン酸エステル結合を介して長く連結することで、核酸の鎖ができ上がっている。また、核酸の鎖の両端を区別する際、この糖の位置記号をとってそれぞれ「3' 末端」「5' 末端」という呼び方をする。
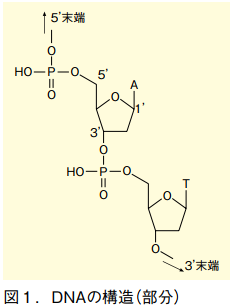
DNA と RNA の大きな差は、5 員環の糖部分にある。RNA の糖は 2' 位にヒドロキシ基が結合しているリボースだが、DNA ではこのヒドロキシ基を欠いたデオキシリボースとなっている。これは一見小さな差と見えるが、RNA では 2' 位ヒドロキシ基がリン酸部位に求核攻撃しうるため、リン酸ジエステル結合が切断を受けやすくなる。
DNA が安定で分解を受けにくいのに対し、RNA が触媒能を示す(リボザイム)などアクティブにはたらく化合物であるのは、このあたりに起因している。このため、RNA は DNA より不安定であり、実験の際に取扱いに注意を要する。
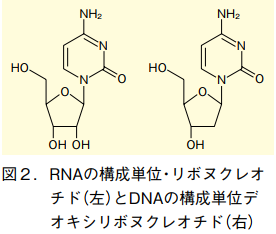
また、DNA と RNA におけるヒドロキシ基の有無という差は、糖の 5 員環のコンホメーションに影響を与え、これが分子全体の立体構造にも反映される。DNA は二重らせん構造をとりやすいのに対し、RNA は一本鎖のまま分子内で水素結合して複雑な立体構造をとるケースが多い。
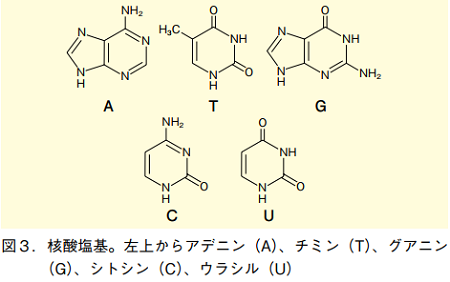
さらに、DNA と RNA では、核酸塩基の種類も異なる。DNA ではアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の 4 種類だが、RNA ではチミンの代わりにウラシル(U)が使われている。このうちアデニン、シトシン、グアニンはアミノ基を持っており、核酸合成の途中にはこれを保護する必要がある(次回以降に詳述)。
広がる核酸の応用研究
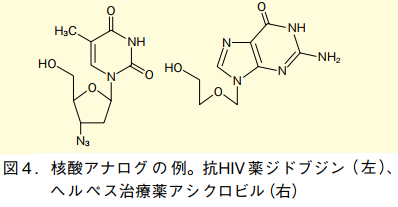
近年、オリゴヌクレオチドの化学は急速な広がりを見せている。たとえば医薬分野においては、現在全盛の抗体医薬に続く新たなジャンルとして、核酸医薬が注目を集めている。この核酸医薬は、抗がん剤や抗ウイルス剤などに用いられる「核酸アナログ」(核酸塩基やヌクレオチドの構造を一部改変した形の医薬)とは全くの別物だ。核酸医薬は、ヌクレオチドが数個から百数十個つながった、オリゴヌクレオチドを医薬として用いる。
一口に核酸医薬といっても、多くのアプローチがある。アンチセンス核酸と呼ばれる手法は、標的の mRNA に相補的な配列の DNA や RNA を投与し、これと二本鎖を形成させてしまう(ハイブリダイゼーション)ことによって、タンパク質の発現を制御しようとするものだ。また、二本鎖 RNA を投与することで、配列特異的に標的 RNA が分解される現象(RNA 干渉)を利用する方法も、現在盛んに研究されている。
また、標的タンパク質に特異的に結合できるよう設計された核酸を用いるアプタマー医薬と呼ばれる手法もある。眼病のひとつである、加齢黄斑変性症の治療薬ペガプタニブ(商品名マクジェン)が、最初に実用化されたアプタマー医薬である。
核酸の医薬への応用に際しては、核酸(特に RNA)は体内で分解されやすいことが問題となる。人体は、侵入してきたウイルスへの防御策としてヌクレアーゼを持っており、外敵の核酸を分解してしまうのだ。
このため、核酸を医薬として用いるためには、分解を防ぐために化学修飾が施されることが多い。例えば、サイトメガロウイルス感染症治療薬のホミビルセンは、リン酸ジエステル結合部分に硫黄原子が導入され、ヌクレアーゼに対する抵抗性を持たせている。その他、近年の核酸医薬には構造にさまざまな工夫が施されており、合成法にも新たな手法が必要となっている。
人工核酸
もちろん医薬以外の分野でも、核酸の研究展開は広く進められている。アデニン(A)、チミン(T)、シトシン(C)、グアニン(G)、ウラシル(U)という天然の核酸塩基に代えて、人工的に設計された核酸塩基を導入し、さまざまな機能を持たせようとするアプローチがそのひとつだ。塩谷光彦らによる、金属イオンへの配位結合を利用した人工 DNA1)、平尾一郎ら 2)や F. E. Romesberg ら 3)による人工塩基対などは、その代表的なものに挙げられる。
また、リボースやデオキシリボースの代わりに人工の糖を導入したものも、さまざまなタイプが提案されている。例えば、リボースの 5 員環を架橋して二環性骨格とした LNA(locked nucleic acid)・BNA(bridged nucleic acid)といったものが開発されており 4)、これらは天然の DNA や RNA に対する親和性が高いため、核酸医薬などへの応用が期待されている。
DNA を単に素材として用い、さまざまな形を作り上げる「DNA ナノテクノロジー」も急速に進展している分野だ。星型や顔の形、多面体構造など、驚くほど複雑な形状を自由に作り出す手法が開発されており、これらは「DNA オリガミ」とも総称される 5)。
オリゴヌクレオチド合成の手順
こうした多様なニーズに応えるため、核酸合成の技術はさらに重要性を増しつつある。オリゴヌクレオチドの合成の基本的な考え方は、他の生体高分子合成とほぼ同様である。
(1)適切に保護された単量体を用意する
(2)反応点を脱保護する
(3)次の単量体を結合させる
(4)(2)及び(3)のステップを、必要な数だけ繰り返す
(5)全体を脱保護する
天然の核酸合成の際には、5' から 3' 側へ向けて鎖が延長されていく。化学合成の場合にはどちら向きに伸ばすことも原理的に可能だが、天然とは逆に 3' 側から 5' 側へ鎖を延長していくケースが多い。これは、5' ヒドロキシ基が一級であるために反応性が高く、延長反応が行いやすいという事情による。
近年ではオリゴヌクレオチド合成には、速度や操作の簡便さといった観点から、固相合成法が用いられることが多い。すなわち、最初の単量体を、固体の担体(ガラスビーズなど)に結合させた上で、反応点の脱保護・単量体導入を必要な回数繰り返す。こうしてヌクレオチド鎖を成長させた上で、最後に全体の脱保護及び担体からの切り出しを行ない、目的のオリゴヌクレオチドを得るというものである。
通常の合成法(液相合成)では、脱保護・結合生成などの工程のたびに、抽出・精製などの操作を必要とし、合成に長い期間と多くの手間と熟練を要する。しかし固相合成法では、全ての反応がビーズ上で進行し、過剰の試薬や反応で生じる副生成物などは洗浄処理によって簡便に除去できる。このため煩雑な操作は必要なく、迅速かつ少ない手間で目的物が得られ、自動化も可能である。ただし固相法では、途中で精製を行なうことができないため、不純物の除去が不可能という点が問題となる。
例えば、50 塩基のオリゴヌクレオチドを合成する場合を考えてみよう。もし、1塩基伸ばすサイクルの収率が 95%であったとしたら、目的物の収率は約 7.7%に過ぎず、1 塩基足りない 49 量体が約 20.2%生成する計算となる。クロマトグラフィーなどの精製技術でこれらを分離するのは、極めて困難である。
一方、各段階の収率が 99%であったなら、目的物の収率は約 60.5%、49 量体の収率が約 30.5%となる。さらに、各段階の収率を 99.9%にまで上げることができたら、総収率は約 95.1%まで上昇する。各ステップの収率を徹底的に向上させることが、いかに重要かわかる。
このため固相合成法を行なう場合には、試薬を大過剰量使い、洗浄を徹底的に行なって、できる限り収率の向上を図る必要がある。また、キャッピングと呼ばれる処置を施すことで、不完全なオリゴヌクレオチド鎖の生成を抑えることも行われる。こうした詳細については、次回以降に述べてゆきたい。
参考文献
- Tanaka, K. et al. : Science, 299 , 1212 (2003). DOI: 10.1126/science.1080587, Tanaka, K. et al. : Nat. Nanotechnol., 1, 190 (2006). DOI: 10.1038/nnano.2006.141
- Kimoto, M. et al. : Nat. Biotechnol, 31, 453 (2013). DOI: 10.1038/nbt.2556
- Maryshef, D. A. et al. : Nature, 509 , 385 (2014). DOI: 10.1038/nature13314
- Obika, S. et al. : Tetrahedron, 54 , 3607 (1998). DOI: 10.1016/S0040-4020(98)00094-5
- Hong, F. et al. : Chem. Rev., 117 , 12584 (2017). DOI: 10.1021/acs.chemrev.6b00825
》関連ページ:核酸合成試薬









