【連載】核酸医薬合成基礎講座 「第4回 オリゴヌクレオチド合成におけるキャッピング及び酸化・硫化反応」
本記事は、和光純薬時報 Vol.86 No.4(2018年10月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

前回までに、オリゴヌクレオチド合成における官能基の保護及び脱保護、カップリング反応について記してきた。今回は、キャッピング及び酸化・硫化反応について解説し、全体を総覧したい。
キャッピング
何度も述べている通り、核酸合成においては一段階ごとの収率をできる限り 100%に近づけなければならない。もしカップリング反応が完全に進行せず、未反応のヒドロキシ基が残ったまま次のステップに進むと、目的とするオリゴヌクレオチドから、一塩基だけ抜けた形のものができてしまう。これらを精製操作によって分離するのは、現代の技術をもってしても至難の業である。
これを防ぐため、カップリング反応終了後、「キャッピング」という操作を行う。大過剰の無水酢酸で処理することで、未反応のヒドロキシ基をアセチル化し、「キャップ」することを指す。こうしてそれ以上の核酸鎖延長を防いでおけば、最終段階での精製が容易になる。
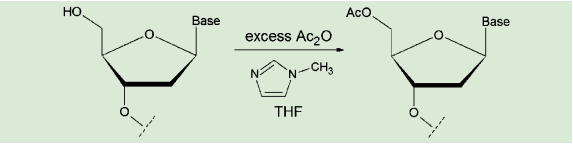
図1. キャッピングの工程
キャッピングは、ヌクレオチド鎖の結合した担体に、無水酢酸と 1-メチルイミダゾール(またはジメチルアミノピリジン)のテトラヒドロフラン溶液を加え(ここにピリジンを加えることもある)、数分処理することで行われる。これらの試薬があらかじめ溶解されたキャッピング用溶液が市販されているので、これを用いるのが簡便である。
酸化反応
前回述べたホスホロアミダイト法によるカップリングでは、亜リン酸エステル結合が生成される。これは安定性がやや低く、さらなる延長反応の際に副反応を起こす危険がある。これを防ぐため、キャッピングが済んだらすぐに酸化反応を行い、安定なリン酸エステルに変換する必要がある。
酸化剤としては、安価かつ簡便なヨウ素(I2)が最もよく用いられる。ヨウ素の水 / テトラヒドロフラン溶液(0.02 〜 0.1M)に、ピリジンやルチジンなどの弱塩基を加えたもので、数分間処理する。これもまた、あらかじめ各種濃度に調製された溶液が市販されており、適切なものを選んで使用することができる。
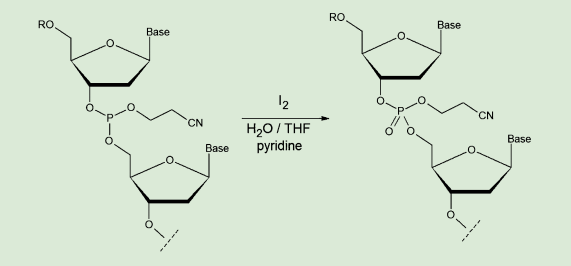
図2. 酸化工程
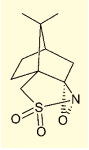
図3. (10-カンファースルホニル)オキサジリジン
特殊な塩基を組み込んでいる場合など、含水溶媒や塩基性溶液による処理ができない場合には、次亜塩素酸tert-ブチル(tBuOCl)を用いて酸化を行う例がある1)。また、(10-カンファースルホニル)オキサジリジンを用いるケースもある2)。
硫化反応
近年、オリゴヌクレオチドを医薬として応用する、核酸医薬が急速に注目を集めている。ただし核酸医薬の問題点に、人体内のヌクレアーゼによってリン酸エステル結合が切断されてしまい、患部に到達する前に医薬分子が分解されてしまうことが挙げられている。
そこで、酵素の標的となるリン酸エステル結合を、チオリン酸エステル結合(ホスホロチオエート)に変換することが広く行われている。ホスホロチオエート結合を持つオリゴヌクレオチド鎖は、ヌクレアーゼに対する耐性を持ちつつ、ワトソン =クリック塩基対の形成は可能であり、アンチセンス鎖とのハイブリダイゼーションなどは問題なく行える特徴を持つ。また、簡便で低コストに合成できるため、ホミビルセン、オブリメルセン、アリカホルセンなど多くのアンチセンス型核酸医薬が、このホスホロチオエート結合を採用している。
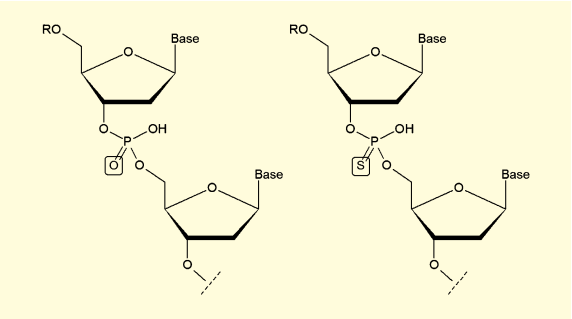
図4. 通常のリン酸ジエステル結合(左)と、ホスホロチオエート(右)
ホスホロチオエートの合成は、先に述べた亜リン酸エステルの酸化の代わりに、硫化反応を行うことで達成される。この目的に、当初用いられたのは分子状イオウ S8 であった。その後、フェニルアセチルジスルフィド、Beaucage 試薬他、いくつかの硫化剤が試されている。
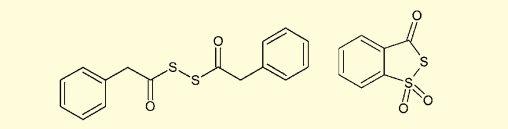
図5. フェニルアセチルジスルフィド(左)と Beaucage 試薬(右)
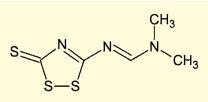
図6. 硫化剤 DDTT
現在ではこの目的に、安定性及び反応性に優れた、((ジメチルアミノメチリデン)アミノ)-3H-1, 2, 4- ジチアゾリン -3- チオン(DDTT)が最もよく用いられている。オリゴヌクレオチド鎖の結合した担体を、DDTT の 0.03 〜 0.1M 溶液で 30 秒〜 5 分程度処理するだけで、硫化が進行する。
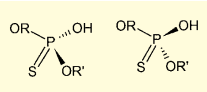
図7. ホスホロチオエートのキラリティ
ただしホスホロチオエート結合は、通常のリン酸ジエステル結合と異なり、リン原子上にキラリティが発生する。当然、DDTT などによる硫化反応では、立体選択性はない。たとえばアンチセンス型核酸医薬のミポメルセンは 20 量体のオリゴヌクレオチドであり、19 ヶ所のホスホロチオエート結合を持つ。このため、219=524,288 種類の異性体が存在するが、ミポメルセンはこれらの混合物のまま製造・販売されている。
しかし、立体的に純粋なミポメルセンを合成してみたところ、立体化学の差が薬理作用に大きな影響を及ぼすことが判明している3)。低分子医薬同様、立体選択的な合成が望ましいのは明らかである。
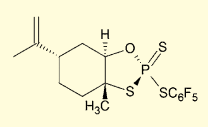
図8. キラルホスホロチオエート合成試薬
ごく最近、立体選択的なホスホロチオエートの合成法がScience 誌に掲載された4)。従来のホスホロアミダイト法と、DDTT などによる硫化のステップを踏むのではなく、右図のようなリモネン由来の試薬を、順次保護されたヌクレオシドと反応させることで、直接にキラルなホスホロチオエート結合を得ている。リモネンは両鏡像異性体が安価に手に入るため、比較的低コストで両ジアステレオマーを合成可能である。
簡便な操作によって、高立体選択的なホスホロチオエート結合生成が行える点で、この反応は優れている。ただしカップリングの収率は 61 ~ 97%にとどまっており、長いオリゴヌクレオチド鎖をこの方法のみで合成するのは、現状では困難を伴うとみられる。
合成のステップ
以上、ここまで主に紹介してきた、ホスホロアミダイト法によるオリゴヌクレオチドの固相合成をまとめると、次のようになる。各段階の反応の後、徹底的に洗浄を行い、余分な試薬や副生成物を除去することが肝要である。
- 担体に、最初の保護されたヌクレオチドを導入する(購入も可)
- 5' 位の脱保護(トリクロロ酢酸)
- カップリング(ホスホロアミダイト)
- キャッピング(無水酢酸)
- 亜リン酸エステルの酸化(ヨウ素)
- 2~5の工程を繰り返し、必要なだけ鎖を延長
- 脱保護及び担体からの切り出し(濃アンモニア水)
ホスホロチオエート合成の場合も、ほぼこれと同じ手順を踏む。ただし、通常の核酸合成の場合はキャッピングのあとで酸化を行うが、ホスホロチオエート合成の場合はカップリングの直後に DDTT などで硫化を行い、その後でキャッピングを行う。
すでにこうした核酸類をコンピュータ制御のもと、自動で合成する機械が市販されており、数十量体の DNA を短時間で作り出せるようになっている。RNA やホスホロチオエートなどにも対応可能なものが出てきているが、特殊な核酸を含むものなどは手動での合成が必要なケースも多い。
参考文献
- Alul, R. H. et al.: Nucleic Acids Res., 19, 1527 (1991). DOI: 10.1093/nar/19.7.1527
- Manoharan, M. et al.: Org. Lett., 2, 243 (2000). DOI: 10.1021/ol9910518
- Iwamoto, N. et al.: Nat. Biotechnol., 35, 845 (2017). DOI: 10.1038/nbt.3948
- Knouse, K. W. et al.: Science, DOI: 10.1126/science.aau3369
》関連製品:核酸合成試薬









