【連載】核酸医薬合成基礎講座 「第2回 オリゴヌクレオチド合成における保護・脱保護」
本記事は、和光純薬時報 Vol.86 No.2(2018年4月号)において、サイエンスライター 佐藤 健太郎 様に執筆いただいたものです。

核酸の人工合成は、生化学における重要技術であり、これまで多くの工夫が積み重ねられてきた 1)。核酸の効率のよい合成を目指すには、官能基の適切な保護と脱保護が不可欠となる。これまでの核酸合成研究の歴史は、保護基の開発の歴史と言っても過言ではなく、今も保護基の選択が合成の可否を大きく左右することは変わっていない。そこで今回は、核酸の保護基について述べてゆきたい。
核酸合成の戦略
ペプチド・糖鎖・核酸という 3 種の生体高分子の構造は、互いに全く異なっている。ただしその人工合成の基本戦略には共通する部分が多く、次のようにまとめられる。
(1)適切に保護された単量体を用意する
(2)反応点を脱保護する
(3)次の単量体を結合させる
(4)(2)および(3)のステップを、必要な数だけ繰り返す
(5)全体を脱保護する
多様な官能基を側鎖に持つペプチドや、複雑な立体構造を持ち、多数のヒドロキシ基を区別して保護しなければならない糖鎖に比べれば、核酸の合成はかなり単純といえる。とはいえ、現在よく用いられる戦略にたどり着くまでには、多くの努力が払われている。
核酸合成において、保護すべき官能基は核酸塩基のアミノ基と、糖部分のヒドロキシ基である。両者の脱離条件はオルソゴナル――すなわち、一方の脱離条件でもう一方は安定であり、その逆も同様でなければならない。以下に、よく用いられる合成法における保護基について述べてゆく。
核酸塩基の保護基
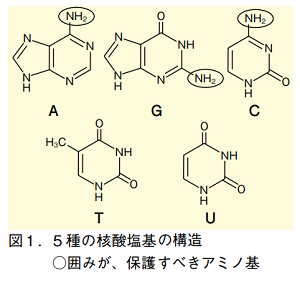
アデニン(A)、グアニン(G)、シトシン(C)のアミノ基は、そのままでは核酸鎖延長反応の際に望まぬ副反応を起こすため、保護しておく必要がある。チミン(T)・ウラシル(U)は反応性の官能基を持たないため、保護の必要はない。
これらアミノ基の保護基としてよく用いられるのは、ベンゾイル基(Bz)やアセチル基(Ac)、イソブチリル基などのアシル基である。中でも、ベンゾイル基は常用される。これらは酸処理や塩基性加水分解条件に対してかなり安定であり、ヌクレオチド(またはデオキシヌクレオチド、以下同様)鎖延長反応においても切断や副反応を起こさない。
近年では、保護された各種ヌクレオシド類が市販されているため、こちらを使用することが普通である。ただし、特殊な核酸を合成したい場合などには、保護ヌクレオシドを自製する必要がある。
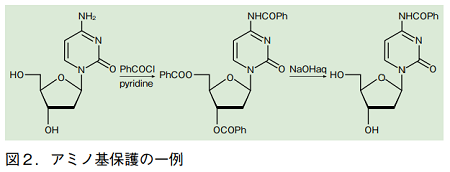
保護基の導入には、2 段階反応がよく用いられる。すなわち、保護したいヌクレオシドに対して塩基存在下で過剰量の塩化アシルを加え、核酸塩基のアミノ基と、糖部分のヒドロキシ基を一挙にアシルかする。その後、アルカリ水溶液でエステル部分を切断して、塩基のアミノ基のみがアシル化された誘導体を得る。
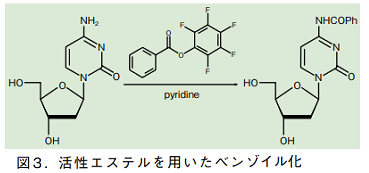
また、安息香酸ペンタフルオロフェニルをシチジンに作用させることで、一段階で核酸塩基のみをベンゾイル化する別法もある 2)。
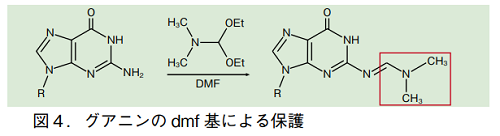
これらアシル基は、合成の最終段階でまとめて脱保護される。多くの場合、50℃の濃アンモニア水にて 5 時間程度処理することで、アシル基は切断される。ただし、イソブチリル基で保護されたグアニンのアミノ基の場合などでは、この条件にかなり抵抗する。この場合は保護基として、アンモニア水処理によってより速く切断されるジメチルホルムアミジル基(dmf)を用いることがある 3)。導入は、ジメチルホルムアミド(DMF)中、過剰量のジメチルホルムアミドジエチルアセタールを加えて室温で撹拌することで行う。
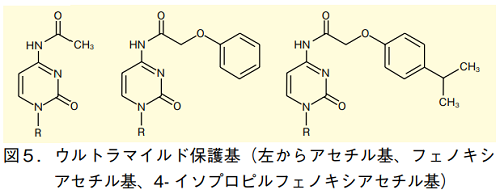
それでも脱保護が難しいことが予想される場合には、「ウルトラマイルド保護基」と呼ばれる、アセチル基(Ac)、フェノキシアセチル基(Pac)、4-イソプロピルフェノキシアセチル基(iPrPac)などが用いられる。導入の手順は、先のアシル化と同様である。これらは、33%アンモニア水と 40%メチルアミン水溶液の混合溶液により、室温で脱保護可能である 4)。ただしウルトラマイルド保護基で保護された化合物は、溶液状態で長期保存すると徐々に分解するため注意が必要である。
糖部分の保護基
DNA のデオキシリボースは 3'位と 5'位の 2 ヶ所、RNA のリボースは 2'位、3'位と 5'位の 3 ヶ所にヒドロキシ基を持つ。ただし、通常の合成法では 3'位は反応点となるため、保護は行われない。
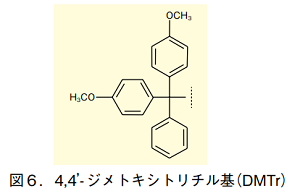
5'位ヒドロキシ基の保護には、多くの場合 4,4'-ジメトキシトリフェニルメチル基(通称 4,4'-ジメトキシトリチル基、DMTr)が用いられる。2 つのメトキシ基によってトリチルカチオンが安定化されているため、弱酸処理によって容易に切断できる。また極めてかさ高いため、一級ヒドロキシ基である 5'位のみを選択的に保護できる。
DMTr 基の導入は、アミノ基が保護されたヌクレオシドに対し、塩基の存在下で塩化 4,4'-ジメトキシトリフェニルメチル(DMTr-Cl)を作用させることで行える。二級の 2'位及び 3'位ヒドロキシ基とは区別し、5'位ヒドロキシ基のみを保護できる。
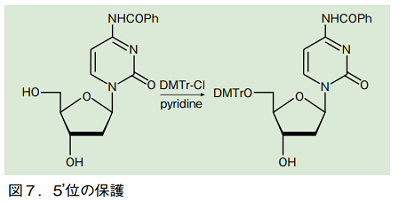
DMTr 基の脱保護は、2 ~ 3%のジクロロ酢酸またはトリクロロ酢酸の、ジクロロメタン溶液で数分処理することで完了する。切断によって生ずるジメトキシトリチル基のカチオンがオレンジ色に発色するため、反応の進行を肉眼で確認できる。
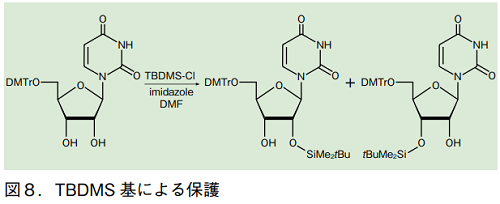
RNA 合成を目的とする場合、さらに 2'位ヒドロキシ基を保護しなければならない。この目的には、tert-ブチルジメチルシリル基(TBDMS)がよく用いられる 5)。核酸塩基のアミノ基及び、5'位のヒドロキシ基が保護されたヌクレオシドに対し、1 当量の TBDMS-Cl を作用させて合成する。ただしこの場合、3'位がシリル化されたものも生成するので、この両者をシリカゲルカラムクロマトグラフィーなどの手段で、慎重に分離する必要がある。
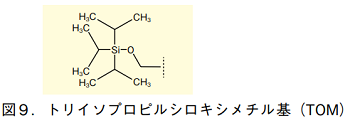
また、トリイソプロピルシロキシメチル基(TOM)も、2'位の保護に用いられる。TBDMS 基と TOM 基はいずれも、フッ化テトラブチルアンモニウム(TBAF)など、フッ化物イオンによる処理で脱保護できる。
次回以降で、ヌクレオチド鎖延長反応の実際を取り上げてゆく。
参考文献
- 核酸合成全般の総説:a)Reese, C. B. : Org. Biomol. Chem., 3, 3851 (2005).; b)日本化学会 編:実験化学講座 第5版16巻「有機化合物の合成IV カルボン酸・アミノ酸・ペプチド」(丸善).
- Igolen, J. and Morin, C. : J. Org. Chem., 45, 4802 (1980). DOI: 10.1021/jo01311a061
- McBride, L. J. et al. : J. Am. Chem. Soc., 108 , 2040 (1986). DOI: 10.1021/ja00268a052
- Reddy, M. P. et al. : Nucleosides Nucleotides, 16, 1589 (2006). DOI: 10.1080/07328319708006236
- Usman, N. et al. : J. Am. Chem. Soc., 109 , 7845 (1987). DOI: 10.1021/ja00259a037
》関連ページ:核酸合成試薬









