【連載】ミクログリア研究の最前線−基礎から臨床へ− 「第6回 ミクログリア-アストロサイト連関による脳卒中の制御」
本記事は、和光純薬時報 Vol.89 No.4(2021年10月号)において、山梨大学大学院 総合研究部 医学域 薬理学講座 小泉 修一様に執筆いただいたものです。
はじめに
グリア細胞が脳機能に果たす役割が次々と明らかにされている。特に種々の脳疾患時には、グリア細胞が、素早く、大きく、多様に変化することから、これらグリア細胞の変化が脳の異常及び修復過程で重要な役割を果たすのではないか、と考えられるようになっている。これらの仮説は、少しずつ受け入れられるようになってきているが、明らかにすべき課題が幾つも残されている。例えば、グリア細胞研究はin vitroとin vivoの結果の乖離が大きく、これまでin vitroのみで得られていた実験結果は単純にin vivoには外挿出来ないことである。
また、これまでの研究はミクログリア、アストロサイト、オリゴデンドロサイト等、それぞれのグリア細胞種毎に分けた研究が多く、異種グリア細胞間コミュニケーションの結果として脳機能が制御されている、との意識が希薄であった点である。もちろんグリア細胞研究の歴史と経験はまだまだ浅く、先ずは各グリア細胞の性質を明らかにすることは非常に重要であるが、最近の研究ではグリア細胞はアセンブリとして異種グリア細胞間で連携することで脳機能を制御している可能性が様々な形で示唆されるようになってきた。
本稿では、in vivo脳卒中モデルにおけるミクログリア−アストロサイト連関に注目し、そのコミュニケーションが脳機能制御に果たす役割の重要性について述べる。
ミクログリア-アストロサイト連関
ミクログリアは脳内外環境の変化に非常に敏感で、微細な変化を感知し、脳変化に先行して変化する。例えばミクログリアは、中年期にすでに活性化し老化を先導するし1)、筋萎縮性側索硬化症等の神経変性疾患では発症前に活性化し疾患の発症・難治化2)に関係する。活性化したミクログリアは直接神経細胞の機能を制御するが、アストロサイトに作用することで脳機能に影響する。外傷性脳損傷モデルでは、先ずミクログリアが傷害を感知してそれをアストロサイトに伝えることで保護機能を発揮し3)、また炎症を感知したミクログリアはアストロサイトにその情報を伝えることで神経細胞の機能を制御する4)。
非侵襲的な虚血ストレスを先行して経験すると、その後の侵襲的虚血に対する抵抗性が獲得できる現象「虚血耐性」は、実験的にも臨床的にも良く知られている(図A, B)。一過性中大脳動脈閉塞(MCAO)モデルマウスにおいて、先ず最初に強い変化が認められる細胞はミクログリアであり、次いでアストロサイトが変化する5)。顕著な傷害を起こさない非侵襲的MCAO(プレコンディショニング、PC)であっても、敏感なミクログリアは活性化型に変化する。
また、非侵襲的MCAO以外のPCによっても虚血耐性が誘導されるクロス虚血耐性現象が知られているが、クロス虚血耐性を誘導する代表的なPCはグラム陰性細菌細胞壁成分のlipopolysaccharide (LPS)である。LPSは中枢では特にミクログリアのToll様受容体4に強く作用することから、虚血耐性誘導にミクログリアが必須であることが示唆されている。
これらミクログリア性虚血耐性誘導メカニズムには、Ⅰ型インターフェロンを介した経路が強く関連しているが、他にもミクログリア依存的グリア伝達物質、サイトカイン及び神経栄養因子等も大きな役割を有している。ミクログリアは、これらにより神経細胞に直接的に作用するだけでなく、アストロサイト等の他種グリア細胞に作用することで間接的に虚血耐性を誘導するメカニズムを有しており、近年は後者の重要性が示唆されている。
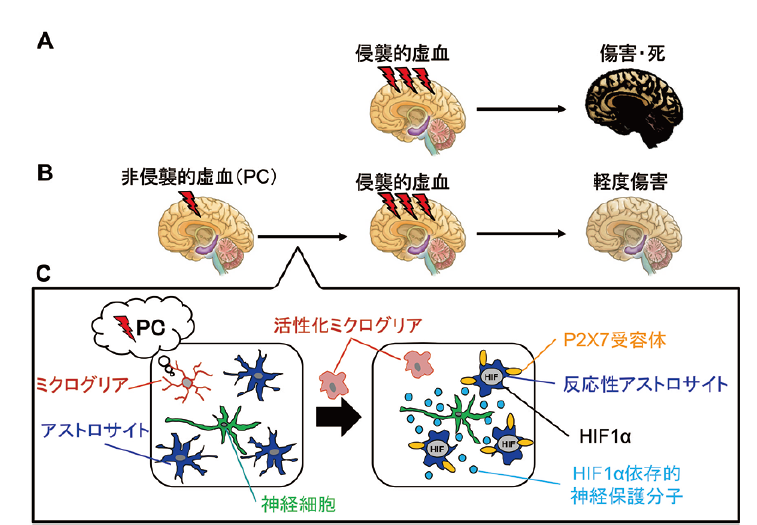
図.グリアコミュニケーションによる虚血耐性獲得メカニズム
A. 侵襲的脳虚血により神経細胞は重度の傷害または死に至る。B. 非侵襲的虚血(PC)を経験すると、侵襲的虚血に対して抵抗性を獲得する虚血耐性が誘導される。
C. PCのような軽度の刺激は、先ずミクログリアが感知する。ミクログリアは活性型ミクログリアに変化し、直接虚血耐性誘導に関与する一方、アストロサイトの活性化(反応性アストロサイト)を誘導する。反応性アストロサイトは複数のメカニズムで虚血耐性形成に貢献するが、特にP2X7受容体発現及びP2X7受容体依存的HIF1α発現による神経保護メカニズムは持続的かつ強力な虚血耐性として知られている。
ミクログリアからアストロサイトへのシグナル
PCを感知したミクログリアはどのようにして情報をアストロサイトに送るのであろうか? 種々のDAMPが知られているが、ATPは最初のシグナルとして重要である。脳卒中初期及びLPS負荷ミクログリアの最初の応答変化として、ATP/P2受容体シグナルの大きな変化がある。
LPSを感知したミクログリアは、Vesicular nucleotide transporter を発現させることで、ATPの開口放出を亢進させる6)。また、脳卒中を感知したミクログリアは、通常発現していないP2Y1受容体を発現させて、ATPを受容し、ミクログリア自身の機能を大きく変化させる7)。特にATPは、脳卒中以外でも、高度の興奮性刺激が起こった場合4)、外傷性脳損傷3)等の初期応答において、ミクログリアからアストロサイトへの情報シグナルとして中心的な役割を果たす。ミクログリア自身にも脳保護作用はあるが7)、先ずはより敏感なミクログリア情報を感知して、より脳保護作用が強力なアストロサイトにその情報を伝える、というカスケードが種々の脳疾患に対応する独自の安全装置として機能していることが示唆される。
虚血耐性実行細胞としてのアストロサイト
PCにより、アストロサイトは活性化型(反応性アストロサイト)となる。これを抑制すると虚血耐性が消失することから、反応性アストロサイトは虚血耐性誘導の必要条件であると言える。反応性アストロサイトは虚血耐性誘導の実行細胞であり、自身が直接、あるいは神経細胞や他細胞とコミュニケーションを取ることで間接的に虚血耐性誘導で中心的な役割を果たす。
例えば、反応性アストロサイトは神経保護分子産生、興奮性神経伝達物質及び有毒物質の除去機能亢進、エネルギー代謝制御等その作用は多岐にわたるが、特にP2X7受容体を介した作用が強力である5, 8, 9)。PCにより、反応性アストロサイトはアストロサイト特異的に大量(100倍以上)かつ長期的(8週間以上)にP2X7受容体を発現亢進させ、本受容体依存的にhypoxia inducible factor1α(HIF1α)を誘導することで非常に強い虚血抵抗性を発揮する(図)。
このアストロサイト特異的なP2X7受容体発現亢進メカニズムをはじめ、虚血耐性型アストロサイトの誘導メカニズムについては不明点が多い。上述したように、PCによる反応性アストロサイト誘導に先行してミクログリアが活性化することから、ミクログリアが虚血耐性型アストロサイトを誘導していると考えられている。しかしその是非、ミクログリアに誘導されるアストロサイト表現型の多様性等に関しては、まだ不明な点が多く残されており、今後のさらなる研究が必要である。
さらに、ミクログリアはどのようにして非侵襲的でマイルドなPCを感知するのか? どのような表現型に変化するのか? ミクログリアからアストロサイト及び神経細胞に伝えるシグナルはそれぞれ何か? 等々、解らない事だらけである。しかし、ミクログリア-アストロサイトが脳内環境の変化をリレーのように伝え、それに対する脳内応答性を変化させるメカニズムは、種々の脳疾患に先行して起こる共通の現象と考えられる。従って、極めて波及効果の大きな現象であることが示唆され、今後の研究の進展が待たれる。
おわりに
虚血耐性を例としてグリア細胞の脳機能制御における重要性を示した。ミクログリア及びアストロサイトそれぞれが、虚血耐性を誘導するポテンシャルを有しているが、実はミクログリア−アストロサイト連関による相互作用がより重要な役割とリンクしている可能性が高い。グリア細胞種それぞれに関する研究が盛んになってきたが、今後はこのような異種細胞間相互作用による神経細胞制御に関する視点が益々重要になることが予想される。
参考文献
- Zhang, G. et al. : Nature, 497, 211 (2013). DOI: 10.1038/nature12143
- Sanagi, T. et al. : J. Neurosci. Res., 88, 2736 (2010). DOI: 10.1002/jnr.22424
- Shinozaki, Y. et al. : Cell Rep., 19, 1151 (2017). DOI: 10.1016/j.celrep.2017.04.047
- Pascual, O. et al. : Proc. Natl. Acad. Sci. USA, 109, E197 (2012). DOI: 10.1073/pnas.1111098109
- Hirayama, Y. et al. : J. Neurosci., 35, 3794 (2015). DOI: 10.1523/JNEUROSCI.4218-14.2015
- Imura, Y. et al. : Glia, 61, 1320 (2013). DOI: 10.1002/glia.22517
- Fukumoto, Y. et al. : J. Cereb. Blood Flow Metab., 39, 2144 (2019). doi: 10.1177/0271678X18805317
- Hirayama, Y. and Koizumi, S. : Glia, 65, 523 (2017). DOI: 10.1002/glia.23109
- Hirayama, Y. and Koizumi, S. : Neurosci. Res., 126, 53 (2018). DOI: 10.1016/j.neures.2017.11.013
「ミクログリア研究の最前線−基礎から臨床へ−」シリーズ:結びのことば
九州大学大学院 薬学研究院 薬理学分野 津田 誠
和光純薬時報2020年第3号から連載がスタートした「ミクログリア研究の最前線−基礎から臨床へ−」のレビューシリーズも、本号のミクログリアとアストロサイトの連関による脳卒中の制御に関する総説をもって全6回を完結することとなった。本シリーズでは、ミクログリアが重要な役割を担う疾患として、アルツハイマー病、てんかん、脳梗塞、精神疾患、慢性疼痛などを取り上げ、その最新知見と展望を非常にわかりやすく、かつミクログリアの魅力を余すことなく解説いただいた。非常に多忙な中ご執筆いただいた、世界のミクログリア研究を牽引する気鋭の先生方に改めて心より感謝申し上げるとともに、ミクログリア研究の成果から依然克服できない神経疾患のメカニズムの解明や診断・治療法の開発が実現する日を楽しみにしつつ、本シリーズの結びのことばとしたい。









