【連載】ミクログリア研究の最前線−基礎から臨床へ− 「第1回 神経障害性疼痛」
本記事は、和光純薬時報 Vol.88 No.3(2020年7月号)において、九州大学大学院薬学研究院 ライフイノベーション分野 津田 誠様に執筆いただいたものです。
「ミクログリア研究の最前線−基礎から臨床へ−」シリーズ開始にあたって
九州大学大学院薬学研究院 ライフイノベーション分野 津田 誠
ミクログリアが発見されてから100年という節目の年に第35回Wakoワークショップ「ミクログリア研究の最前線-基礎から臨床へ-」(2019年11月)が開催され、このたび和光純薬時報のレビューシリーズとして、ミクログリア研究の最前線を連載する好機を頂いた。グリア(glia;英語ではglue)はその名が示すように、かつては神経と神経の間を埋める糊のような物質(neuroglia)とされていたが、最近の基礎研究から、グリアが神経活動に大きく影響を及ぼす重要な細胞であることが次々と示されている。特に、ミクログリアは、現代医療でも依然克服困難な神経疾患において重要な役割を有していることが明らかにされてきており、ミクログリアを切り口とした疾患メカニズムの解明や診断・治療法の開発への期待が一層高まっている。本シリーズでは、ミクログリアが重要な神経系疾患としてアルツハイマー病、てんかん、脳梗塞、精神疾患、慢性疼痛などを取り上げ、我が国の気鋭の先生方にその最新知見と展望をご紹介頂く。どうぞご期待ください。
はじめに
生体に有害な刺激が加わった場合、私たちは痛覚システムを利用し、痛みを発生させ、それに対し適切な防御的行動をとる。しかし、末期癌や糖尿病、脳梗塞、脊髄損傷、帯状疱疹治癒後などで神経系に損傷や圧迫、機能不全が起こると、神経障害性疼痛と呼ばれる慢性的な痛みとなってしまう。症状として、自発痛や疼痛過敏、そして触刺激など通常は痛みが起こらないような刺激で痛みが起こるアロディニア(異痛症)が知られている。
これらの痛みは、生体防御としての痛覚信号が持続的に発生するためという単純なものではなく、アロディニアのような感覚モダリティーそのものが変化する症状からもわかるように、体性感覚情報伝達系の機能破たんが原因と考えられている。末梢組織→一次求心性神経→脊髄後角→脳という一連の神経伝達系において、どのような仕組みで異常が起こるのか、そのメカニズムはまだ解明されていない。
本稿では、脊髄と脳に生じる痛覚伝達異常にミクログリアが重要な役割を担うことを概説し、そこから見えてきた神経障害性疼痛メカニズムと今後の展望について紹介する。
ミクログリア
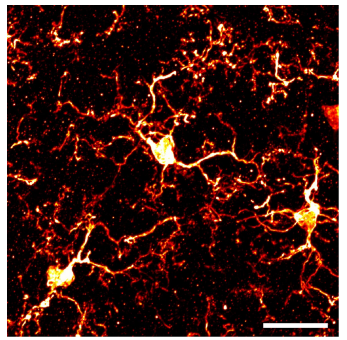
図1.正常状態のミクログリア(脊髄後角)
IBA1 抗体による免疫組織染色画像。スケールバー:50 μm。ミクログリアは中枢神経系を構成するグリア細胞の一つである。成体でのミクログリアは、小さな細胞体に複数の細かく枝分かれした突起をもつ形態で存在している(図1)。脳ミクログリアの生体イメージング解析により、ミクログリアはその突起を常に動かし、シナプス活動や細胞障害に応答するといった、時空間的に非常にダイナミックな活動性を有することが示されている 1)。
ミクログリアの発生起源は、2010年以降の fate-mapping 研究から、胎生期卵黄嚢に存在する前駆細胞とされ、それが血流を介して脳へ移動しミクログリアに分化・成熟することが明らかになり 2)、現在では、ミクログリアは中枢神経系の組織常在性マクロファージに分類されている。成体でのミクログリアの維持には、従来の骨髄細胞供給説ではなく、自己複製維持説が想定されている。その詳細はまだ不明だが、コロニー刺激因子 1 受容体(CSF1R)の欠損 3) や阻害薬処置 4)、インターロイキン -34(IL-34)の欠損 5)でミクログリア数が減少あるいは消失することから、これらが維持に重要なシグナルであろう。
脊髄後角ミクログリア
神経障害性疼痛の基礎研究では、末梢神経(主に坐骨神経や腰部脊髄神経)を直接損傷した動物モデルなどが利用される。1970 年代に坐骨神経の切断によって脊髄後角のミクログリアが活性化することが報告され、その後1990 年代に神経障害性疼痛とミクログリアとの相関性が示され、2003 年に初めてその両者間の因果性が明らかにされた 6)。それ以降、神経障害性疼痛メカニズムとしてミクログリアが世界的に注目され、現在まで盛んに研究されている。以下にこれまでに明らかになった分子細胞メカニズムを概説する。
ミクログリアの活性化メカニズム
末梢神経損傷により脊髄後角のミクログリアは細胞体の肥大化や突起の退縮、そして急激な細胞数の増加など、劇的な細胞応答を示す 7)。細胞数の増加には、ミクログリア自身の細胞分裂による自己増殖が関与する。その分子メカニズムとして、損傷神経でデュアルロイシンジッパーキナーゼ(DLK)依存的に発現増加した CSF1 が、神経軸索を介して脊髄後角に運ばれ、ミクログリアの CSF1R に作用するという仮説が有力である 8, 9)(図2)。一方で、血液脳関門の破たんを伴う疾患モデルの脳や脊髄では、末梢血由来の単球 / マクロファージの浸潤が見られる。神経障害性疼痛モデルでも神経損傷後一時的に血液脊髄関門の機能が低下するが、末梢血由来単球の脊髄後角内浸潤は見られない 10)。
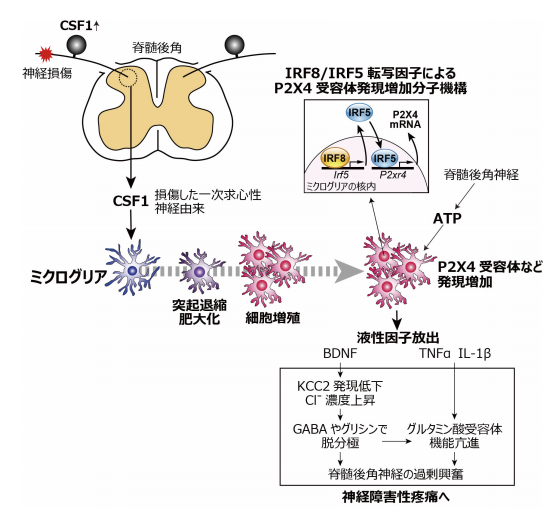
図2.脊髄後角でのミクログリアの活性化と神経機能変調メカニズム
損傷した一次求心性神経で発現増加したCSF1 が脊髄後角ミクログリアの CSF1受容体に作用し、形態変化、細胞増殖、遺伝子発現を伴い活性化状態となる。P2X4 受容体は、IRF8-IRF5 転写因子カスケードを介し発現増加する。脊髄後角介在神経から放出された ATP が P2X4受容体を刺激し、ミクログリアから液性因子が放出される。BDNF は KCC2 の発現低下を介して細胞内 Cl- 濃度を高め、GABA やグリシンの作用を興奮性へと転換させる。その神経興奮や TNFαや IL-1βはグルタミン酸受容体の機能を亢進させ、脊髄後角神経の過剰興奮を引き起こし、神経障害性疼痛へと繋がる。活性化ミクログリアによる感覚伝達の変調メカニズム
活性化したミクログリアはエピゲノムレベルで変化し 11)、細胞膜受容体や細胞内リン酸化酵素、液性因子など様々な遺伝子発現を介して機能的に活性化する 6)。その代表的な分子として、ATP などの細胞外ヌクレオチドに対する受容体(P2 受容体)が挙げられる。神経損傷後の脊髄では主にイオンチャネル型の P2X4 や P2X7 受容体、G タンパク質共役型の P2Y12 受容体の発現がミクログリア特異的に増加し、その機能や発現の阻害でアロディニアが著明に抑制される 6, 12)。P2X4受容体の発現増加は、転写因子 IRF8と IRF5 で誘導される 13, 14)。
同受容体は、脊髄後角介在神経から放出されるATP で活性化し 15)、脳由来神経栄養因子(BDNF)などの液性因子を産生放出する。それが脳へ痛覚情報を伝達する脊髄後角神経の KCC2 の発現を低下させ、細胞内外の Cl-濃度勾配を乱し、GABA やグリシンの作用を興奮性に転じさせ 16)、それが NMDA 受容体の活性化も導き、最終的に同神経の異常興奮を引き起こす(図2)6)。
ミクログリアは脳や脊髄における炎症性サイトカインの主要な産生細胞である。IL-1βは、TREM2/DAP12 や toll様受容体(TLR)、NLRP3 インフラマソームを介し産生され、脊髄後角神経でグルタミン酸受容体機能を亢進、GABA 受容体やグリシン受容体機能を抑制する 6)。TNFαはミクログリア選択的に発現し、脊髄後角神経への直接作用に加え、アストロサイトや血管内皮細胞への間接作用を介して神経の興奮性を高める。また、TNFαはミクログリアへ作用して BDNF の発現を高め、痛覚伝達神経のスパイン構造やシナプス結合の増加を起こす 17)。さらに、ミクログリアが放出する血小板活性化因子(PAF)は、オートクライン的にミクログリアの PAF 受容体を刺激し PAF 産生を誘導するというポジティブループを形成し、神経障害性疼痛に関与する 18)。
脳ミクログリア
脊髄後角のミクログリアと比較すると形態学的変化は劇的ではないものの、末梢神経損傷時に複数の脳部位でミクログリアが活性化することが報告されている。報酬系を司る腹側被蓋野で活性化したミクログリアは中脳辺縁系ドパミン神経機能と報酬系の低下に関与し 19)、海馬のミクログリアは CA1錐体神経のスパイン密度、シナプス伝達、BDNF 発現レベル、記憶の低下に関与する 17)。一方、扁桃体中心核では、神経損傷 4 週間後という比較的遅い時期に末梢血由来の単球 / マクロファージが浸潤し、それが NMDA 受容体のリン酸化と不安行動に関与する 20)。したがって、脳で活性化したミクログリアは、神経障害性疼痛の情動や記憶などに関与すると思われる。
治療と診断への展開
P2X4 受容体を含めミクログリア発現分子をターゲットにした化合物や抗体が複数開発され、いずれも非臨床試験でその有効性が報告された 6, 21)。神経障害性疼痛患者を対象とした臨床試験においてもその有効性が示されることを期待したい。
ヒトの脳や脊髄でのミクログリアイメージング技術は、創薬や治療、さらに診断にも応用できる。ミクログリアの生検は極めて困難であるが、九州大学の加藤隆弘らの研究グループは、線維筋痛症患者の末梢血中の単球から分化させたミクログリア様細胞(iMG細胞)では TNFα放出能が高く、それが痛みと相関していることを見出した 22)。今後の更なる研究から、iMGが慢性疼痛の診断や治療に応用できる可能性が期待される。
おわりに
現在までの十数年間で蓄積された数多くの研究成果から、神経障害性疼痛の発症には、神経だけなく、神経障害に伴って脊髄後角や脳で活性化するミクログリアの重要性が分かってきた 6)。また、アストロサイトも神経障害性疼痛に寄与していることが示されている(他の総説 23)などをご参照いただきたい)。これまでグリア細胞は神経を単に支持する細胞とされてきたが、これらの成果は、グリア細胞の活動が神経機能に大きな影響を及ぼすという重要な例を示しており、神経障害性疼痛メカニズムや中枢神経機能の理解には、神経とグリアの相互作用という視点が大切である。
一方、近年の1細胞解析から示されたミクログリアのヘテロジェナイティーが神経障害後にどのように崩れ、それが慢性疼痛にどのような意味を持つのかは全く分かっておらず、これからの重要な課題である。今後、ミクログリアサブセットの役割や神経との相互作用などを明らかにすることで、神経障害性疼痛メカニズムの解明と治療薬の開発に繋がる重要な道筋が拓けることと思われる。
参考文献
- Wake, H. et al. : Trends Neurosci., 36, 209 (2013). DOI: 10.1016/j.tins.2012.11.007
- Prinz, M. et al. : Cell, 179, 292 (2019). DOI: 10.1016/j.cell.2019.08.053
- Erblich, B. et al . : PLoS One , 6, e26317 (2011). DOI: 10.1371/journal.pone.0026317
- Elmore, M. R. et al. : Neuron, 82, 380 (2014). DOI: 10.1016/j.neuron.2014.02.040
- Wang, Y. et al . : Nat. Immunol., 13, 753 (2012). DOI: 10.1038/ni.2360
- Inoue, K. and Tsuda, M. : Nat. Rev. Neurosci., 19, 138 (2018). DOI: 10.1038/nrn.2018.2
- Kohno, K. et al. : Biol. Pharm. Bull., 41, 1096 (2018).
- Guan, Z. et al. : Nat. Neurosci., 19, 94 (2016). DOI: 10.1038/nn.4189
- Wlaschin, J. J. et al. : Elife, 7, (2018). DOI: 10.7554/eLife.33910
- Tashima, R. et al. : Sci. Rep., 6, 23701 (2016). DOI: 10.1038/srep23701
- Denk, F. et al. : Cell Rep., 15, 1771 (2016). DOI: 10.1016/j.celrep.2016.04.063
- Tsuda, M. et al. : Nature, 424, 778 (2003). DOI: 10.1038/nature01786
- Masuda, T. et al. : Cell Rep., 1, 334 (2012). DOI: 10.1016/j.celrep.2012.02.014
- Masuda, T. et al. : Nat. Commun., 5, 3771 (2014). DOI: 10.1038/ncomms4771
- Masuda, T. et al. : Nat. Commun., 7, 12529 (2016). DOI: 10.1038/ncomms12529
- Coull, J. A. et al. : Nature, 438, 1017 (2005). DOI: 10.1038/nature04223
- Liu, Y. et al. : J. Neurosci., 37, 871 (2017). DOI: 10.1523/JNEUROSCI.2235-16.2016
- Shindou, H. et al. : Faseb J., 31, 2973 (2017). DOI: 10.1096/fj.201601183R
- Taylor, A. M. et al. : J. Neurosci., 35, 8442 (2015). DOI: 10.1523/JNEUROSCI.4036-14.2015
- Sawada, A. et al. : Pain, 155, 1762 (2014). DOI: 10.1016/j.pain.2014.05.031
- Williams, W. A. et al. : Pain, 160, 1989 (2019). DOI: 10.1097/j.pain.0000000000001587
- Ohgidani, M. et al . : Sci. Rep., 7, 11882 (2017). DOI: 10.1038/s41598-017-11506-4
- Ji, R. R. et al. : Nat. Rev. Neurosci., 20, 667 (2019). DOI: 10.1038/s41583-019-0218-1









