【連載】ミクログリア研究の最前線−基礎から臨床へ− 「第2回 ミクログリアの発生起源と脳疾患」
本記事は、和光純薬時報 Vol.88 No.4(2020年10月号)において、京都薬科大学統合薬科学系 高田 和幸様に執筆いただいたものです。
はじめに
ミクログリアは中枢(脳・脊髄)の組織マクロファージであり、中枢での免疫を第一線で担う。発生様式や生態の特殊性が明らかになるにつれ、ミクログリアは様々な学問領域の研究者たちからの脚光を浴び、ミクログリアの生物学的学術研究がますます盛んに繰り広げられている。
本稿では、ミクログリアの発生起源やその生態に着目し、脳疾患との関わりや治療標的としての位置づけについて紹介したい。
ミクログリアの発生
1919 年、スペインの神経科学者であるPío del Río Hortega は、神経細胞、アストロサイトに次ぐ第三の脳構成細胞群の形態学的特徴を鮮明に描写し、この細胞集団をミクログリアと命名した。Hortegaはミクログリアの発生起源にも触れており、前駆細胞は脳の発達初期に脳の外から移入してくると述べている。
長らくその前駆細胞は末梢血中の単球と考えられてきたが、今から10 年前、胚体外組織の卵黄嚢での造血により作られる「原始マクロファージ」であることがマウスを用いた実験で明らかとなった 1)。この原始マクロファージ は、erythro-myeloid progenitors(EMPs)と呼ばれる細胞から転写因子 Myb 非依存的 2)に単球を経ず発生し、脳を含む全身の各臓器に生着して一時的に組織マクロファージとなる(図)。
その後、EMPs が胎仔肝へ移動して造血の場が引き継がれると、そこではEMPsからMyb 依存的に単球(fetal liver monocytes)が作られる。この単球も全身をめぐり、先に生着していた原始マクロファージを置換または共存しながら、新たな組織マクロファージとしてのポピュレーションを形成していく3)。この時、脳では発達段階の血液脳関門が形成されており、この侵入はほとんど起こらない。すなわち、全身の臓器に常在性の組織マクロファージが存在する中で、ミクログリアだけが卵黄嚢で作られた原始マクロファージを主な発生起源にすることになる。
細胞起源によるミクログリアの特徴付け
EMPs による造血に遅れ、胎生期の大動脈 - 性腺 - 中腎(aorta-gonad-mesonephros : AGM)領域では造血幹細胞(hematopoietic stem cells : HSCs)が発生する(図)。HSCsもマウス胎仔肝で胎生期の二次造血を開始するが、出生直前には骨髄へと移行して出生後の二次造血を全般的に担っていく。HSCs 由来単球も組織マクロファージのソースの一つと考えられるが、生理的条件下でのミクログリアのポピュレーションへの貢献はほとんどない 1, 4)。
一方で、HSCs 由来単球は血流にのって全身を巡回し、感染や障害性シグナルに応答して組織に移行してマクロファージへと分化する。この HSCs 単球由来マクロファージは短命で組織に一時的に滞在して炎症反応を惹起するが、対する EMPs 由来の組織常在性マクロファージは主に栄養や組織再構築に働くとされる。
また、HSCs 由来マクロファージはケモカイン受容体 CCR2 の発現が高く、EMPs 由来マクロファージは F4/80、colony-stimulating factor-1 receptor(CSF-1R)やフラクタルカイン受容体 CX3CR1 の発現が高いなど、それぞれの遺伝子発現パターンに細胞起源が色濃く残り4)、機能的役割分担に繋がることが予想される。
CSF-1R を介するシグナルが microRNA-21 を誘導して炎症性因子の発現を抑制し、栄養因子の発現を促進することは5)、ミクログリアを代表とする EMPs 由来組織マクロファージの細胞起源に伴う機能的特徴を説明する上でも興味深い6)。
最近では、脳実質との境界となる血管周囲、硬膜や脈絡叢に存在するマクロファージ(borderassociated macrophages : BAMs) と実質のミクログリアは、卵黄嚢 EMPsを同じ細胞起源としながらも、それぞれの運命付けは卵黄嚢に存在する時点で決まることが示唆されており 7)、さらに BAMs とミクログリアを区別する遺伝子発現パターンも明らかとなっている 8)。
このように、ミクログリアという組織マクロファージの特徴は、生着先である脳や脊髄といった環境から受けるシグナルのみならず、そのユニークな発生起源からの影響を大きく反映しており、ミクログリアの生態や機能をより深く、正確に理解するには、この発生起源を十分考慮することも重要であることがわかる。
ミクログリアのポピュレーションの維持
上述のように、ミクログリアの前駆細胞は胎生期にのみ作られ、生後の脊髄 HSCs 由来単球はミクログリアの補填にはほぼ関与しない。このミクログリアの生後のポピュレーションの維持について、近年、マウス脳では約 96 日に一回脳全体のミクログリアが入れかわるサイクルで細胞死 (アポトーシス) と分裂を繰り返しており、脳内での細胞数を一定に保つことが報告された 9)。
この自己分裂によるポピュレーションの維持様式は、エピジェネティック修飾という形で分裂後の細胞にも発生起源を伝え、また、時々刻々と変化する生着後の中枢内での微小環境の情報を引き継ぎ、時空間依存的なミクログリアのサブポピュレーションや脳疾患に特異的なサブポピュレーションの出現にも大きく関わると考えられる 10, 11)。
ミクログリアと脳疾患
21番染色体トリソミーが原因で発症する Down syndrome (DS) では、胎生期に神経発生が減少するがその原因は不明である。京都薬科大学の石原慶一博士らとの共同研究により DS モデルマウスを解析したところ、胎生期脳内ではミクログリアを含む脳組織マクロファージの割合の減少と好中球や単球などの炎症性細胞の割合の増加がみられ、大脳皮質では神経新生が低下することを見出した 12)(図)。このことは、ミクログリアを含む胎生期の脳内免疫環境の破綻が DS 発症に深く関与し、その正常化が DS の胎内治療法を見据えた新たな治療標的となることを示唆している。
一方、Alzheimer's disease (AD) の最大のリスクは加齢であり、発症までに数十年に渡って脳に蓄積するamyloidβ (Aβ) が病態形成の引き金として捉えられている。また、Aβ蓄積部位(老人斑)にはミクログリアが集積することも古くからよく知られる。ミクログリアの自己分裂によるポピュレーションの維持機構を考慮すると、加齢や長期間の Aβ暴露で積み重なったミクログリアの性質変化 13)こそが、AβからAD 発症までを結ぶ主要な経路なのかもしれない。
我々は、マウスの骨髄や末梢血から採取した HSCs から CSF-1 刺激下にマクロファージを作製し、脳内Aβ蓄積を呈する AD モデルマウスの海馬内に移植したところ、マウスの認知機能障害が改善することを見出した 14, 15)(図)。当初、移植したマクロファージのAβ貪食のみが治療効果をもたらす作用機序と考えていたが、この移植細胞から分泌される transforming growth factor-β1(TGF-β1)がミクログリアの機能変化をもたらすことも治療に関わることが判明した 16)。
TGF-βシグナルは発生初期の段階での原始マクロファージからミクログリアへの運命付けに必須であることが報告され 7)、一方では、ミクログリアを含む老化したグリア細胞の除去が認知機能の改善に繋がることも報告されている 17)。
長期間にわたるAβへの暴露や加齢により積み重なるミクログリアの性質変化は認知機能の低下に働き、ミクログリアの初期発生に必須となる TGF-β シグナルはこの変化を一部解除し、認知機能の改善に繋がるのかもしれない。
おわりに
ミクログリアの自己分裂を繰り返すポピュレーションの維持機構において、発生起源や生着後の微小環境情報はエピジェネティック修飾という形で引き継がれ、時空間依存的にミクログリアを特徴付けていくと考えられる。我々は、Agency for Science, Technology and Research (A*STAR) の Florent Ginhoux 博士との共同研究において induced pluripotent stem (iPS) 細胞から胎生期初期の造血を反映した原始マクロファージ (iMacs) の作製に成功しており 18)(図)、このような発生起源を再現できるプリミティブな細胞を用いた解析が、ミクログリアの生態のより正確な理解に導いてくれることが期待される。
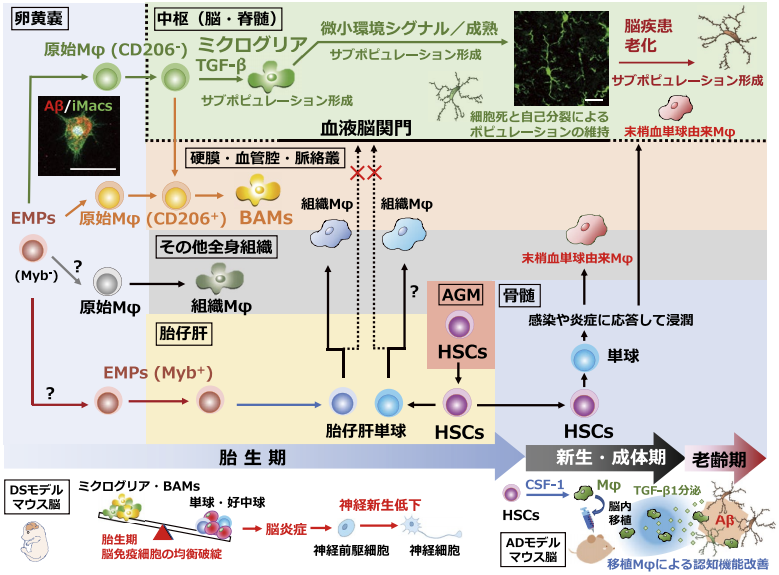
図.ミクログリアを含む組織マクロファージの発生と脳疾患との関わり
マウス卵黄嚢で EMPs から転写因子 Myb 非依存的に単球を経ずに原始 Mφが作られ、ミクログリアを含む組織 Mφとして各組織に生着する。ミクログリアと BAMs へはこの時点で方向付けられ、ミクログリアへの分化にはTGF-βシグナルが必要である。その他の原始Mφの方向付けは不明である。その後、胎仔肝へ移動した EMPs が胎仔肝単球を作り、原始φを置換または共存しながら新たな組織 Mφとなるが、中枢では血液脳関門のため置換されない。その後の AGM 領域で発生した HSCs 由来の単球も生理的条件下ではミクログリアとはならないが、感染/障害性シグナルに応答し、血中から組織に移行して Mφとなる。ミクログリアの発生起源は卵黄嚢原始 Mφであり、その後は細胞死と自己分裂でポピュレーションを維持する。DS モデルマウス胎生期脳では、ミクログリアや BAMs の割合が減少し、炎症性細胞の割合が増加して神経発生が低下している 12)。AD モデルマウスに CSF-1 刺激により HSCs から作製した Mφを移植すると、移植細胞は Aβを貪食するのみならず TGF-β1 を分泌して内在性のミクログリアの Aβ貪食を促進して、認知機能障害を改善する 14-16)。写真左:iPS 細胞由来 Mφ(iMacs)は原始 Mφの発生過程を再現し、ミクログリアにも分化誘導でき Aβ貪食機能を示す。写真右:成体期マウス海馬のミクログリア(Goat 抗 Iba1 抗体による染色)。Scale bars : 20 μm。Aβ: amyloid-β, AD : Alzheimer's disease, AGM : aorta-gonad-mesonephros, BAMs : border-associated macrophages,CSF-1 : colony-stimulating factor-1, DS : Down syndrome, EMPs : erythro-myeloid progenitors, HSCs : hematopoietic stem cells, Mφ : macrophages, TGF-β : transforming growth factor-β。参考文献
- Ginhoux, F. et al. : Science, 330, 841 (2010). DOI: 10.1126/science.1194637
- Schulz, C. et al. : Science, 336, 86 (2012). DOI: 10.1126/science.1219179
- Hoeffel, G. et al. : Immunity, 42, 665 (2015). DOI: 10.1016/j.immuni.2015.03.011
- Hagemeyer, N. et al. : EMBO J ., 35, 1730 (2016). DOI: 10.15252/embj.201693801
- Caescu, C. I. et al. : Blood, 125, e1 (2015). DOI: 10.1182/blood-2014-10-608000
- Chitu, V. and Stanley, E. R. : Curr. Top. Dev. Biol., 123, 229 (2017). DOI: 10.1016/bs.ctdb.2016.10.004
- Utz, S. G. et al. : Cell, 181, 557 (2020). DOI: 10.1016/j.cell.2020.03.021
- Mrdjen, D. et al. : Immunity, 48, 380 (2018). DOI: 10.1016/j.immuni.2018.01.011
- Askew, K. et al. : Cell Rep., 18, 391 (2017). DOI: 10.1016/j.celrep.2016.12.041
- Masuda, T. et al. : Nature, 566, 388 (2019). DOI: 10.1038/s41586-019-0924-x
- Keren-Shaul, H. et al. : Cell, 169, 1276 (2017). DOI: 10.1016/j.cell.2017.05.018
- Ishihara, K. et al . : Brain Pathol ., 30, 75 (2020). DOI: 10.1111/bpa.12758
- Baik, S. H. et al. : Cell Metab., 30, 493 (2019). DOI: 10.1016/j.cmet.2019.06.005
- Kawanishi, S. et al. : J. Alzheimers Dis., 64, 563 (2018). DOI: 10.3233/JAD-170994
- Kuroda, E. et al. : J. Alzheimers Dis., 73, 413 (2020). DOI: 10.3233/JAD-190974
- Kuroda, E. et al. : Neuroscience, 438, 217 (2020). DOI: 10.1016/j.neuroscience.2020.05.004
- Tyler, B. et al. : Nature, 562, 578 (2018). DOI: 10.1038/s41586-018-0543-y
- Takata, K. et al. : Immunity, 47, 183 (2017). DOI: 10.1016/j.immuni.2017.06.017









