【連載】ミクログリア研究の最前線−基礎から臨床へ− 「第4回 ミクログリア・マクロファージによる脳梗塞後の炎症と修復の制御メカニズム」
本記事は、和光純薬時報 Vol.89 No.2(2021年4月号)において、東京都医学総合研究所 脳卒中ルネサンスプロジェクト、慶應義塾大学薬学部生化学講座 大谷 健人様、東京都医学総合研究所 脳卒中ルネサンスプロジェクト、日本医療研究開発機構 七田 崇様に執筆いただいたものです。
はじめに
脳梗塞は本邦における脳卒中の約8割を占め、寝たきりや死亡の主な原因である。脳梗塞では、脳血流が低下することによって脳組織への酸素や栄養の補給が不足し、脳組織が虚血壊死(梗塞)に至る。脳虚血では様々な細胞ストレスが惹起されるが、炎症はそのようなストレスのひとつである。脳虚血後の炎症においては、脳組織に常在するマクロファージであるミクログリアや、血液脳関門の破綻に伴って脳組織に浸潤したマクロファージが炎症性サイトカインを産生する。
ミクログリアやマクロファージによる脳梗塞後の炎症は数日間続くが、その後は炎症性サイトカインの産生がみられなくなり、その代わりに脳組織の修復を促進するようにミクログリアやマクロファージの役割が変化する。ミクログリアやマクロファージが炎症性細胞や修復性細胞として機能する分子メカニズムは近年様々に報告がなされている。そこで本稿では、脳梗塞後の炎症とマクロファージによる神経修復の分子メカニズムについて議論するとともに、脳梗塞におけるミクログリア・マクロファージの機能を標的とした治療薬開発の展望を述べる。
脳梗塞後の炎症におけるミクログリア・マクロファージの役割
血液中を循環しているマクロファージは、血液脳関門の破綻によって脳組織へ浸潤する。マクロファージの脳内浸潤にはケモカインの働きが必須であることが知られており、特にCCL2(C-C motif chemokine 2)とその受容体であるCCR2(C-C chemokine receptor 2)は脳組織内へマクロファージが浸潤するのに重要な役割を担う1)。CCL2 は虚血に陥った脳組織中の細胞から産生される。マクロファージにおいてCCR2 を欠損させると脳組織内への浸潤が減弱し、脳梗塞発症後早期にマクロファージの浸潤を抑制すると脳内炎症が減弱して脳保護効果が観察される2)。したがってCCL2-CCR2 の相互作用は、炎症性マクロファージの脳内への浸潤に重要であると考えられる。
虚血によって組織が壊死を起こすと、組織を構成する物質が放出されるが、これらの物質の中には炎症を引き起こす分子が含まれておりDAMPs(Damage-associated molecular patterns)と呼ばれている3)。DAMPs は、ミクログリアやマクロファージに発現しているパターン認識受容体(Pattern recognition receptors : PRRs)を活性化して脳梗塞後の炎症を引き起こすことが知られている (図1)。 脳梗塞後の主要なDAMPs としては、HMGB1(High mobility group box1) やPRX(Peroxiredoxin)が知られている。
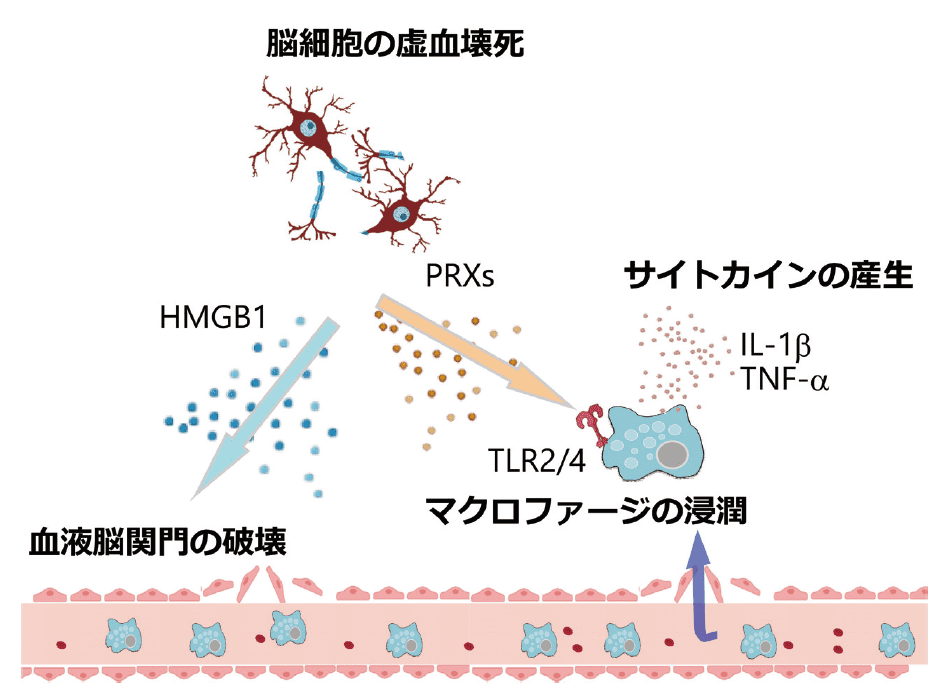
図1.脳梗塞後における炎症の惹起
虚血壊死した脳細胞からはHMGB1 やPRX などのDAMPs が放出される。HMGB1 は血液脳関門を破綻させ、血液中のマクロファージが脳組織内へ浸潤する。DAMPs はTLRs などのパターン認識受容体を介してミクログリアやマクロファージを活性化することで炎症性サイトカインの産生を誘導し、脳梗塞後の脳浮腫やさらなる神経傷害を引き起こす。HMGB1 は細胞の核内に存在するDNA 結合タンパクとして発見された。脳組織では神経細胞がHMGB1 を主に産生しており、脳虚血2 ~ 4 時間後には神経細胞外にHMGB1 が放出されている様子が観察されている4, 5)。HMGB1 は脳組織におけるMMP9(Matrix metalloproteinase 9)の発現を増加させて血液脳関門の破綻を促進することにより炎症を増大させる6)。さらにHMGB1 は好中球を活性化し、NETs (Neutrophil extracellular traps)と呼ばれる細胞外トラップの放出を誘導する7)。細胞外トラップは、ゲノムDNA とエラスターゼやミエロペルオキシダーゼなどの殺菌酵素で構成される複合体であり、感染や炎症病態において病原体の排除や組織における炎症を促進する役割があると考えられており、好中球やマクロファージから放出される8)。NETs は脳梗塞組織においても観察されており、脳梗塞後の炎症と神経傷害を促進すると考えられている。また、脳梗塞後の血管内においてもNETs が観察されるが、血管内でNETs が放出されると血栓の形成が促進され、梗塞巣周辺の脳血流をさらに減少させることにより神経症状の悪化を加速させる可能性がある。
PRX は細胞内で過酸化水素を水へと代謝する抗酸化タンパク質として知られている。PRX は虚血後の脳細胞内で発現が増加し、酸化ストレスに対して細胞保護的な機能を持つ9)。一方で、虚血壊死した細胞からは細胞内で蓄積したPRX が細胞外に放出されて、ミクログリアや脳組織内に浸潤したマクロファージのパターン認識受容体を活性化し、炎症性サイトカインの産生を誘導する。
Myd88 は、主要なパターン認識受容体として知られるToll 様受容体(Toll-like receptors : TLRs)のシグナルの下流で機能するアダプター分子であり、Myd88 を欠損したマウスではほとんどのTLRs の機能を欠損する。Myd88 欠損マウスを用いて脳梗塞モデルを作製すると、脳内に浸潤した免疫細胞における炎症性サイトカイン産生が顕著に減少する10)。TLRs は本来、細菌やウイルスなどの病原体由来の分子を認識して免疫細胞を活性化するが、傷害を受けた組織から放出される自己由来の分子も認識して無菌的な炎症を惹起する役割も持つことが知られている。
脳梗塞においては、細胞外に放出されたPRX はTLRsを活性化し、IL-1β (Interleukin-1β)やIL-23、TNF-α(Tumor necrosis factor α)などの炎症性サイトカインの産生を誘導する。齧歯類の脳梗塞モデルや脳卒中患者では、これらの炎症性サイトカインは虚血後の炎症を促進し、脳浮腫を引き起こし、さらなる神経傷害や予後不良につながると考えられている11)。
脳梗塞後におけるマクロファージによる炎症収束
ミクログリアやマクロファージは脳梗塞後の炎症に重要な役割を持つが、炎症性サイトカインの産生は脳梗塞発症の数日後にピークを迎え、その後減少していく12)。脳梗塞発症数日から1週間程度経過するとマクロファージは、炎症収束を促し、神経修復に寄与するように役割を変化させる13)。このようなマクロファージは、抗炎症性サイトカインであるIL-10 やTGF-β(Transforming growth factor β) を産生して神経保護的な作用を持つことが知られている。
脳組織においてアデノウイルスを用いてIL-10 を過剰発現させると、脳梗塞後の神経細胞死と梗塞体積の拡大を防ぐ14)。TGF-βは炎症抑制に働く制御性T 細胞の分化にも重要な因子であり、脳梗塞後の炎症を減弱する15)。以上のように、脳梗塞においてマクロファージは炎症抑制性の因子も産生している。
脳梗塞後の炎症収束には、脳組織内からDAMPs を排除することが重要である。ミクログリアやマクロファージに発現しているスカベンジャー受容体(MSR1 やMARCO)はPRX やHMGB1 などのDAMPs を認識して脳梗塞組織から排除する。MSR1 やMARCO を欠損したマウスでは、脳梗塞組織からのDAMPs の排除が遅延して炎症状態が長引くことで、神経症状が野生型のマウスと比べて悪化する16)。
ミクログリアやマクロファージにおけるMSR1 の発現は、脳梗塞発症1 日目から3 日目にかけて上昇するが、このようなMSR1 の発現上昇には、マクロファージの分化に重要な転写因子であるMafb が重要な役割を持つ。MSR1 の発現が高いマクロファージでは、TNF-α、IL-1β、IL-23といった炎症性サイトカインよりも、IGF-1(Insulin-like growth factor1)のような神経栄養因子を主に産生している16)。脳梗塞を作製したラットにフタリド誘導体を投与すると、脳組織に浸潤したマクロファージにおけるMSR1 の発現を増加させてDAMPsの排除を促進し、TNF-αの産生を減弱させることが示された17)。したがって、脳梗塞後におけるDAMPs の排除は炎症を収束させるための重要なプロセスである。
脳梗塞発症後7日程度経過すると、ミクログリアやマクロファージは炎症を収束させて修復を促進することにより、脳梗塞後の回復に寄与することが知られている18)。マクロファージでCCR2 を欠損したマウスでは、脳梗塞発症数日後における炎症は減弱するものの、発症5 日目以降においては炎症がリバウンドして神経症状が悪化し、脳梗塞後の回復が不良になることが報告されている13, 19)。
脳梗塞発症7日目以降には、ミクログリアやマクロファージからIGF-1 やFGF-2 などの脳保護的に作用する栄養因子が産生される20, 21)。これらの栄養因子は再髄鞘化やシナプス形成に関与するため脳梗塞後の回復に重要な役割を持つと考えられている22)。このように、脳梗塞組織に浸潤したマクロファージは、炎症性から炎症収束・修復性へと形質が変化することにより脳梗塞後の機能回復にも寄与しているものと考えられる。
ミクログリアやマクロファージを治療標的とした脳梗塞後の炎症制御
脳梗塞の急性期治療では、rt-PA(Recombinant tissue plasminogen activator)の静脈内投与による血栓溶解や、血栓除去術が実施されている23)。免疫抑制剤であるステロイドやシクロスポリン、タクロリムスなどは脳梗塞患者における機能予後の改善効果が証明されていない。したがって、脳梗塞後の炎症を抑制するだけではなく炎症の収束を早めて修復を促進する薬剤の開発が期待されている。
IL-10 やTGF-βを治療標的とした薬剤は、抗炎症性サイトカインのみ発現誘導させることが困難である上に、脳梗塞において発現制御を行うべき適した時期が不明であることが問題となる。脳梗塞を作製したマウスにDHA(Docosahexaenoic acid)やIL-13、メイソインジゴを投与することで、ミクログリアやマクロファージを抗炎症性・修復性へと形質を変化させる24-26)。アンジオポエチンを投与すると炎症性サイトカインの産生が減少し、血管新生が促進されて脳保護的な効果がみられる27)。最近の報告では、PPARγやSTAT6 のような転写因子は脳梗塞後の炎症を収束させる治療標的分子である可能性が示されている28)。
ミクログリアやマクロファージの炎症収束・修復作用を持続させるための分子メカニズムを解明できれば、脳梗塞を含め様々な臓器傷害における予後を改善させられる治療剤開発が可能となるであろう。さらに、脳梗塞発症後24 時間以降に投与開始できる治療剤は少ないが、発症数日後に投与しても脳梗塞後の機能予後を改善させる治療薬が開発できる可能性が高い。
結論
ミクログリアやマクロファージは炎症性、抗炎症性、炎症収束性、修復性など多彩な機能を持ち、脳梗塞後の時期によって病態の進行に重要な役割を果たす(図2)。脳梗塞におけるミクログリアやマクロファージによる炎症収束・修復の役割を促進させて持続させる次世代の治療剤開発が期待される。
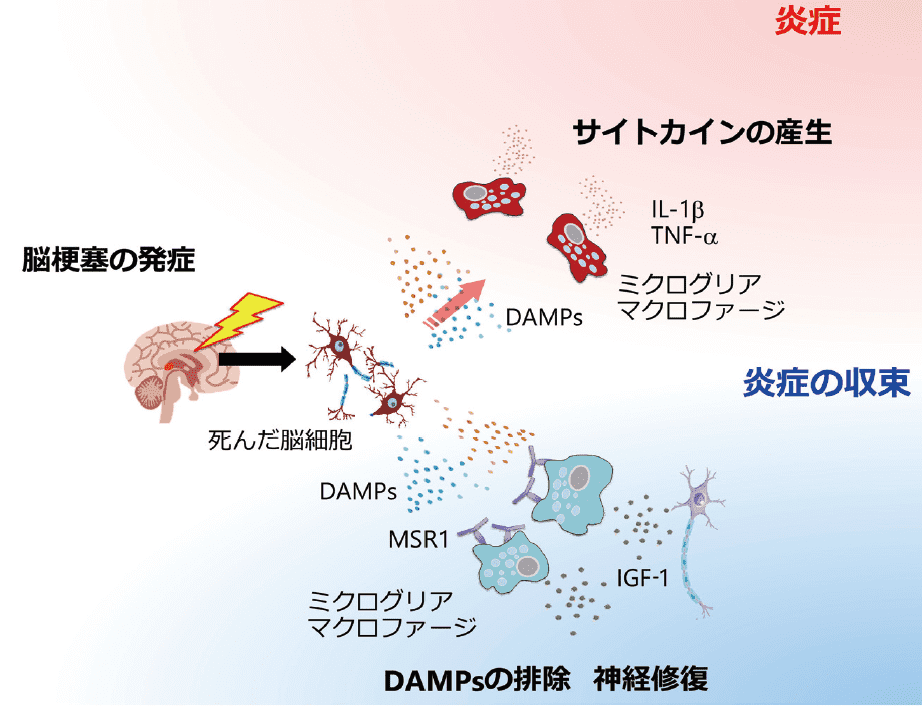
図2.脳梗塞におけるミクログリアやマクロファージの多彩な機能と役割
脳梗塞発症後、虚血壊死した脳細胞から放出されるDAMPs によってミクログリアやマクロファージが活性化され、IL-1βやTNF-αなどの炎症性サイトカインが産生される。一方、MSR1の発現が高いミクログリアやマクロファージは脳梗塞組織からDAMPs を排除し、神経修復の働きを持つIGF-1 を産生することで脳保護的な効果を示す。Abbreviations
CCL2: C-C motif chemokine 2; CCR2: C-C chemokine receptor 2; DAMPs: Damageassociated molecular patterns; PRRs: Pattern recognition receptors; HMGB1: High mobility group box1; PRX: Peroxiredoxin; MMP9: Matrix metalloproteinase 9; NETs: Neutrophil extracellular traps; TLRs: Toll-like receptors; IL-1β: Interleukin-1β; TNF: Tumor necrosis factor; TGF-β: Transforming growth factor β; IGF-1: Insulin-like growth factor1; rt-PA: Recombinant tissue plasminogen activator; DHA: Docosahexaenoic acid
Competing interests
The authors declare that they have no competing interests.
参考文献
- Mildner, A. et al. : Nat. Neurosci., 10, 1544 (2007). DOI: 10.1038/nn2015
- Gliem, M. et al. : Ann. Neurol., 71, 743 (2012). DOI: 10.1002/ana.23529
- Huang, J. et al. : Ageing Res. Rev., 24, 3 (2015). DOI: 10.1016/j.arr.2014.10.004
- Qiu, J. et al. : J. Cereb. Blood Flow Metab., 28, 927 (2008). DOI: 10.1038/sj.jcbfm.9600582
- Zhang, J. et al. : Stroke, 42, 1420 (2011). DOI: 10.1161/STROKEAHA.110.598334
- Qiu, J. et al. : Stroke, 41, 2077 (2010). DOI: 10.1161/STROKEAHA.110.590463
- Ma, Y. H. et al. : Arthritis. Res. Ther., 18, 2 (2016). DOI: 10.1186/s13075-015-0903-z
- Kim, S. W. et al. : Acta Neuropathol. Commun., 7, 94 (2019). DOI: 10.1186/s40478-019-0747-x
- Rashidian, J. et al. : J. Neurosci., 29, 12497 (2009). DOI: 10.1523/JNEUROSCI.3892-09.2009
- Shichita, T. et al. : Nat. Med., 15, 946 (2009). DOI: 10.1038/nm.1999
- Shichita, T. et al. : Nat. Med., 18, 911 (2012). DOI: 10.1038/nm.2749
- Clausen, B. H. et al. : Neuroscience, 132, 879 (2005). DOI: 10.1016/j.neuroscience.2005.01.031
- Pedragosa, J. et al. : J. Cereb. Blood Flow Metab., 40, S98 (2020). DOI: 10.1177/0271678X20909055
- Ooboshi, H. et al. : Circulation, 111, 913 (2005). DOI: 10.1161/01.CIR.0000155622.68580.DC
- Cekanaviciute, E. et al. : Glia, 62, 1227 (2014). DOI: 10.1002/glia.22675
- Shichita, T. et al. : Nat. Med., 23, 723 (2017). DOI: 10.1038/nm.4312
- Zou, X. et al. : J. Neuroimmune Pharmacol., (2020). doi: 10.1007/s11481-020-09911-0
- Wattananit, S. et al. : J. Neurosci., 36, 4182 (2016). DOI: 10.1523/JNEUROSCI.4317-15.2016
- Fang, W. et al. : Theranostics, 8, 3530 (2018). doi: 10.7150/thno.24475
- Ikeda, N. et al. : Stroke, 36, 2725 (2005). DOI: 10.1161/01.STR.0000190006.88896.d3
- Zhu, W. et al. : Stroke, 39, 1254 (2008). DOI: 10.1161/STROKEAHA.107.500801
- Leker, R. R. et al. : Stroke, 38, 153 (2007). DOI: 10.1161/01.STR.0000252156.65953.a9
- Hankey, G. J. : Lancet, 389, 641 (2017). DOI: 10.1016/S0140-6736(16)30962-X
- Ye, Y. et al. : Front. Cell. Neurosci., 13, 553 (2019). DOI: 10.3389/fncel.2019.00553
- Cai, W. et al. : Transl. Stroke Res., 9, 669 (2018). DOI: 10.1007/s12975-018-0662-7
- Kolosowska, N. et al. : Neurotherapeutics, 16, 1304 (2019). DOI: 10.1007/s13311-019-00761-0
- Venkat, P. et al. : CNS Neurosci. Ther., 27, 48 (2020). DOI: 10.1111/cns.13541
- Zhang, W. et al. : CNS Neurosci . Ther., 25, 1329 (2019). DOI: 10.1111/cns.13256









