【連載】基礎から応用までよくわかる組織透明化技術 「第4回 骨組織に囲まれた内耳イメージングのための透明化法、Modified ScaleS」
本記事は、和光純薬時報 Vol.88 No.1(2020年1月号)において、東京大学大学院医学系研究科 浦田 真次様、岡部 繁男様に執筆いただいたものです。
1.研究バックグラウンド
本研究の目的は蝸牛全有毛細胞を観察する手法の開発になります。蝸牛は異なる機能を持つ細胞が複雑に配置されて構成される極めて精巧な組織であり、骨包に囲まれているために解析法は限定的でした。従来の蝸牛有毛細胞の組織解析は切片作成や surface preparation による観察が主流でした 1, 2)。しかし、切片作成は蝸牛軸と水平面で行う為、コルチ器から側壁までの観察が可能ですが有毛細胞の観察できる領域は極めて限定的でした。
一方、幼若マウスの蝸牛の surface preparation では大多数の有毛細胞の観察が可能ですが剥離される蝸牛側壁の観察は不可能でした 1)。成体マウスでの surface preparation では成長に伴う蝸牛軸周囲の骨を含めた骨包の骨化によって蝸牛を分割する必要があるだけでなく、断片化された蝸牛の側壁除去を行う際に一部の有毛細胞を犠牲にせざるをえませんでした。さらにライスネル膜と蓋膜の除去処理には側壁処理以上に極めて繊細な手技を要する為、熟練した研究者のみ可能な手法でした。
蝸牛正常生理及び病態生理の解明には 3 次元構造を温存した状態での解析が不可欠であり、「蝸牛の解剖学的制約」と「研究者の手技的制約」を補完する技術開発が必要とされていました。
2.内耳を透明化しようとした背景
内耳の蝸牛内にはコルチ器と呼ばれる感覚装置があり、この組織の重要な細胞要素である、有毛細胞と呼ばれる感覚細胞の機能を評価することはヒトの耳の機能を評価する上で極めて重要です。コルチ器には異なった周波数の音に対応して反応する有毛細胞が高い音から低い音に向かって順番に整然と配列しており、これらの多数の細胞全体の空間的なアトラスを作成できれば、難聴などの耳の疾患の研究に広く利用することができます。
しかしながら、これまでコルチ器の有毛細胞の状態を調べるには組織切片を使って全体の細胞のほんの一部を解析する手法が主に使われてきました。あるいはヒトの手によって微細なコルチ器を複雑な骨の迷路の中から取り出してくる方法もありますが、非常にデリケートなコルチ器を無傷で取り出す事は大変難しく、一般的な解析方法にはなっていません。
このような背景から、耳の機能の研究を発展させるには、コルチ器全体を傷を付けない状態でイメージングし、中に存在する有毛細胞を全て検出して、一個一個の細胞レベルでその細胞に障害が起こっているのかを判断する技術が必要だと考えました。
3.内耳の全感覚細胞透明化により得られた新規知見
本研究では、コルチ器に存在する数千個の有毛細胞全てを高い精度で自動的に検出し、一個一個の細胞の障害程度などを評価できる技術が提案されています 3)。このような解析を実現させるために、新しい技術である組織の透明化手法を骨に囲まれたコルチ器にも応用できるように改良しました。その結果として、組織深部からの蛍光シグナルを検出できる二光子顕微鏡によるイメージングと組み合わせることで、コルチ器を含む内耳の組織全体の 3 次元画像を取得できるようになりました。
次に得られた 3 次元画像から自動的に全ての細胞の位置や細胞毎の情報を抽出するためのプログラムを、機械学習の手法を活用して開発しました。これまで人の眼で行っていた一個一個の細胞の同定や計測をプログラムによって自動化することができ、サンプル作成から全細胞データの取得までを5 日間で終えることが可能になりました。この自動化プログラムはヒトの眼による有毛細胞の検出や細胞死によって細胞が抜け落ちた部位の同定を代替することが可能で、その正確度や精度も人間による測定と同レベルにありました。
新しいコルチ器の細胞アトラス作成法を用いると、加齢や騒音によって引き起こされるコルチ器の障害を短時間で詳細に解析することが可能になり、障害の原因によって異なった細胞死を起こす細胞の空間的な配置に違いがあることもわかりました。またこの方法は細胞を同定するだけではなく、細胞内の構造や特定のタンパク質、有毛細胞が神経細胞と形成するシナプス構造の検出も可能です。解析の応用例の一つとして障害を受けて死んでいく細胞の周囲の細胞にも、細胞骨格レベルでの変化が生じている事が示唆されました。
4.透明化プロトコルとアプリケーションデータ
Modified ScaleS プロトコル 4)
A. 蝸牛摘出
| a. | 4%パラホルムアルデヒド(PFA)による経心灌流を行った後、側頭骨を摘出する。頭蓋底側に露出した三半規管をメルクマールに内耳を同定する[Figure 1A]。骨裂にそって内耳を摘出する[Figure 1B]。摘出された内耳を 4%PFA に浸透させて 4℃で一晩インキュベートする。 |
| b. | リン酸緩衝生理食塩水(PBS)で 15 分× 3 回洗浄を行う。 |
| c. | エチレンジアミン四酢酸(EDTA)で 37℃で 45 時間インキュベートする。 |
| d. | リン酸緩衝生理食塩水(PBS)で 15 分× 3 回洗浄を行う。 |
| e. | 内耳周囲に付着している組織を除去する。 |
| f. | 三半規管と前庭を切り離し、蝸牛を摘出する[Figure 1C,D]。 |
B. 脱脂
Solution 1 に浸透させて 37℃で 2 時間インキュベートする。
C. 免疫組織染色(GFP 発現サンプルは Skip)
| a. | 0.1% Triton X-100 を含有する PBS(PBST)に置換し 30分洗浄する。 |
| b. | 一次抗体を 37℃で 2 時間から 48 時間インキュベートする。 |
| c. | PBST で 15 分× 3 回洗浄を行う。 |
| d. | 二次抗体を 37℃で 12 時間から 48 時間インキュベート後、PBST で 15 分× 3 回洗浄を行う。 |
D. サンプル準備
| a. | Blu-Tack を円柱状に形成する[Figure 2(i)]。 注 1)円直径の長さと蝸牛をスライドグラスに置いたときの高さが同じ(もしくは円柱が少々高い程度)にする。 |
| b. | Basukoku をスライドグラス上に馬蹄形に塗る[Figure 2(ii)]。 |
| c. | 馬蹄形に塗布された Basukoku の上に D-a で作成した BluTack をのせる[Figure 2(iii, iv)]。 |
| d. | 馬蹄形の Blu-Tack の内側のスライドグラス上に少量の Basukoku を塗布する[Figure 2(v)]。 |
| e. | 塗布した Basukoku 上に蝸牛を置く[Figure 2(vi)]。 注 2)全有毛細胞観察の為には蝸牛軸がスライドグラスに垂直であることが望ましい[Figure 3(次ページに掲載)]。 |
| f. | Blu-Tack 上にカバーグラスを置き[Figure 2(vii)]、蝸牛表面に接するまでカバーグラスを圧迫する[Figure 2(vii-a)]。 注 3)カバーグラスが蝸牛表面に接したことは目視でも確認できる。カバーグラスの破損を防ぐ為に圧迫する力は均等になるよう慎重に行う。カバーグラスが破損した場合は新しいスライドグラスを用いて D-a 工程からやり直す。 注 4)サンプルの固定が不十分な場合、イメージングができなくなる場合があるので D-f 工程は極めて重要である。 |
| g. | スライドグラスに沿わせて Solution 2 を充填する[Figure 2(viii)]。 注 5)サンプルが移動する場合は Solution 2 を吸引し D-f 工程からやり直す。 |
| h. | Basukoku で密閉する[Figure 2(ix)]。 注 6)気泡はイメージングでの視野障害になるだけでなくサンプル保存の際に乾燥する原因となる為、気泡が入らないように注意する。 注 7)Solution 2 浸透後、速やかに透明化が開始する。約20 分で透明化工程は終了する。自然光では蝸牛輪郭や血管条の色味は残る。スライドグラス後方に指をかざし透視できればイメージングを行う。 |
試薬調製
A. Solution 1(20 mL)
5.7g グアニジン塩酸塩
7g D-ソルビトール
3g D-グルコース
800μL(w/v)Triton X-100 含有 PBS(pH 6.0-8.0)
B. Solution 2(20 mL)
5.7g グアニジン塩酸塩(もしくは 4.8g 尿素)
12g D-ソルビトール
20μL Triton X-100 含有 PBS(pH 7.1)
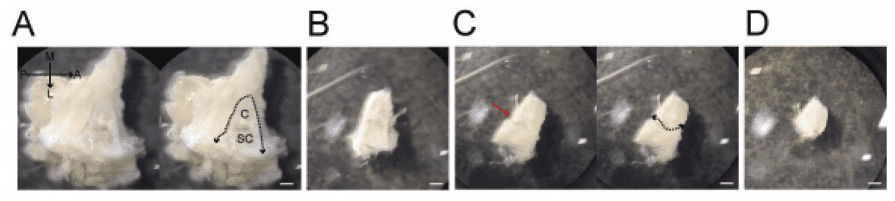
Figure 1. 蝸牛摘出
A:側頭骨を摘出し頭蓋底を観察すると球状の三半規管(SC)が観察できる。SC の内側に蝸牛(C)が存在する。内耳の外周に沿って(点線)組織の剥離を行い内耳を摘出する。B:内耳摘出図。C:蝸牛と三半規管の間の裂隙(赤矢印)に沿って半割を行い蝸牛を摘出する。D:蝸牛摘出図。Scale bar : 1mm、使用顕微鏡:Nikon A1MP、使用レンズ:N25X-APO-MP(NA1.10, WD2.00), VC 20x(NA0.75, WD1.00)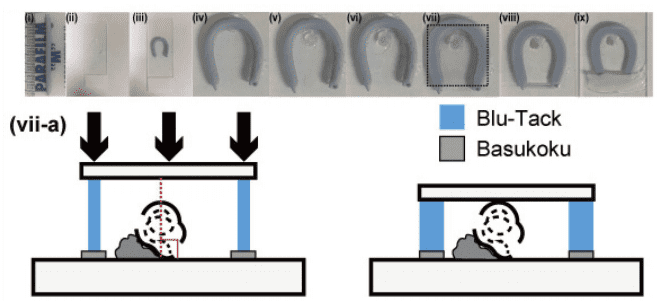
Figure 2. サンプル準備工程
Basukokuを塗布したスライドグラスにBlu-Tack でサンプル高さに合わせて土手を作成し、Basukoku 上にサンプルを静置 [ 蝸牛軸がスライドグラスに垂直になるよう(vii-a)に ] する。次にカバーグラスを静置し蝸牛表層と接着するまで圧迫し Solution 2 を充填し密閉する。使用顕微鏡:Nikon A1MP、使用レンズ:N25X-APO-MP(NA1.10, WD2.00), VC20x(NA0.75, WD1.00)
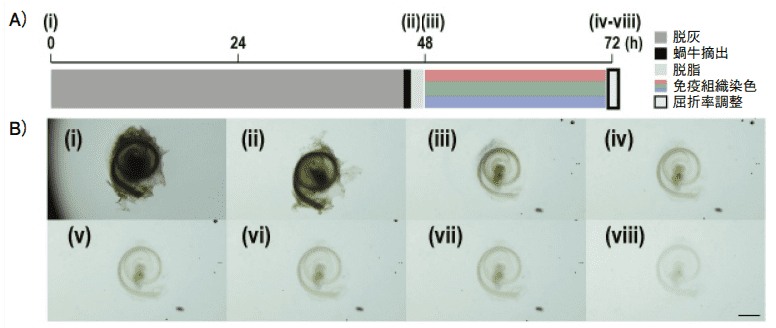
Figure 3. Modified ScaleS
時間変化(A)、透明性変化(B)。(iv)から(viii)は Solution 2 浸透後 5 分毎の変化を示す。Scale bar : 1mm、使用顕微鏡:Nikon A1MP、使用レンズ:N25X-APO-MP(NA1.10, WD2.00), VC 20x(NA0.75, WD1.00)
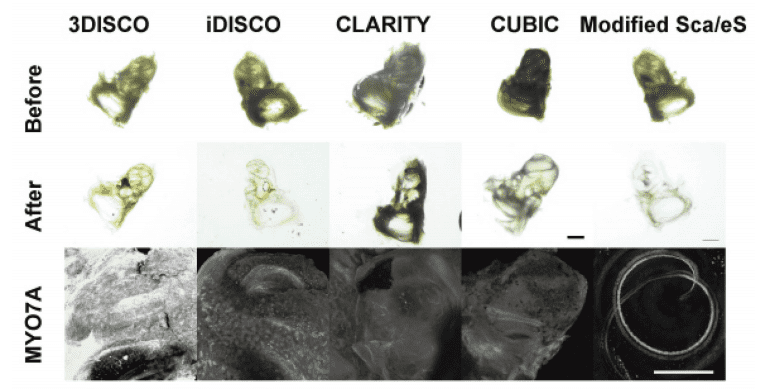
Figure 4. 従来法との比較
Modified ScaleS のみで有毛細胞(MYO7A)を観察することができる。Scale bar : 500μm、使用顕微鏡:Nikon A1MP、使用レンズ:N25X-APO-MP(NA1.10, WD2.00), VC 20x(NA0.75, WD1.00)
5.各種透明化技術の比較例(Figure 4)
従来の透明化手法(3DISCO5), iDISCO6), CLARITY7), CUBIC8))では蝸牛の透明度は上昇しますが、MYO7A によって標識化された蝸牛有毛細胞を観察することはできませんでした。Modified ScaleS を用いることでラセン状に配列している有毛細胞群を観察することができるようになりました。
6.透明化技術を用いた今後の展望
本成果により、これまで解析することが困難だった難聴のモデル動物の内耳に起こっている変化を、短時間の内に網羅的かつ一細胞レベルで解析することが可能になりました。難聴を表現型とする疾患動物のモデルは多く存在しますが、これまではコルチ器での有毛細胞の病態を効率良く検出する技術が存在しなかった為に、細胞レベルでどのような変化が初めに起こるのかはほとんど明らかになっていません。本成果を活用することで、様々な難聴のモデル動物での有毛細胞における初期の変化を特定することが可能です。
現在、我々は Modified ScaleS を用いて有毛細胞以外の蝸牛内細胞群の観察においても有効性があることを見出しています(Figure 5)。様々な難聴モデルマウスでの研究を通じて、乳幼児を悩ます先天性難聴や高齢者を悩ます老人性難聴の病態の解明やそれに基づく治療戦略の開発が将来的に加速すると期待されます。
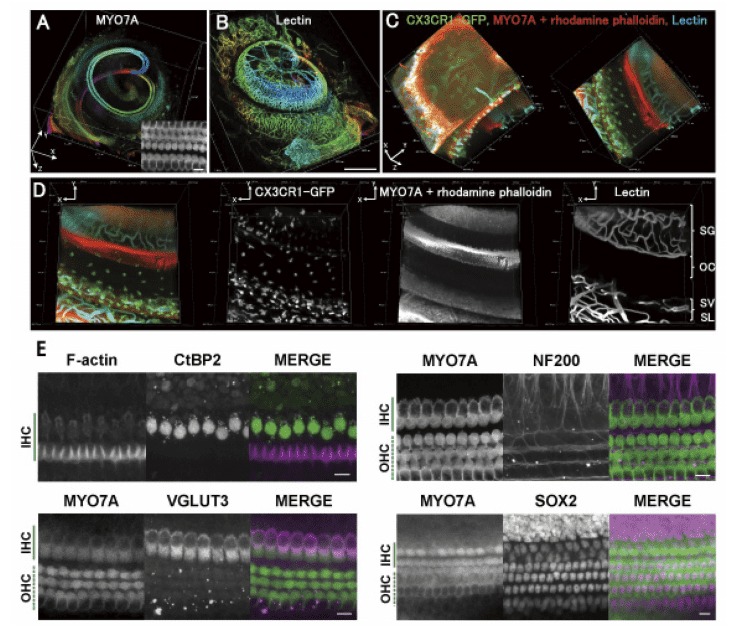
Figure 5. 蝸牛全解析
蝸牛内における有毛細胞(A)、血管(B)を観察することができる。蝸牛管(C)を拡大するとラセン神経節(SG)、コルチ器(OC)、血管条(SV)、ラセン靭帯(SL)内の血管、組織マクロファージ(CX3CR1-GFP)を観察することができる(D)。また、リボンシナプス(CtBP2)、ニューロフィラメント(NF200)、グルタミン酸トランスポーター(VGLUT3)、支持細胞核(SOX2)などの免疫染色も可能である。使用顕微鏡:Nikon A1MP、使用レンズ:N25X-APO-MP(NA1.10, WD2.00), VC 20x(NA0.75, WD1.00)
参考文献
- Fujimoto, C. et al. : Cell Death Dis., 8(5), e2780 (2017). DOI: 10.1038/cddis.2017.194
- Mizushima, Y. et al. : Biochem. Biophys. Res. Commun., 493 (2), 894 (2017). DOI: 10.1016/j.bbrc.2017.09.124
- Urata, S. et al. : eLife, 8, e40946 (2019). DOI: 10.7554/eLife.40946
- Urata, S. et al. : Bio-protoc., 9 (16), e3342 (2019).
- Ertürk, A. et al. : Nat. Protoc., 7 (11), 1983 (2012). DOI: 10.1038/nprot.2012.119
- Renier, N. et al. : Cell, 159 (4), 896 (2014). DOI: 10.1016/j.cell.2014.10.010
- Chung, K. et al. : Nature, 497, 332 (2013). DOI: 10.1038/nature12107
- Susaki, EA. et al. : Cell, 157 (3), 726 (2014). DOI: 10.1016/j.cell.2014.03.042









