【総説】核酸合成用ユニバーサルリンカー「PTリンカー」
本記事は、和光純薬時報 Vol.92 No.4(2024年10月号)において、徳島文理大学薬学部 張 功幸様に執筆いただいたものです。
1. はじめに
1980年代に開発されたホスホロアミダイト法は、基質や反応条件の改良、固相合成への適用、自動化を経て、オリゴヌクレオチド合成法として現在幅広く利用されている。その合成は通常、望みのオリゴヌクレオチドの3'末端のヌクレオシドを担持した固相担体を出発原料に用いて、3'末端から一塩基ずつ(ヌクレオチド単位で)伸長していく。伸長するための合成サイクルは、(1) 5'末端の水酸基上のジメトキシトリチル (DMTr) 基の除去、(2) フリーになった5'位水酸基と伸長したいヌクレオシドホスホロアミダイト体のカップリング、(3) 未反応の5'位水酸基が以降伸長しないようにするためのアセチル保護(キャッピング)、(4) カップリングにより構築された亜リン酸部のリン酸への酸化からなり、その後、(1) から (4) のステップを繰り返すことで望みのオリゴヌクレオチドを合成する。それゆえ、3'末端が非天然型ヌクレオシドやリンカー等の非ヌクレオシドの場合、それぞれを担持した固相担体を予め準備する必要があるため、非常に煩雑になる。
その解決策として、ユニバーサルリンカー(UL)と呼ばれるユニットを担持した固相担体が開発された1)。これまでに報告されたULの大半は、コアユニットとして1,2-ジオール構造を有しており、1つの水酸基はオリゴヌクレオチド伸長のためDMTr保護され、もう1つの水酸基はエステル結合を介してリンカー(主に、スクシニル基)が導入され、固相担体との連結に利用される。オリゴヌクレオチド合成後の塩基処理によりリンカーとコアユニットをつなぐエステル結合が切断され、固相担体からオリゴヌクレオチドと結合したままコアユニット(未放出体)が切り出され、その後環状リン酸を形成することで、コアユニットからオリゴヌクレオチドを放出する(図1)。従って、ULを担持した固相担体を用いた場合、最初のカップリングで導入したユニットがオリゴヌクレオチドの3'末端となるため、ULは3'末端の種類に関係なく使用できる。それゆえ、様々なものが担持された固相担体を準備しておく必要がないため、ULを担持した固相担体はオリゴヌクレオチド合成に頻繁に利用されつつある。とりわけ、オリゴヌクレオチドのハイスループット合成では、全てのウェルにULを担持した固相担体を配置することで、どのような配列にも対応できるため、ULの利用は不可欠である。
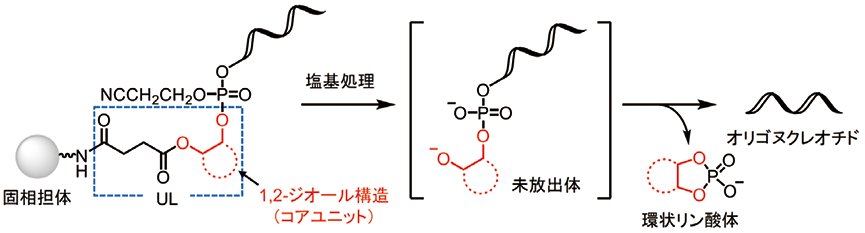
図1.塩基条件下によるUL からオリゴヌクレオチドの放出
そのような背景下、私たちの研究グループでは新たなULの開発を目指した研究を行っており2)、コアユニットにフェナントレン構造を有する二環性UL(PTリンカー)を最近報告した(図2)3)。このPTリンカーはオリゴヌクレオチド合成のためのULとして、幾つかの魅力的な特徴を有しており、この度、PTリンカーを担持した多孔質ガラス(CPG)が富士フイルム和光純薬株式会社より販売されることとなった。本稿では、PTリンカーの特徴やPTリンカーCPGを用いたオリゴヌクレオチドの合成を中心に紹介したい。
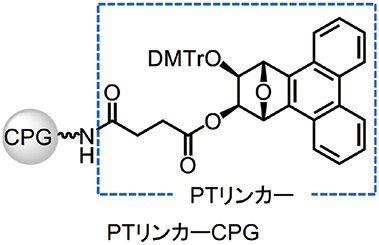
図2.PT リンカーを担持したCPG
2. PTリンカーの特徴
PTリンカーは、フェナントレンを含む二環性1,2-ジオール構造と、固相担体とアミド結合により連結するためのスクシニルユニットからなる(図2)。PTリンカーは、現在、オリゴヌクレオチド合成に広く利用されているマレイミド構造を持つ二環性UL(図3)と同じ7-オキサビシクロ [2.2.1] へプタン-1,2-ジオール構造を有する。それゆえ、PTリンカーを使用した際のオリゴヌクレオチド合成や合成後のオリゴヌクレオチドの放出は、これら二環性ULと同様の条件が利用でき、特別な条件を必要としない。
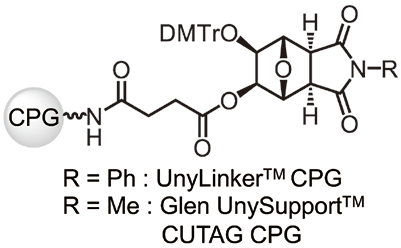
図3. 現在利用されている二環性UL を担持したCPG
一方、相違点としては、図3に示す二環性UL はオリゴヌクレオチド合成後の塩基処理によりマレイミド部の開環が認められるのに対し4)、PTリンカーは安定な構造からなるため、そのような反応は起こらない。また、フェナントレンは高い脂溶性を持つため、オリゴヌクレオチドと、オリゴヌクレオチドとPTが連結した未放出体oligonucleotide-PT(図4)の保持時間に有意な差が見られる。さらに、フェナントレンを含むコアユニットPTは高いモル吸光係数注1を持つため、未放出体oligonucleotide-PTだけでなく、オリゴヌクレオチドを放出した後のPT由来の各生成物(リン酸体p-PT、環状リン酸体cp-PT、コアユニットPT)をRP-HPLC分析において検出できる等の特徴が挙げられる(図4)。
注1: PTのメタノール中の254 nmにおけるモル吸光係数ε254は、61,000 M−1cm−1であり、260 nmにおけるモル吸光係数ε260は47,000 M−1cm−1である。
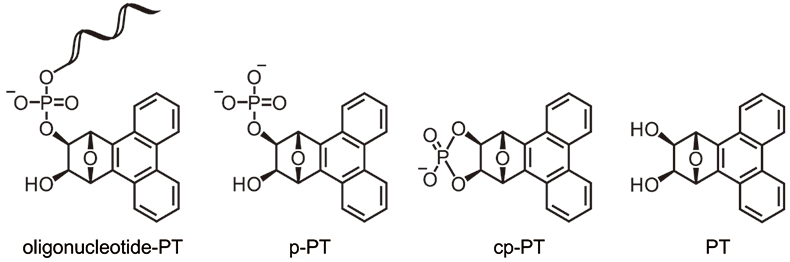
図4.塩基処理後に想定されるPT リンカー由来の生成物
3. PTリンカーを用いたオリゴヌクレオチドの合成
核酸塩基部の保護基を要しないオリゴチミジル酸(T10)を通常のDNA合成条件(DMTr-offモード)で合成した。その後、28%アンモニア水、室温、2時間(ULからオリゴヌクレオチドを完全に放出するには不十分な条件)処理した後、粗生成物のRP-HPLC分析を行った。
既存のマレイミド構造を持つ二環性UL(CUTAG CPG、図3)を用いた場合、望みのT10に加えて、マレイミド構造を含むコアユニットからオリゴヌクレオチドが放出されていない未放出体T10-MIならびに未放出体のマレイミド環の開環に伴う誘導体がT10のピークの周辺に確認された(図5a)。
PTリンカーCPGでは、フェナントレンの高い脂溶性のため、図5aと同条件ではT10のみしか確認できず、移動相をより低極性にすることで、未放出体T10-PTに加えて、cp-PTを確認できた(図5b, c)。ピーク面積からT10の量が少なく感じられるが、これはPTの254 nmにおけるモル吸光係数が非常に大きいことが影響している。一方、マレイミド構造を持つ二環性ULの推奨条件である28%アンモニア水、55 ℃、8時間処理を行うことにより、PTリンカーCPGにおいても、ほぼ完全にT10を放出することが確認でき、PT由来の各生成物p-PT、cp-PT、PT注2を検出できることが確認された(図6)。
注2: 処理条件によって、p-PT、cp-PT、PTの生成割合は異なる。p-PTとPTは主にcp-PTから生成するため、一般的に長時間処理や高温処理等、処理条件が強くなるにつれて、p-PTやPTの量が増える。
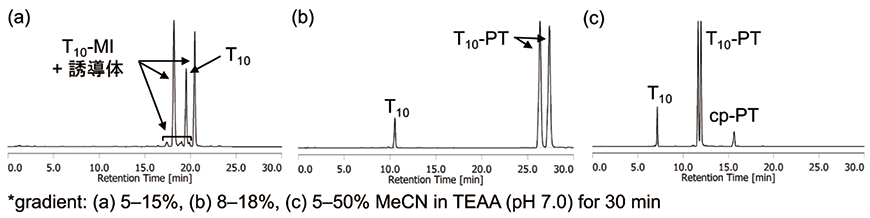
図5.CUTAG CPG とPT リンカーCPG の比較
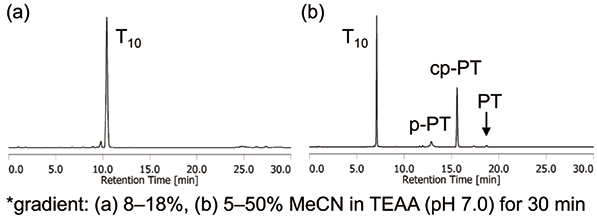
図6.PT リンカーCPG を用いたT10 合成
ホスホロチオアート修飾オリゴヌクレオチド(s-オリゴ)は多数のジアステレオ混合物であるため、RP-HPLC分析では通常ピークがブロード化する。それにもかかわらず、12塩基長のs-オリゴ合成でPTリンカーCPGの利用により、目的とするs-オリゴと未放出体を含むPT由来生成物のピークがPR-HPLC上で十分に分離した。また、十分な塩基(濃アンモニア水、55 ℃、8時間)処理により、未放出体は消失し、望みのs-オリゴに変換された。これらの結果から、PTリンカーを使用すれば、未放出体との分離に加えて、UL由来の各生成物の検出、分離も容易になることが期待される。
また、PTリンカーとカップリングする3'末端のヌクレオシドホスホロアミダイトとして、チミジン以外の天然ヌクレオシド並びに2'-OMe修飾体やLNA修飾体を用いた場合においても、目的のオリゴヌクレオチドを効率良く合成できた(図7)。マレイミド構造を持つ二環性ULの別の推奨条件である、AMA(28%アンモニア水:40%メチルアミン水溶液=1:1)、65 ℃、1時間処理を利用できることも確認済みである。また、固相担体上でリン酸部のシアノエチル基のみを除去するためのジエチルアミン(20% ジエチルアミンアセトニトリル溶液、室温、30 分)処理5)も問題なく行うことができる。
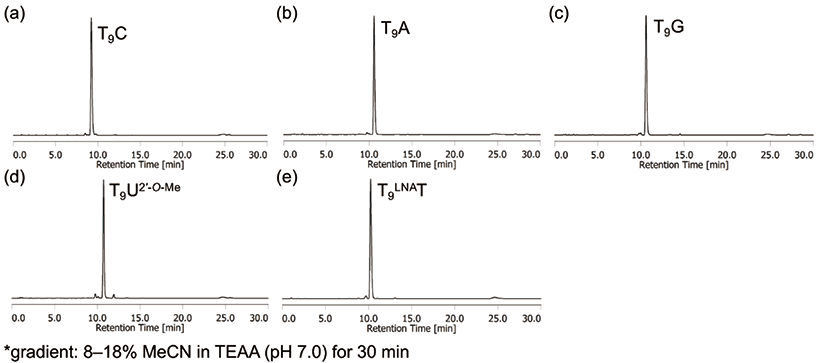
図7.3'末端に様々なヌクレオシドを有するオリゴヌクレオチドの合成
次に、DMTr-onモードでT10を合成した。合成後、カートリッジカラム(Sep-Pak® C18カートリッジ等)精製を行い、その生成物をRP-HPLCにより分析した(図8)。結果、T10-PTは確認されず、カートリッジ精製により、PT由来生成物の多くが除去された。さらに、1%トリフルオロ酢酸水溶液(カートリッジ精製時の脱DMTr化条件)中、酢酸エチルで複数回抽出することでp-PTとcp-PTを除去することも可能であった。
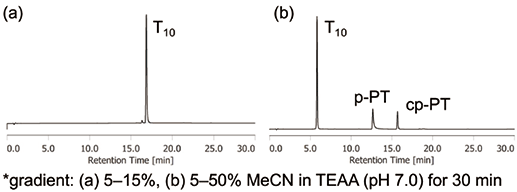
図8.DMTr-on モード合成
また、最近私たちの研究グループは、オリゴヌクレオチド合成においてULから伸長する際の、ヌクレオシドホスホロアミダイトとしてシアノエトキシ基の代わりにイソプロポキシ基やネオペンチル基等のアルコキシ基を利用することで(図9)、ULからオリゴヌクレオチドの放出を温和な条件下、実現できることを報告した6)。そこで、PTリンカーCPGとのカップリング(3'末端となる最初のカップリング)のみイソプロポキシ基を有するチミジンホスホロアミダイトを用い、その後、通常のシアノエトキシ基を有するチミジンホスホロアミダイトを用いてT10を合成した(DMTr-offモードの通常合成)。合成後の塩基処理として、温和な条件(UltraFAST DeprotectionあるいはUltraMILD Deprotection条件)で知られる3つの条件7)を試みたところ、いずれもオリゴヌクレオチドの放出が効果的に行われていることが明らかとなった(表1)。また、50 mM K2CO3/MeOHの条件を使用できれば、イソプロポキシ基の代わりに市販のメトキシ基を用いても、ほぼ完全にT10の形で得ることができた(T10 : T10-PT=>99 : 1)。PTリンカーとO-アルキルホスホロアミダイトの併用は、温和な条件で大半のオリゴヌクレオチドを放出でき、さらに残存する未放出体はPTの脂溶性のため分離が容易であることから、塩基に対する安定性が乏しい修飾オリゴヌクレオチドの合成に有用であることが期待される。
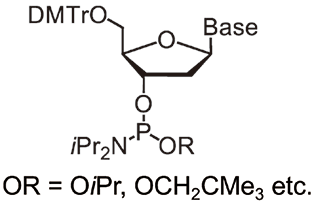
図9.O -アルキルホスホロアミダイト
4. おわりに
以上紹介したように、今回私たちが開発したPTリンカーは、既存のULと同様、天然、非天然を問わず、様々なオリゴヌクレオチド合成に利用できると考えられる。さらに、本稿で紹介した以外の、マレイミド構造を有する二環性ULで利用されるオリゴヌクレオチドの放出条件(メチルアミンガス(30 psi)、65 ℃、30分等8))も利用できる可能性が高い。オリゴヌクレオチド合成の際に、PTリンカーCPGをぜひお試しください。
参考文献
- Review : Guzaev, A. P. : Curr. Protoc. Nucleic Acid Chem., 53, 3.1.1 (2013).
- (a) Yamamoto, K. et al. : Tetrahedron, 92, 132261 (2021). (b) Yamamoto, K. et al. : Synthesis, 53, 4440 (2021).
- (a) Fuchi, Y. et al. : Synthesis, 55, 1112 (2023). (b) Fuchi, Y. et al. : Curr. Protoc., 4, e1013 (2024).
- Ravikumar, V. T. et al. : Org. Process Res. Dev., 12, 399 (2008).
- Capaldi, D. C. et al. : Org. Process Res. Dev., 7, 832 (2003).
- Yamamoto, K. et al. : J. Org. Chem., 88, 2726 (2023).
- Glen Report 20.24 (October 2008).
https://www.glenresearch.com/reports/gr20-24 - Glen Report 34.22 (November 2022).
https://www.glenresearch.com/reports/gr34-22




