【テクニカルレポート】ヒト腎細胞3D-RPTEC®の開発と創薬研究での有用性
本記事は、和光純薬時報 Vol.92 No.4(2024年10月号)において、日機装株式会社 インダストリアル事業本部 精密機器技術センター 高橋 越史様、森村 馨様に執筆いただいたものです。
はじめに
従来使用されていたヒトの腎臓細胞としては株化細胞の「HK-2細胞」、初代細胞の「ヒト初代近位尿細管上皮細胞(RPTEC)」がありました。これらの細胞は薬物トランスポーターの発現量が低く1)、培養日数によって腎臓関連の機能を失っていく2)ことがわかっています。そのため、近年ではヒトiPS細胞由来腎オルガノイドや新鮮腎モデルを用いた研究が精力的にされています。しかしながら、細胞の成熟度や創薬におけるコストならびにスループットの観点から未だ課題が多く、現状では多くの製薬企業が腎臓の評価については「動物実験」を行うことが主流かと思います。
このような中、日機装は特許を取得した独自の細胞加工技術によって、高機能なヒト近位尿細管上皮細胞のスフェロイドを構築し、初代細胞の欠点である腎機能の低さやロット差を克服した3D-RPTEC®の開発に成功しました。
3D-RPTECの製品特長
本製品の大きな特長は「Ready-to-use」な製品であることです。96wellプレートでお届けし、1つのウェル底に1つの腎細胞スフェロイドが培養されています。製品ロットごとの生存率、ロット差、ドナー差が非常に少ないことを確認しており、品質が安定した製品となっています。
機能としては主に「薬物トランスポーター」と「エンドサイトーシス」について確認しております。腎臓では薬物の取込みと排泄の機能には「薬物トランスポーター」が大きく関わっています。3D-RPTEC®では特に、OAT1について従来の細胞系より高い発現量を示しました(図1-A)。また、「エンドサイトーシス」ではMegalinやCubilinというエンドサイトーシス受容体が機能しています。細胞膜上のプロテオーム解析においてこれらの高い発現量を示しました(図1-B)。加えて、本細胞の特筆すべきことは、同じ形態を維持したまま、長期間培養できることです。納入後、1ヵ月の培養期間においても遺伝子発現量や生存率を維持していることが確認されています。そのため、長期の慢性実験等にもご利用できます。
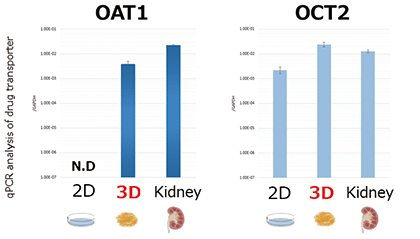
図1-A
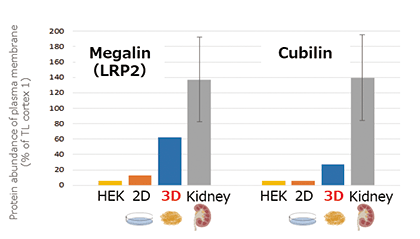
図1-B
図1.腎臓関連の遺伝子発現量およびタンパク質発現量の解析
薬物誘発性腎障害
腎臓は心臓や肝臓と同様にヒトで毒性の起こりやすい臓器であり、薬物誘発性腎障害(腎毒性)は創薬における大きな課題と言われています。これは、腎毒性を検出する有用なシステムが無いことが要因であり、動物実験ではおよそ副作用を予測する感度は50%程度と報告3)されています。そのためヒトに投与して初めて腎毒性を発症することもあり、創薬の早期段階にてヒトの腎毒性を検出する有用な評価系の構築が必要です。
腎毒性の主要なターゲットは近位尿細管上皮細胞であり、腎臓への直接障害の薬物のうち約7割は近位尿細管障害とも言われています。また、腎毒性薬物の多くは薬物トランスポーターの基質として取込みや排泄が行われます。よって、薬物トランスポーターが高く発現した近位尿細管上皮細胞のスフェロイドモデルある「3D-RPTEC®」は腎毒性を評価するのに適した細胞です。
本細胞を用いた腎毒性評価としてATP測定を実施しました。腎臓は肝臓と同様にエネルギー産生が高いため、細胞内ATP量の測定は腎細胞にとって良いマーカーです。腎毒性薬物として、Cisplatin(OCT2の基質)およびAdefovir(OAT1の基質)を曝露した結果、用量依存的にATP量が減少し、それらは各トランスポーターの阻害剤(Cisplatinの場合はCimetidine、Adefovirの場合はProbenecid)で有意に軽減されました(図2)。よって、3D-RPTEC®は「トランスポーター介在性の腎毒性」を検出できることが示されました。
さらに、腎毒性の有る化合物と無い化合物を合わせて32化合物評価し、ヒトの腎毒性副作用の予測精度を検証した結果、3D-RPTEC®の7日間曝露では、従来よりも高い確度(感度80%以上、特異度90%以上)でヒトの腎毒性を予測することができました。
また、近年の国内外の創薬研究では「核酸医薬品」が非常に注目されています。核酸医薬品は従来の低分子医薬品よりも特異性が高く、一方で抗体医薬品よりも安価に製造できることからニューモダリティとして期待されている医薬品です。核酸医薬品の課題として腎毒性の副作用を多く発症する事が挙げられます。3D-RPTEC®はメガリン等のエンドサイトーシス受容体の高発現により核酸の導入も可能であることが示されており、「核酸医薬品の腎毒性評価ツール」としても期待できます。
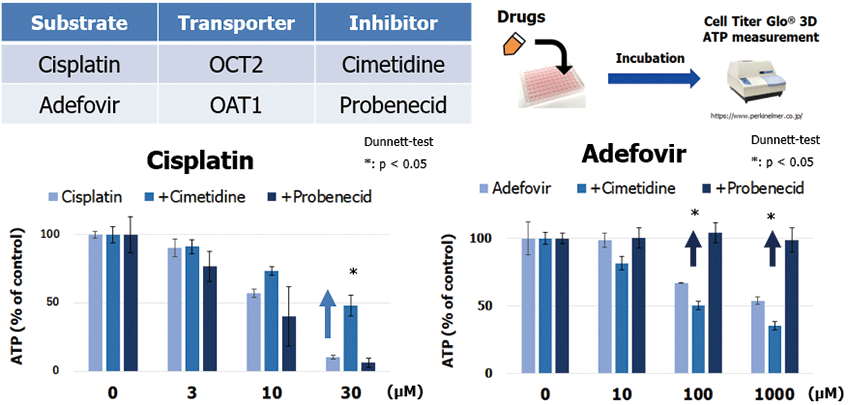
図2.ATP 測定によるトランスポーターを介した腎毒性評価
腎毒性バリデーション試験の取り組み
このように、3D-RPTEC®を用いた腎毒性評価は創薬におけるツールとして非常に期待できる評価系です。3D-RPTEC®を用いた腎毒性評価に関する研究はAMEDレギュラトリーサイエンス事業に採択され(課題名:三次元培養ヒト近位尿細管上皮細胞を用いた薬物誘発性腎障害in vitro評価手法の開発、金沢大学 荒川先生)、評価手法の標準化を進めています。さらに、本評価系を国内外の研究現場に広く導入するため、「OECDテストガイドライン化」を目指し、2024年よりバリデーション試験を進めています。製薬企業、食品企業、受託機関の複数社より賛同いただき、バリデーション活動が進行中です。in vitro腎毒性評価を標準化することにより、①毒性スクリーニングの効率化、②腎毒性の回避、③動物実験の代替などが実現し、創薬において大きなメリットが期待されます。
今後の展望
3D-RPTEC®は従来の細胞系と比べて非常に高機能なヒト腎臓スフェロイドモデルであり、腎臓の毒性評価や薬物動態評価に利用できる細胞です。毒性評価では核酸医薬品など、ニューモダリティを含む今後の創薬研究において有用な細胞です。また、ヒト由来の高機能な腎臓細胞であることから、腎疾患の薬理研究にも利用が期待されます。
今後、本製品の機能を維持したまま「凍結」して海外輸送できるような体制を構築中です。海外では国内以上に動物実験の代替やin vitro評価系の実用化が進んでいるため、海外の研究現場でも3D-RPTEC®を広く使ってもらいたいと思います。今後、より多くの皆様に3D-RPTEC®をお使い頂き、本細胞が腎臓の総合的なin vitro評価のツールとなれるよう研究が進展していくことを期待しております。
参考文献
- Jenkinson, S. E. et al. : Pflugers Arch, 464 (6), 601 (2012).
- Weiland, C. et al. : Toxicology in Vitro, 21 (3), 466 (2007).
- Monticello, T. M. et al. : Toxicol Appl Pharmacol, 1 (11), 100 (2017).




