【テクニカルレポート】ScreenFect™A および ScreenFect™A plus による遺伝子導入の特徴
本記事は、和光純薬時報 Vol.86 No.3(2018年7月号)において、埼玉医科大学 医学部 微生物学教室 高木 徹 様、村上 孝 様に執筆いただいたものです。
はじめに
近年のゲノム科学の発展は生物ゲノムの塩基配列や発現解析を格段に飛躍させた。そこで解析された遺伝子の機能を解析することに欠かせないのが遺伝子導入技術である。プラスミド DNA や siRNA などの核酸を細胞に導入し、細胞の変化や機能を解析する手法は、現在の生物科学でもっとも基本的な技術の一つになっている。
遺伝子工学技術の発展に伴い、現在では多くの遺伝子導入法や遺伝子導入試薬が登場している。また、遺伝子導入法として、ウイルスベクターを用いた方法もあり、ヒト疾患に応用できる安全なウイルスベクターも開発され応用されている 1)。さらに、CRISPR/Cas9 法の登場により、2 本鎖 DNA を切断して、目的の遺伝子を削除・挿入できるようになった。この CRISPR/Cas9 法を行う上でも、遺伝子導入法はとても重要なものになっている 2)。
このように、現在の生物科学実験を行う上で、目的の細胞に遺伝子を導入し、目的のタンパク質を発現させることは欠かせないことであり、簡便かつ安定的な発現が求められる。本稿では筆者の経験を踏まえ、簡易な手順で目的の細胞への遺伝子導入が高い効率で実現できる ScreenFect™A、ScreenFect™A plus の特徴について紹介したい。
遺伝子導入方法の種類と特徴
目的の細胞への遺伝子導入法として主に、リン酸カルシウム法、リポフェクション法、DEAE デキストラン法、エレクトロポレーション法、マイクロインジェクション法、ウイルスベクター法があり、それぞれの特徴がある 3)。
リン酸カルシウム法
正電荷をもつカルシウムイオンを負の電荷をもつ DNA に結合させリン酸を加えると、カルシウムイオンとリン酸が結合し沈殿が生じる。このリン酸カルシウム・DNA 複合体が膜輸送であるエンドサイトーシスによって、細胞内に取り込まれ、核に移行することにより遺伝子を発現する方法である。特殊な機器や技術は必要なく、比較的簡単に行うことができる。
リポフェクション法
陽性電荷脂質などから成る脂質二重膜小胞(リポソーム)と導入する DNA との電気的な相互作用により複合体を形成し、貪食やエンドサイトーシスにより細胞内に取り込ませる方法。遺伝子導入効率が高く、オリゴヌクレオチドや二本鎖 RNA の導入も可能であり、特殊な機器や技術は必要なく、簡単に行うことができる。
DEAE デキストラン法
本法による動物細胞への遺伝子の取り込みや核内輸送のメカニズムは、DEAE デキストランと DNA が複合体を形成して細胞表面に結合し、エンドサイトーシスにより細胞内へと移行する。リン酸カルシウム法やリポフェクション法に比べて遺伝子導入効率が低く、細胞毒性がある。
エレクトロポレーション法
高電圧パルスにより一過性に細胞膜の脂質二重層の膜構造を不安定化させ、DNA を取り込ませる方法。導入効率は電圧・電気パルスの長さ・温度・細胞や DNA 濃度・緩衝液の組成などの条件により左右される。また、高電圧パルスをかけるので、他の方法と比較してバイアビリティーが低い。操作が簡単で遺伝子導入効率は高いが、高価な専用機器が必要である。
マイクロインジェクション法
1 個の細胞に微細ガラス注射針を刺して試料を導入する方法。原理は簡単ながら、高度な技術を必要とする。遺伝子改変動物(マウスやラットなど)の作製における常道で、受精卵に遺伝子を注入する。
ウイルスベクター法
レトロ(レンチ)ウイルス、アデノウイルス、アデノ随伴ウイルスなど、ウイルス固有の生活環を応用し、目的の細胞に感染させ遺伝子を導入する。組換えウイルスを作製する必要があるため、アデノ随伴ウイルス意外はバイオセーフティーレベルレベル 2(BSL2)以上の施設が要求される。目的に合ったウイルスベクターを用い、組換えウイルスさえ作製できれば、遺伝子導入効率も高い。
ScreenFect™A および ScreenFect™A plus(リポフェクション法)を用いた遺伝子導入の例
ScreenFect™A シリーズの特記すべきポイントとして、使用面での簡便さと導入効率の高さにある。
1) one-step 法の簡便さ
従来より幅広く利用されているリポフェクション試薬の多くは、遺伝子導入の前日に目的の細胞を調整(播種)しておく必要がある。また、リポソームと DNA の複合体形成を妨げるため、抗生物質フリーや血清フリーの培養液を用いて培養しておかなければならない。それに対して ScreenFect™A シリーズでは、このような操作は必要ない。さらに目的の細胞を前日から調整しておく必要がなく、遺伝子導入実験の当日に、本試薬を用いて目的の遺伝子を導入することができる。使用する細胞は抗生物質も血清も含んでいる培地でも遺伝子導入を行えるので、時間的に制約される場合でも細胞の調整や培地交換の必要がなく、非常に簡便にスムーズに遺伝子導入を行うことができる。
2) 遺伝子導入効率の高さ
ScreenFect™A および ScreenFect™A plus を使用し、ヒト胃がん細胞株 MNK45 細胞とヒト膵がん(肝転移)細胞株である KMP8 細胞を用いて遺伝子導入効率と生存率の例を示す。尚、導入した遺伝子は GFP(Green Fluorescent Protein)をコードする pCAGGS-EGFP を使用し、生存率の確認には Propidium Iodide(PI)染色を行い、フローサイトメーターを用いて比較した。
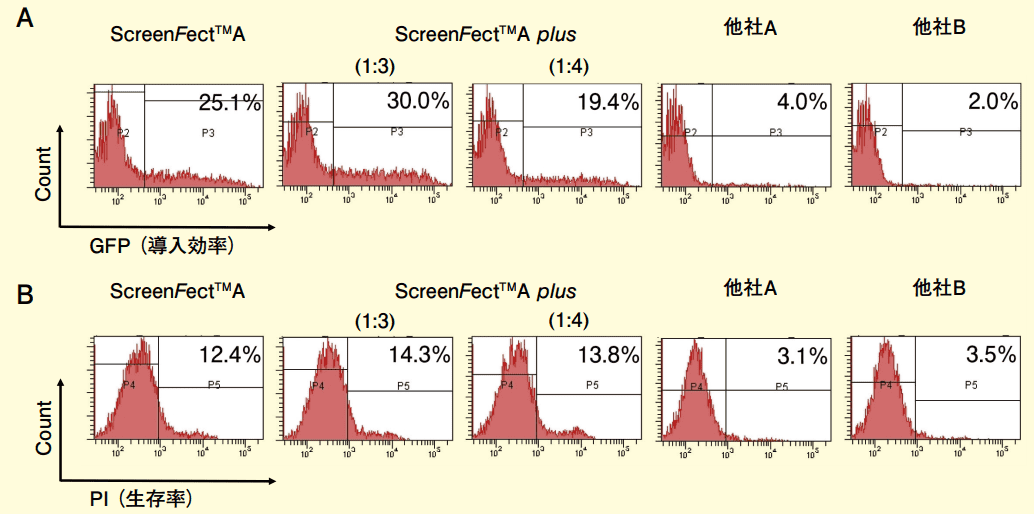
図1.MNK45 細胞を用いた遺伝子導入効率の比較
ScreenFect™A および ScreenFect™A plus は遺伝子導入当日に細胞密度が 80% confluent になるように調整した。一方、他社試薬用では 6 well plate に 2.5 x 105 個ずつ細胞を前日に幡種した。ScreenFect™A および ScreenFect™A plus は one-step 法、他社製品については two-step法で遺伝子導入を行った。ScreenFect™A plus においては、試薬と DNA 量を(1:3), (1:4)の2 通りで導入効率の比較を行った。遺伝子導入 24 時間後に、細胞をトリプシン処理し、培養液で 2 回洗った。遺伝子導入効率(GFP 陽性率)の測定とPropidium Iodide (PI : 2μg/mL ; 5 分間)染色による細胞生存率の測定は FACSCant II フローサイトメーターで行った。(A) ScreenFect™A, ScreenFect™A plus (1:3), (1:4), 他社 A, 他社 B について GFP 発現細胞を測定することにより、遺伝子導入効率の確認を行った。(B) ScreenFect™A, ScreenFect™A plus(1:3), (1:4), 他社 A, 他社 B について PI 陽性細胞を測定することにより、生存率の測定を行った。
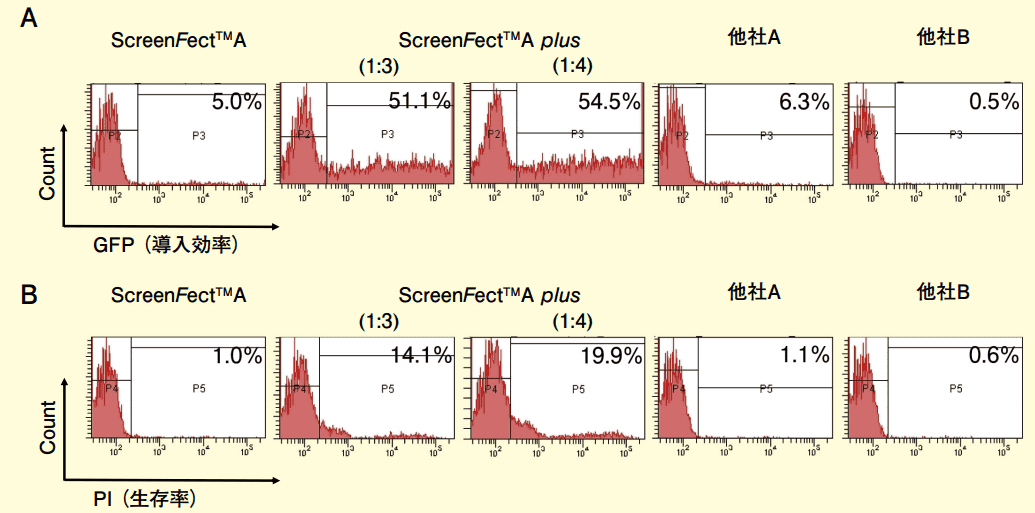
図2.KMP8 細胞を用いた遺伝子導入効率の比較
実験条件は図1と同じ。(A) ScreenFect™A, ScreenFect™A plus (1:3), (1:4), 他社 A, 他社 B について GFP 発現細胞を測定することにより、遺伝子導入効率の確認を行った。(B) ScreenFect™A, ScreenFect™A plus(1:3), (1:4), 他社 A, 他社 B について PI 陽性細胞を測定することにより、生存率の測定を行った。
MNK45 細胞(図 1)では他社製品と比較して、生存率はわずかに低下するものの、遺伝子導入効率が非常に高いことが確認された。遺伝子導入効率は他社と比較して 5~8 倍高い結果となった。KMP8 細胞(図 2)でも同様に、生存率はわずかに低下するが、遺伝子導入効率が非常に高い。他社と比較して 8 倍以上高い導入効率を示した。
このように他社製品では非常に導入効率が低い細胞でも、ScreenFect™A シリーズを用いることで確実に目的の遺伝子を効率よく導入することができるうえに、前日からの細胞調整も必要なく、数多く市販されている遺伝子導入試薬の中で非常に有効な試薬だと考えられる。遺伝子導入試薬(ポリマー)の細胞毒性については、ScreenFect™A plus でやや高い様に見える。遺伝子導入後の実験評価項目にもよるが、十分な遺伝子発現が得られる利点の前には大きな障壁になる様には見えない魅力がある。
参考文献
- Cong, L. et al. :"Multiplex genome engineering using CRISPR/Cas systems", Science, 339, 819(2013).
- Cucchiarini, M. :"Human gene therapy : novel approaches to improve the current gene delivery systems", Discov. Med., 21, 495(2016).
- 村上 孝:「発光・蛍光蛋白質による細胞標識の基本的手技とその応用」,Surgery Frontier, 16, 97(2009).




