【連載】LC/MS分析 −測定原理から様々な分野での活用例− 第2回 LC/MSを用いるキラルアミノ酸分析
本記事は、和光純薬時報 Vol.92 No.1(2024年1月号)において、味の素株式会社 バイオ・ファイン研究所 唐川 幸聖様に執筆いただいたものです。
はじめに
アミノ酸はタンパク質の構成成分であるとともに遊離体としても神経伝達や免疫などに関わる様々な生理機能を有している。グリシンを除くアミノ酸には光学異性体(旋光性以外の物理的、化学的性質が全く同じ異性体)が存在しており、D体、L体と呼ばれている。タンパク質構成アミノ酸や生体内に存在する多くのアミノ酸はL体であるが、D体も存在しており、L体とは異なる生理機能をもつことが知られている。代表的なD-アミノ酸の機能としては、D-セリンが脳で神経伝達や学習、記憶に寄与することや、D-アスパラギン酸がホルモンの合成や分泌の調節に関わっていることが知られている。また、細菌においては、D-アラニンやD-グルタミン酸、D-アスパラギン酸をはじめとする種々のD-アミノ酸がペプチドグリカン構成成分として産生、利用されていることや、エビや二枚貝などの水生無脊椎動物において、D-アラニンが浸透圧調節に利用されていることも報告されている。酒類や酢、乳酸菌飲料などの身近な発酵食品にD-アラニンやD-グルタミン酸、D-アスパラギン酸などが多く含まれていることも知られている。また近年、慢性腎臓病や軽度認知障害(MCI)患者において血漿中D-アミノ酸が変動することからバイオマーカーとしての有用性も報告され、診断や創薬への活用が期待されている。しかし、総じてL-アミノ酸と比較すると、D-アミノ酸の存在や機能はまだ明らかになっていないものが多く、研究者らの高い関心を集めている。
キラルアミノ酸の分析
一般的に生体中のD-アミノ酸含量はL-アミノ酸と比較して非常に少なく、検出し定量することが非常に難しいため、分析技術がD-アミノ酸研究のボトルネックになっていた。そのため、これまでのD-アミノ酸研究は、新たなD-アミノ酸分析法を開発した分析研究者とその共同研究者らによってはじめてD-アミノ酸の存在や分布、変動、機能が明らかにされてきた。言い換えると、D-アミノ酸の研究を推進するためには、D-アミノ酸の最適な分析手法が必要である。
生体試料や食品など複雑な試料中の微量なD-アミノ酸を分析するためには、L-アミノ酸を含めて他の夾雑成分と分離できる選択性の高さと、高い検出感度が求められる。アミノ酸のD体、L体を分離する手法として、直接法と間接法という2種類のアプローチがある1)。直接法は、キラルカラムでD体、L体のアミノ酸を分離し、蛍光検出器や質量分析計(MS)で測定する手法であり、代表的な技術として、九州大学の浜瀬らが開発した、4-フルオロ-7-ニトロ-2,1,3-ベンズオキサジアゾール(NBD-F)による蛍光誘導体化と、逆相カラムとキラルカラムを組み合わせた二次元HPLC法を用いた分析法がある2)。間接法は、D体、L体のアミノ酸をキラルな誘導体化試薬と反応させることでジアステレオマーにし、逆相カラムで分離した後、蛍光検出器や質量分析計で測定する手法である。代表的なものとして、オルトフタルアルデヒド(OPA)とキラルチオールを用いてアミノ酸をジアステレオマー誘導体化し、逆相カラムで分離し、蛍光検出する手法がある3)。アミノ酸は両性イオン物質であり親水性が高いため逆相カラムでは保持が弱く、誘導体化することで疎水性を付与して、逆相カラムでの保持、分離能を高める手法が一般的に用いられている。アミノ基を誘導体化することで、アミノ基を有する化合物のみを選択的に検出し、かつ誘導体化試薬の構造にキラルな骨格と蛍光分子やMSでイオン化されやすい構造を検出基として導入することで分離や感度を向上させることができるため、これまでに様々なアミノ酸分析用の誘導体化試薬が開発されている。
LC/MSを用いるアミノ酸分析
近年、生体試料や食品のアミノ酸分析にはLC/MSが用いられることが多くなってきた。質量分析計を検出に用いることで質量ごとに化合物を検出できるため、従来のUVや蛍光検出法よりも選択性の高い分析が可能である。従来のHPLCとニンヒドリン試薬によるポストカラム誘導体化を用いるアミノ酸分析法は高精度かつ簡便に約120分で約40種のアミノ酸の分析が可能であるのに対して、LC/MSを用いるアミノ酸分析は高速かつ高感度な分析が可能である。代表例として、富士フイルム和光純薬より販売されているAPDSタグ®ワコーを用いるプレカラム誘導体化によるLC/MS分析法があり、38種のアミノ酸を8分という非常に短時間で分析が可能である4)。さらに自動で誘導体化を行う分析機器として「UF-Amino Station」(島津製作所)も開発、販売されており、バイオマーカー研究やアミノ酸製品の開発など多検体の分析が必要な研究に利用されている。一方で、MS検出においてはマトリックス効果によるイオン化抑制やイオン化促進の影響により検出感度が大きく振れてしまうことが注意点である。サンプル、測定対象成分によりマトリックス効果は大きく変動することから、精密に定量分析を行うためには同じ保持時間に溶出する安定同位体を内部標準として用いて補正することが必要となる。アミノ酸のLC/MSでの精密定量に必須な内標準物質(アミノ酸安定同位体の混合溶液)は試薬メーカー(富士フイルム和光純薬)から入手可能である。
(R)-BiACプレカラム誘導体化によるLC/MSキラルアミノ酸分析法
前述のAPDSタグ®ワコーを用いるアミノ酸分析は、例えば、アラニン、セリン、グルタミン酸といったように各アミノ酸を定量可能であるが、そのアラニンのうちL-アラニンとD-アラニンは分離できていないためL体とD体の合計の量として定量される。多くのアミノ酸研究では、この分離できていないデータをほぼL体だと解釈して研究が進められているが、試料によってはD体が多く含まれる場合があり、厳格にアミノ酸の機能や変動を評価するためにはD体とL体を分けて分析する必要がある。
LC/MSでキラルアミノ酸を分析する手法として、我々は軸不斉型キラル誘導体化試薬((R)-BiAC (Biaryl axially chiral-tag))を独自に開発し、LC/MSでD,L-アミノ酸を一斉分析する方法を確立した5)。(R)-BiAC試薬はアミノ基と反応してアミノ酸を選択的にラベル化し、ジアステレオマーにすることでD体とL体を逆相カラムで分離可能にし、かつ質量分析計で高感度に検出できるよう設計されている(図1)。
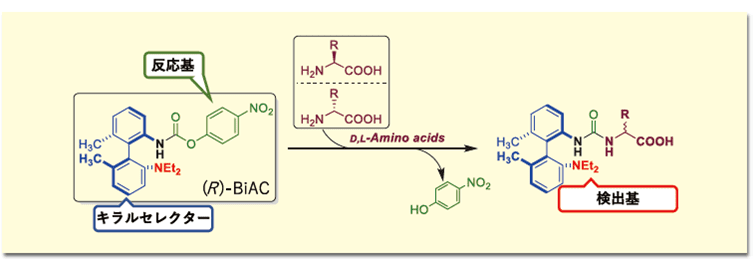
軸不斉骨格の誘導体化試薬構造と、高分離のsub-2μmカラムによる分離を組み合わせることにより、19種のD,L-アミノ酸を分離度Rs 1.9以上、分析時間19分で一斉分析可能である。さらに、MS検出に優れた検出基をもつことで1インジェクションあたりattoモルレベルという既存試薬にはない非常に高い感度での検出が可能であり、微量のD-アミノ酸を再現よく分析することができる。D,L-アミノ酸の標準溶液を分析した抽出マスクロマトグラムを図2に示す。

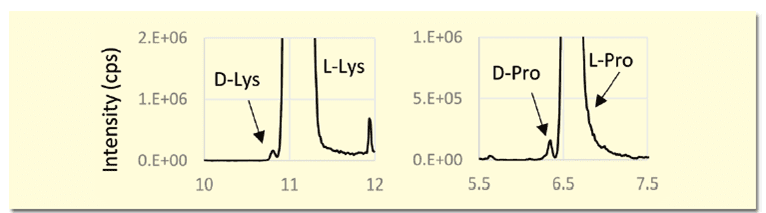
本分析法はD体がL体よりも前に溶出することが特徴であり、生体試料のようなL体が過剰なサンプルにおいて、D体が前に溶出することでL体のピークの裾にD体が埋もれずに検出できるメリットがある(図3)。
本分析法は感度、選択性ともに良好であり、食品から生体試料(血漿、尿、糞便、組織、細胞)、微生物、など幅広い試料に適用でき、かつ、試薬とLC/MSの分析装置があれば、誰でも分析を実施することが可能な汎用的な分析法である6,7)。食品分析の事例として乳酸菌飲料を分析した際のマスクロマトグラムを図4に示す。
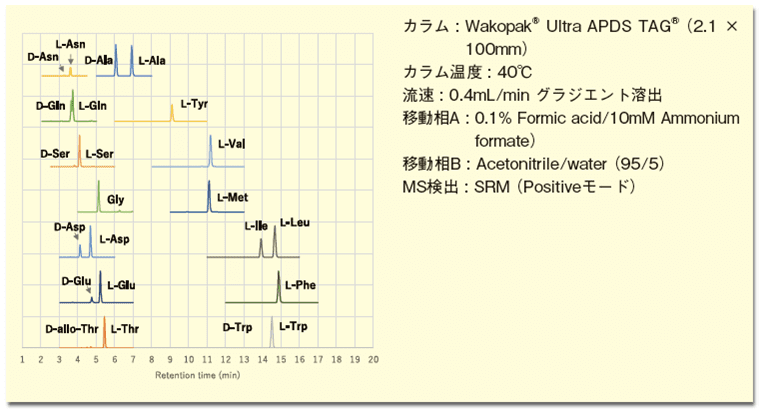
D-アラニン、D-グルタミン酸、D-アスパラギン酸などのD-アミノ酸の存在を明確に確認することができる。本(R)-BiAC試薬は富士フイルム和光純薬より入手可能である。
おわりに
D-アミノ酸を手軽に分析できるようになったことで、様々な領域においてD-アミノ酸の機能や有用性が明らかにされてきている。本稿で紹介した分析法以外にも、LC/MSを用いるアミノ酸分析法やさらにD体とL体を分けるキラルアミノ酸分析法が多く報告されているが、その特徴や性能は様々である。標準溶液では測定ができるが、実試料では夾雑成分の影響やマトリックス効果により定量ができないことも多くある。事前に測定する試料のバリデーションが必要である。
本(R)-BiAC試薬はあらゆる試料において必要な感度と選択性を得ることができ、バリデーションも取りやすいため、D-アミノ酸研究を加速できると期待される。
参考文献
- 唐川幸聖,原田真志 : 和光純薬時報, 87 (1), 5(2019).
- Ishii, C. et al. : Chromatography, 41, 1(2020).
- Gogami, Y. et al. : J. Chromatogr. B, 879, 3259 (2011).
- Shimbo, K. et al. : Rapid Commun. Mass Spectrom., 23, 1483 (2009).
- Harada, M. et al. : J. Chromatogr. A, 1593, 91 (2019).
- Harada, M. et al. : Symmetry, 12, 913 (2020).
- Karakawa, S. et al. : Chromatography, 44, 21 (2023).




