【連載】フロー合成の魅力 ~安全・高効率なグリーンものづくりへ~ 第3回 フロー合成の実践 ~学術・産業への応用~
本記事は、和光純薬時報 Vol.92 No.1(2024年1月号)において、静岡大学 グリーン科学技術研究所 間瀬 暢之様に執筆いただいたものです。
フロー合成の精密性と拡張性の利点は、多くの研究室や企業で評価され、精密有機合成の分野にも導入が進んでいる。その結果、新規・新奇な学術的知見が得られ、産業への応用も広がっている。これまで、「フロー合成の魅力 ~なぜフロー合成?~」と「フロー合成の基礎 ~要素技術と設計~」について概説してきた。今回は、具体的なフロー合成の実践例と学術・産業への応用について紹介する。
フロー合成手法の浸透
フロー化学分野の開発を促すとともに、コミュニティに新しい研究結果や情報を迅速に提供するプラットフォームとして、フロー化学に特化したジャーナル「Journal of Flow Chemistry(Springer出版社)」が2011年1月に発刊され、多種多様な報告例が載っている。そして、2020年代になり、フロー化学の領域は、ほぼ毎日のように新しい論文が世に送り出されるほど学術的に発展している。このように、有機合成化学において、フロー合成はバッチ合成とともに、太い柱となる一般的な手法として着実に浸透し始めている。一方、ファインケミカルズ、特に医薬品の合成においては、2000年代初頭にいくつかの研究グループが既知の医薬品のフロー合成について報告しているものの1)、多くの反応と後処理工程が必要なため、複雑な構造を持つ化合物に対するフロー合成の開発は遅れていた。
フロー合成におけるポイント
フロー合成の適用を考慮する際、反応工程のフロー化による短時間化やスケールアップに注目しがちだが、このアプローチには盲点がある。実際の目的物合成には、一般的に多数の工程が含まれる(図1-①)。そのため、反応工程だけを短縮・増強しても、全体のプロセス時間短縮や生産量向上とはならない(図1-②・③)。したがって、フロー合成の効果を最大限に発揮するには、全体のプロセスを包括的に最適化する視点が必要となる。例えば、抽出・洗浄・乾燥・濃縮などの後処理や、各反応後の精製工程をできる限り省略することは、全体のプロセスを効率化する鍵となる。この視点は、バッチ合成であろうとフロー合成であろうと重要であり、より良い合成プロセス構築への一歩となり、究極の完全合成へとつながる。
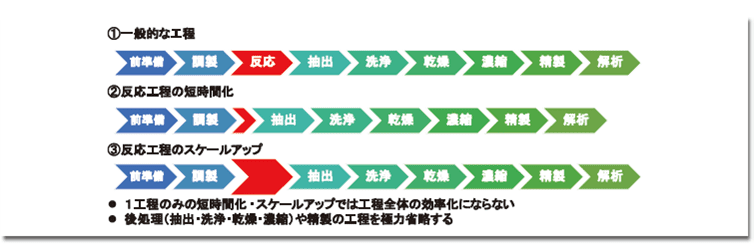
連結フロー合成におけるポイント
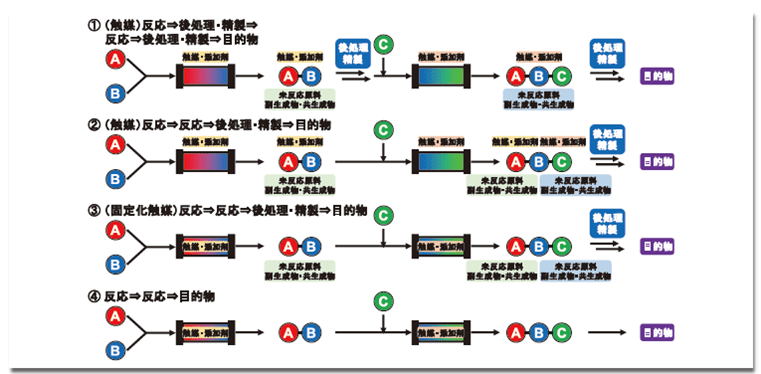
一つの反応工程で目的物を合成できればよいが、多くの場合、複数工程により複雑な目的物を合成する。各フロー反応工程を連結する上で、考慮しなければならないことは、反応溶液に含まれる触媒、添加剤、未反応原料、副生成物、共生成物、溶媒などが、次のフロー反応へ、そのまま移動する点である。したがって、これらが次反応に悪影響を与える場合、各段階において、後処理・精製工程が必要となる(図2-①)。これらの工程すべてをフロー化することは、システムが複雑となり、投資額も大きくなるので適切ではない。一方、もし触媒等が次反応に影響しない場合、もしくは、プラスの影響を与える場合、最終段階で後処理・精製工程をすればよいことから、フロー反応化に好ましい(図2-②)。したがって、バッチ法において報告されているワンポット逐次反応例は、フロー反応に適した合成スキームとなる可能性が高い。また、触媒や添加剤等を固定化できる場合、さらにフロー反応に適している(図2-③)。究極的には超高活性な固体触媒をカラムに詰め、当量反応を無溶媒で検討し、100%の収率・立体選択性、つまり、完全合成を達成できれば、革新的な連続生産ものづくりとなる(図2-④)。以下、連結フロー合成の革新的な例を紹介する。
7工程連結フロー合成の例
まず、図2-②様式の連結フロー合成の例として、2019年に報告されたブロックバスター抗菌薬リネゾリド合成について紹介する2)。「連続フロー」をキーワードとしてSciFinderで検索すると、2018年1月から10月までに、190件の連続フロー合成が報告されており、これらの96%は1段階または2段階であった。一方、溶媒交換や中間体精製を伴わない連結フロー合成は、その当時、4工程で3例3-5)、5工程で1例6)、6工程で1例7)しかなかった。低分子合成医薬品(分子量550以下)において、化学変換の平均回数は8.1であることから8)、より工程数の多いフロー合成の開発が望まれていた。Jamisonらのグループは、単純な原料から7つの化学変換を含む収束型連結フローによって、光学活性なリネゾリドを総滞留時間27分、単離収率73%で得ており、生産性は816 mg/hである(図3)。
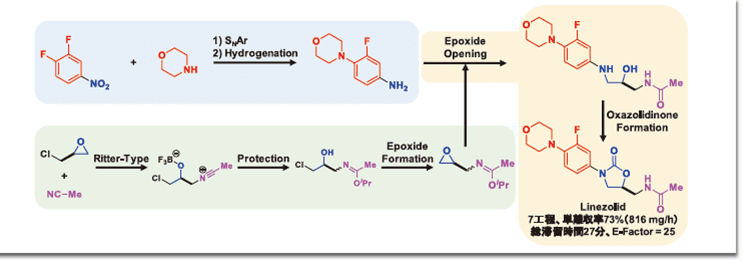
このプロセスにおけるE-factorは25であり(化学変換1回あたりの平均E-factorは3.57)、一般的な医薬品製造プロセスでは、通常、25~100であることから、本プロセスの環境負荷低減に対する優位性は高い。副生成物や共生成物を最小限に抑える試薬や溶媒を適切に選択したフロー合成スキームを入念に計画したことにより、高度な連続生産が可能になった。
なお、本報告は溶媒交換や中間体精製をすることなく、連結フローで行われた当時の最大反応工程数であった。今回、改めて調査したところ、2023年1月にビタミンB1の8工程連結フロー合成が報告されていた9)。しかし、不斉合成の範疇において、Jamisonらの報告は、依然として、おそらく最大反応工程数の座を維持している。
不均一系触媒を用いた連結フロー合成の例
続いて、図2-③様式の連結フロー合成の例として、2015年に小林らのグループによって報告された抗炎症薬でありγ-アミノ酪酸(GABA)誘導体の一つであるロリプラム合成について紹介する(図4)10)。
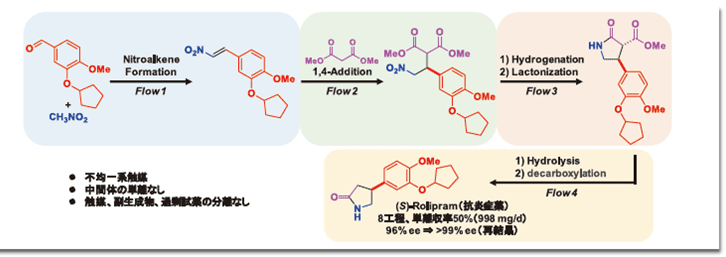
本手法の特徴は、不均一系アキラル、またはキラル触媒を充填した4種類のカラムに、小過剰の試薬を含む反応液を順番に流すだけで光学活性な(S)-ロリプラムを溶媒交換や中間体精製をすることなく不斉合成できる点である。
さらに、キラル触媒をそのエナンチオマーに置き換えたカラムに交換するだけで、(R)-ロリプラムが得られた。また、基質の変更により、GABA誘導体の抗不安作用薬であるフェニブットも合成された。なお、不均一触媒からの金属の溶出が懸念されるが、本システムで得られた生成物には金属は含まれていなかった(パラジウム、<0.01 ppm)。システム自体はラボスケールにもかかわらず、最終的に、(S)-ロリプラムは収率50%、生産性997.8 mg/d、96%ee(エナンチオマー過剰率)で得られた。クロマトグラフィーをすることもなく、粗生成物を直接再結晶すると、化学的にもエナンチオ純度的にも純粋な(S)-ロリプラムが得られた。なお、このシステムは少なくとも1週間は安定に作動しており、使用した不均一系触媒は頑強で、空気中で安定であり、寿命が長いことも確認されている。例えば、キラルカルシウム触媒は、触媒活性とエナンチオ選択性を失うことなく、数ヶ月以上使用することができる。このようなきわめて高度な連結フロー合成システムが、2015年に、しかも、日本から報告されたことは、我が国の技術レベルの高さを証明するものである。
モジュール化によるフロー合成システムの構築
フロー手法の利点の一つに、システムのコンパクト化とモジュール化が挙げられる。そのため、現在では複数の企業からフロー合成システムが販売されている。しかし、複数の反応工程が含まれる連結フロー合成を検討するには、システムの自由度が低い。そのため、ラボ内では入手が容易で安価な部品から、わずか30分でモジュール式フロー装置を組み立てて、実験することが多い11)。また、プラグアンドプレイの連結フロー合成システムも開発されている12)。具体的には、実験者が選択した試薬と反応器・分離器ユニットを制御し、反応を分析・最適化する。このシステムではC-CおよびC-Nクロスカップリング、オレフィン化、還元的アミノ化、芳香族求核置換、光酸化触媒反応、および連結反応の高収率化が達成されており、その有用性が実証されている。
先端技術を利用したkgスケールフロー合成
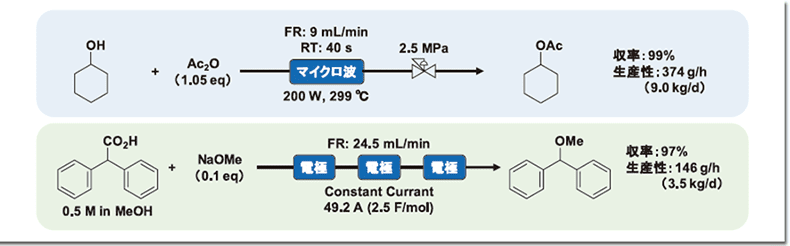
フロー反応の社会実装をさらに推進するために、さらなる反応の高速化や高度化が求められている。外部加熱による伝熱方式だけでなく、急速加熱と物質選択的加熱ができるマイクロ波を活用したフロー法も、この10年にわたり日本で急速に発展した13)。例えば、無水酢酸によるアルコールの無溶媒・無触媒アセチル化において、マイクロ波照射下、40秒の滞留時間で出口温度が299℃まで達し、99%の収率でアセチル化体が得られた。一日当たり9.0 kg(計算値)の生産量を一つのフロー反応装置で達成できる(図5上)14)。また、近年、グリーンケミカルな手法として脚光を浴びている電気化学的フロー法についても、kgスケールが検討されており、回転円筒電極を直列に3つ連結することにより、ジフェニル酢酸のアノード脱炭酸メトキシ化が収率97%、3.5 kg/d(計算値)で連続合成されている(図5下)15)。このような新しい技術がフロー合成にも次々取り入れられており、これらを組み合わせることにより、さらに複雑な物質合成が展開されると考えられる。
以上、フロー合成の実践 ~学術・産業への応用~について概観したが、かなり高度な有機合成もフロー法でできると感じてもらえただろうか?次回、フロー法と親和性の高いAIを活用した、フロー合成の未来 ~DXとの融合~について紹介する。お楽しみに。
参考文献
- Baumann, M. et al. : Beilstein J. Org. Chem., 11, 1194 (2015).
- Russell, M. G. et al. : Angew. Chem. Int. Ed. Engl., 58 (23), 7678 (2019).
- Murray, P. R. D. et al. : Org. Process Res. Dev., 17 (9), 1192 (2013).
- Salvador, C. E. et al. : J. Org. Chem., 80 (9), 4590 (2015).
- Hayashi, Y. et al. : Synthesis, 49 (2), 424 (2016).
- Ghislieri, D. et al. : Angew. Chem. Int. Ed. Engl., 54 (2), 678 (2015).
- Lin, H. et al. : Angew. Chem. Int. Ed. Engl., 56 (30), 8870 (2017).
- Carey, J. S. et al. : Org. Biomol. Chem., 4 (12), 2337 (2006).
- Jiang, M. et al. : Engineering (2023). AOP DOI : 10.1016/j.eng.2023.01.004.
- Tsubogo, T., Kobayashi, S. et al. : Nature, 520 (7547), 329 (2015).
- Britton, J. et al. : Nat. Protoc., 12 (11), 2423 (2017).
- Bedard, A. C. et al. : Science, 361 (6408), 1220 (2018).
- Sajiki, H. : Chem. Rec., 19 (1), 2 (2019).
- Vamosi, P. et al. : Chem. Rec., 19 (1), 77 (2019).
- Petrović, N. et al. : Org. Process Res. Dev., in press (2023).
DOI : 10.1021/acs.oprd.3c00255




