【テクニカルレポート】AI-AAM® を用いた難病でのドラッグリポジショニング
大阪大学 腎臓内科 招へい教員 木村友則 先生に「【テクニカルレポート】AI-AAM®を用いた難病でのドラッグリポジショニング」を執筆いただき、当社ブログsiyaku blogに掲載いたしました。本記事は当社の和光純薬時報 Vol.92 No.2(2024年4月号)にも掲載予定です。
1. はじめに
難病の多くは、患者数が少なく発症機序が不明であるため、新規に薬を開発するのは難しい。病態も複雑であり、一般的な技術のみでは治療薬開発にたどり着かない。一方で、日本に数百万人いるとされる難病患者は治療薬を待っている。そこで、既にある薬を別の疾患の治療薬として転用する、ドラッグリポジショニングという手法が注目されている。難病には特効薬はないものの、標的が既知であり、ある程度効果を持つことが知られている薬は存在する。これらをもとに、標的に対する活性を保ちながら多様な構造の薬を探索することができれば、その中に効果や安全性の面でよりふさわしい薬が見つかる可能性は高いはずである。このような方法を Scaffold hopping と呼ぶ1)。
我々は、Scaffold hoppingの新しい技術であるAI-AAM®に着目して、難病でのドラッグリポジショニングに活用できるか検討したので紹介する(図1)2)。既存の薬の中から、薬理効果の保たれた、多様な構造の薬をスクリーニングすることができた。得られた化合物を解析し、AI-AAM®の特徴を分子生物学、薬理学的観点から分析した。スクリーニングを通じて見えてきた特徴を、AI-AAM®の原理と関連付けて考察する。
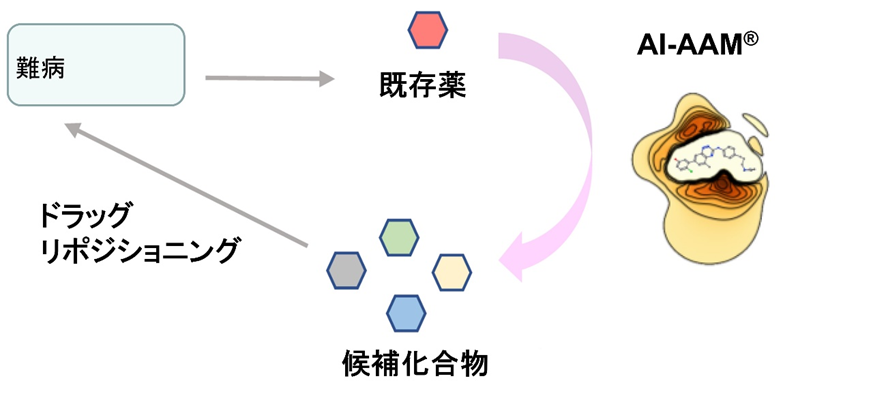
2.AI-AAM® を用いたスクリーニング
コンピューターで医薬品を探索するVirtual screening (VS) は、リガンドベースの VS と構造ベースの VS とに分類される。AI-AAM®は、特定の標的タンパク質を想定することなく、基点化合物とライブラリ中の化合物の類似性を評価してスクリーニングを行うため、リガンドベース VS の方に属している。ただしその類似性とは、構造的特徴というよりも、化合物と、タンパク質を構成する各アミノ酸残基との相互作用のパターンに基づいたものである。詳細については他稿に譲るが、基点化合物とライブラリ中の各化合物について、化合物の周辺のアミノ酸残基の存在確率を表す関数 (AAM記述子) を取得し、基点化合物との各組合せについて、それらの関数のコサイン類似度を AAM 類似度として算出し、その値が 0.7 以上となるようなライブラリ中の化合物をヒットとして同定する。そのためAI-AAM®は、リガンドベース VS で問題となる、取得される化合物の構造上の新規性が乏しいという課題を克服しうる。また、構造ベースVSで必要な、標的の立体構造についての情報は不要である。
我々はAI-AAM®を用いて、薬理活性が既知のライブラリ化合物3)のうち、計算用に適切に処理できた 44,503 件の化合物をスクリーニング対象の化合物ライブラリとして、スクリーニングを行った。それらのうち、中性化合物 808個、1価カチオン 443個については、 DrugBank4) に標的情報があったため、標的の比較解析に使用した。
3.本手法の実験的検証
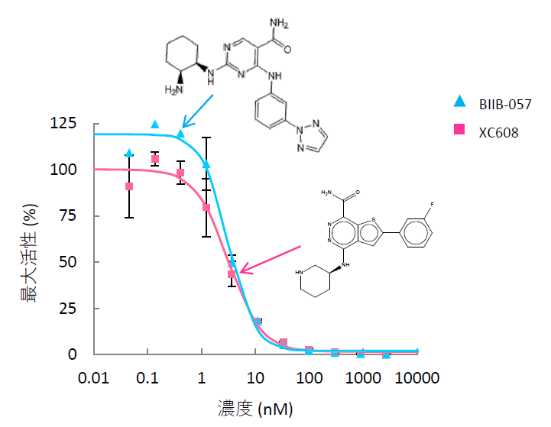
我々はまず、DDrare5)というデータベースに整理された、厚生労働省の指定難病の創薬情報を基に、悪性関節リウマチなど多くの臨床試験中の難病治療薬の標的となっている SYK に着目した。 SYK は非受容体型チロシンキナーゼであり、特に免疫に関連した様々なシグナル伝達に関わる重要なタンパク質として知られている。 このタンパク質の阻害剤として、まだ上市されていないリード化合物である BIIB-057 を基点化合物として選びスクリーニングを行ったところ、18個の化合物が得られた。それらの内、母核の異なる化合物 (XC608) のin vitroでのSYK kinaseに対する阻害アッセイを実施した。その結果、標的とする SYKの半数 (50%) の働きを阻害できる濃度、つまり IC50はBIIB-057 と XC608とで近い値となっており (図2)、 これらの SYK に対する活性は同等であることが示された。 以上の比較解析は、AI-AAM®により Scaffold hopping がうまく行われていることを示している。
4.スクリーニング結果の詳細な解析
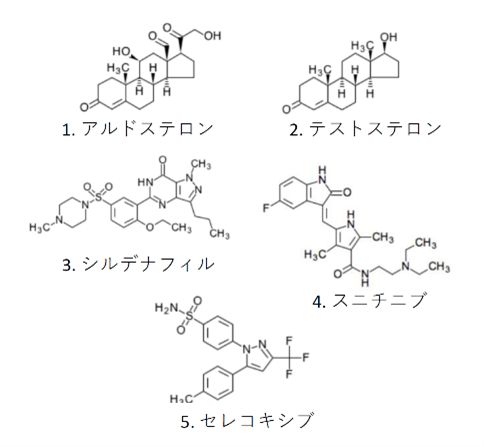
次に、既に難病の治療薬として上市されている5つの薬剤 (図3) を基点化合物として AI-AAM®を適用し、スクリーニングを行った。ライブラリの中で、既知の標的が基点化合物の標的と同じである化合物が網羅的に取得されれば、それはこの手法の一つの検証となるだろう。実際、そのような化合物は高い割合で取得された。フラグメント分子軌道法 (FMO) を用いた計算でも、基点化合物と AI-AAM®によるヒット化合物の標的への結合性は、ほぼ同等であることが示されており、また、VS の効率を示す EF (enrichment factor) の値も、多くの構造ベースVS と同程度かそれ以上であった。いずれの方法も、AI-AAM®は、基点化合物の標的に対する結合性の高い化合物を確かにスクリーニングしている、ということを示している。
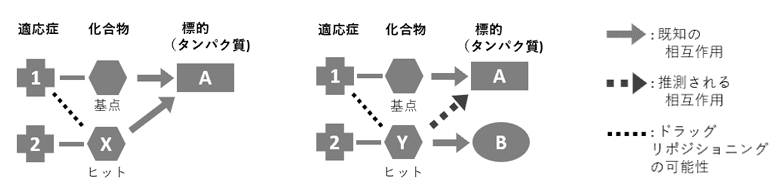
ただし、取得された化合物の中には、既知の標的が基点化合物とは異なるものもそれ以上に多いという傾向が見られた。上述した検証結果を考慮すると、これらの化合物は、基点化合物の標的にも結合していることが示唆される (図4)。それら既知の標的と、推測された標的との組み合わせの傾向は、文献情報とも合致していた6)。また、基点化合物との構造的類似性という観点から調査してみると、類似度の低い化合物が多く取得されていた。この事実は、AI-AAM®によるスクリーニングは、従来の多くのリガンドベースVSとは異なり、基点化合物との構造的特徴の類似性のみに基づくのではなく、化合物周辺の静電場等が大きく関わることの表れと考えられる。これは、ヒットした化合物の既知の標的が多様であることにも表れていると考えられた。過去30年ほど、治療薬と標的とは、1対1の対応関係にあることが理想的であるとされ、標的に対して特異性の高い化合物が探索される傾向があった。 しかし最近、薬剤の効果も副作用も標的が複数あるために生じていることが多いことが示され、"Polypharmacology" と呼ばれる新しい概念が生み出されている7)。上記の化合物は、基点化合物の標的だけでなく、それとは異なる既知の標的を介して、基点化合物とは異なる強さ(あるいは種類)の薬理作用、副作用を、基点化合物の適応症に対してもたらす可能性がある。つまり、このような化合物が多く取得されたということは、 Scaffold hopping がうまく行われていることの表れとみなすことができる。そのため、その中から基点化合物の適応症へのドラッグリポジショニングにふさわしい薬が見つかる可能性が高い。逆に、これらの化合物の現在の適応症への効果の方に視点を移すと、これまで知られていなかったものの、実際にはこれらの化合物は、基点化合物と同じ標的にも結合することで薬理作用、副作用を生じていたのではないかといったメカニズムの推測、さらにはそれらの解明につながることも考えられた。
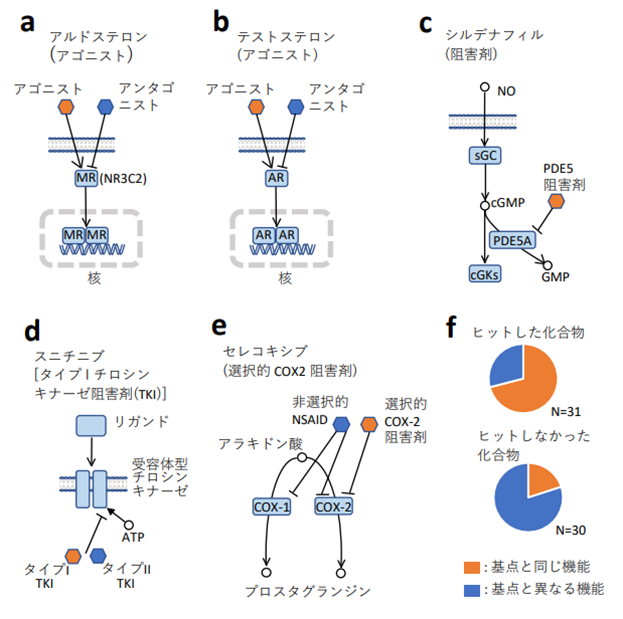
上述したように、AI-AAM®を使ったスクリーニングにより、基点化合物と同じタンパク質を標的とすることが知られている化合物を比較的高い率で取得できたが、取得できなかったものもあった。これについては、同じタンパク質に結合する薬剤でも、アゴニストとアンタゴニスト、選択的阻害剤と非選択的阻害剤のように、薬理作用は異なる場合があったため、おそらく薬理作用が関係しているのではないかと推測した (図5)。この観点から、ヒット化合物、ヒットしなかった化合物(既知の標的は基点化合物と同じ)をまとめて分類したところ、ヒット したものの中には、基点化合物と機能の同じものが多く、ヒットしなかったものの方は、機能の異なるものが大半を占めている、という結果になった。つまり、AI-AAM®を用いたスクリーニングは、機能に対する選択性が高いということができ、AI-AAM®は相互作用の本質的な性質に着目することにより、相互作用を正確に記述していることが示唆される。テストステロン、セレコキシブを基点とした場合は単独でも統計的に有意であった。androgen receptor (AR) のアゴニストとアンタゴニストの違い、COX-2の阻害剤の 選択的/非選択的 の違いは、 それぞれ、標的タンパク質の中の数個のアミノ酸残基との相互作用の有無により生じることが報告されている8)-10)。 従って、化合物周辺の特定の位置におけるアミノ酸の存在確率が AAM 記述子に確かに反映され、化合物の機能の識別につながっている可能性が考えられた。
5.結語
AI-AAM®は Scaffold hoppingの成功例であると考えられた。この手法により得られた化合物は、基点化合物の代替物として妥当であり、難病治療へのドラッグリポジショニング候補となるものである。また、本研究の副産物として、化合物と標的タンパク質の新たな相互作用の可能性が多数示されたが、これは、未だ網羅的に調査されているとはいえない化合物の Multi-target情報の蓄積に貢献し、さらに今後、薬剤の作用、副作用の機序の解明につながっていくことが期待される。実際、既に承認されているが作用機序が不明であった薬剤について、本研究で推測された標的を介して作用しているのではないかと考えられる事例が少なからずある。本手法で得られた結果を基に実験系での検証が進み、実際の臨床で実証され、難病患者に薬を届ける契機になれば幸いである。
参考文献
- Schneider, G. et al. : Angew. Chem. Int. Ed. Engl. 38, 2894 (1999)
- Tanabe, M. et al. : Sci Rep., 13, 19358 (2023).
- Namiki Shoji Co., Ltd. : https://www.namiki-s.co.jp/
- DrugBank : https://go.drugbank.com/
- Sakate R, and Kimura T. Drug Discov Today 27: 1789-1795, 2022.
- Paolini, G. V., et al. : Nat. Biotechnol., 24, 805 (2006).
- Hu, Y. and Bajorath, J. : Drug Discov. Today. 18, 644 (2013).
- Singam, E. R. A. et al. : J. Phys. Chem. B., 123, 7657 (2019).
- Rao, P. N. P. and Knaus, E. E. : J. Pharm. Pharm. Sci., 11, 81s (2008).
- Zarghi, A. and Arfaei, S. : Iran J. Pharm. Res., 10, 655 (2011).
- 富士フイルム和光純薬ウェブセミナーで木村先生にご講演いただきました。
【期間限定配信】第49回WAKO Web受託セミナー
「新しいScaffold Hoppingをアミノ酸マッピングAAMで導くー天然化合物の骨格改変と難病におけるドラッグリポジショニングへの適用ー」視聴申込はこちら 
- AI-AAM®を用いた骨格改変drug2drugsのサービスページはこちら





