【テクニカルレポート】間葉系幹細胞由来エクソソーム産生用無血清培地の開発 エクソソームを利用した再生医療の実現に向けて
本記事は、和光純薬時報 Vol.89 No.4(2021年10月号)において、富士フイルム和光純薬 ライフサイエンス研究所 丸谷 祐樹、山根 昌之が執筆したものです。
はじめに
細胞外小胞 (Extracellular vesicle : EV) は、細胞より放出される脂質二重膜の小胞体で細胞間のコミュニケーションツールとしての機能を持つ。EVの一種として分類されるエクソソームは、種々の生体機能の制御に関わると考えられており、疾患バイオマーカーや治療用製剤への利用が期待されている。治療用製剤への利用においては抗炎症や抗線維化といった効果を有する間葉系幹細胞 (Mesenchymal stem cell : MSC) 由来のエクソソームが最も注目されており、近い将来の実用化への期待は大きい。このように、MSC由来エクソソーム実用化の期待が高まる中、治療用製剤としてのエクソソームを製造する技術開発が盛んに行われてきている。
本稿では、我々が独自に開発したMSC由来エクソソーム産生用無血清培地を治療用エクソソームの産生に用いる有用性について紹介する。
MSC由来エクソソーム
エクソソームは、CD9、CD63、CD81などをマーカータンパク質とする、細胞から分泌される直径30-100nm程度の脂質二重膜の膜小胞であり、タンパク質や核酸(DNA、mRNA、miRNA)、脂質などの細胞由来成分を含有している1, 2)。一方、MSCは、骨髄や脂肪、臍帯といった組織から樹立できる中胚葉由来の体性幹細胞であり、脂肪、骨、軟骨への分化能を有する。さらに、MSCはこのような分化能に加えて、抗炎症、抗線維化、あるいは免疫抑制を誘導する分泌物効果を発揮するが、近年これらの効果がエクソソームによるものであることが示唆されている3)。このような背景の下、MSC由来エクソソームを利用した治療用製剤の注目度が急激に高まりつつある。
MSC由来エクソソーム産生用無血清培地の開発
MSC由来エクソソームの産生に使用する培地としては、ウシ由来エクソソームを除去したウシ胎児血清 (EVdepleted FBS) を添加した基礎培地をはじめいくつかの培地が使用されている4, 5)。しかし、これらはいずれもMSCの生存維持を目的とした組成であり、エクソソーム分泌や生物活性効果に最適化されたものは開発されていない。
そこで我々は、MSCがエクソソーム産生を行うために適した環境を提供できる無血清かつアニマルフリーの培地で、高性能と高生物活性を両立させたEV-Up™基礎培地とサプリメント(以下、EV-Up™培地と表記)を開発した。
EV-Up™培地を用いた培養により得たエクソソームの産生量と活性について
EV-Up™培地は、任意の増殖用培地で80-90%コンフルエントまで培養した後に培地交換して3-5日間培養を行うという使用法を推奨している (図 1)。通常、血清培地から無血清培地に切り替える場合は馴化作業を必要とする場合が多いが、EV-Up™培地はFBSを含む血清培地で増殖させた細胞であっても直接交換できるという点を特長のひとつとしている。

図1. EV-Up™ 培地の推奨プロトコル
EV-Up™ 培地の推奨プロトコルは、任意の増殖培地を用いて80-90% コンフルエントまで培養した後、EV-Up™ 培地に交換する。その後3-5 日間培養を行い、培養上清を回収する。回収した培養上清からはPS アフィニティー法によりエクソソームを回収することが可能である。骨髄由来MSCを血清培地で増殖させた後にEV-depleted FBSを含む基礎培地、もしくはEV-Up™培地に切り替えて5日間培養した後の細胞数と細胞生存率を測定したところ、細胞数と生存率が高い状態で維持されていることが確認された (図2 A, B)。
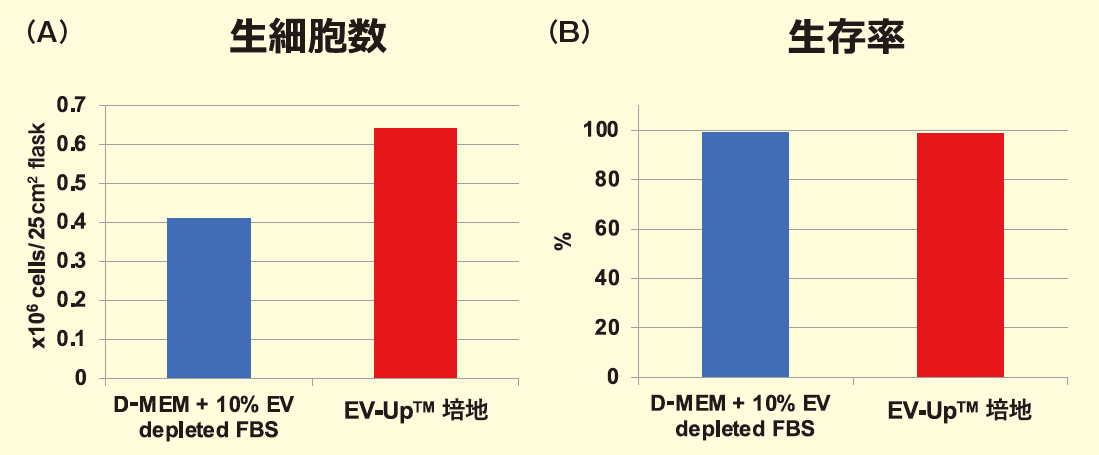
図2. EV-Up™ 培地を用いて培養したMSC の細胞生存率
EV-Up™ 培地に培地交換して5 日後の細胞数 (A) と細胞生存率 (B) を測定した結果。次に、PSアフィニティー法にて精製したエクソソームの粒子数をナノ粒子トラッキング解析法 (NTA) で比較した6)。その結果、EV-Up™培地を用いて得たエクソソームは、EV-depleted FBSを添加した基礎培地に比べ、粒子数が約2.6倍に増加することが確認された(図3A)。さらに、PSアフィニティー法を応用したエクソソーム定量技術であるPS ELISA法によりエクソソーム量の比較を行ったところ、NTAと同様にエクソソームマーカータンパク質であるCD9、CD63及びCD81の増加も確認された6, 7)(図3B)。
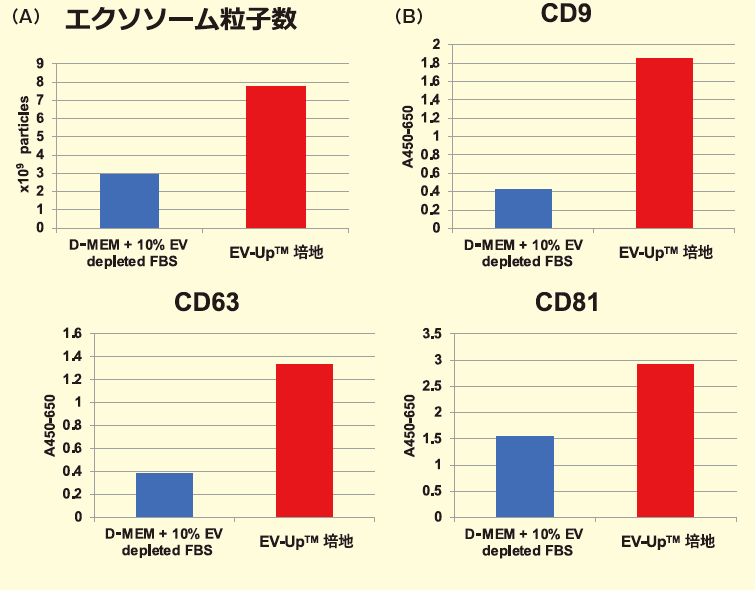
図3.EV-Up™ 培地を用いた培養後のエクソソーム粒子数比較及びエクソソームマーカー比較
各培地で得た培養上清1mL から取得されたエクソソームのNTA による粒子数比較 (A) とPS ELISA によるエクソソームマーカー解析結果 (B)。最後に、各培地で培養したMSC由来エクソソームの生物活性を比較するために、ヒト胎児肺由来正常線維芽細胞(TIG3)における線維化抑制効果について評価した。その結果、一般的に用いられている基礎培地にEVdepleted FBSを添加した培地に比べ、EV-Up™培地で培養したMSC由来のエクソソームの方が極めて高い抗線維化効果を有することが明らかになった(図4)。
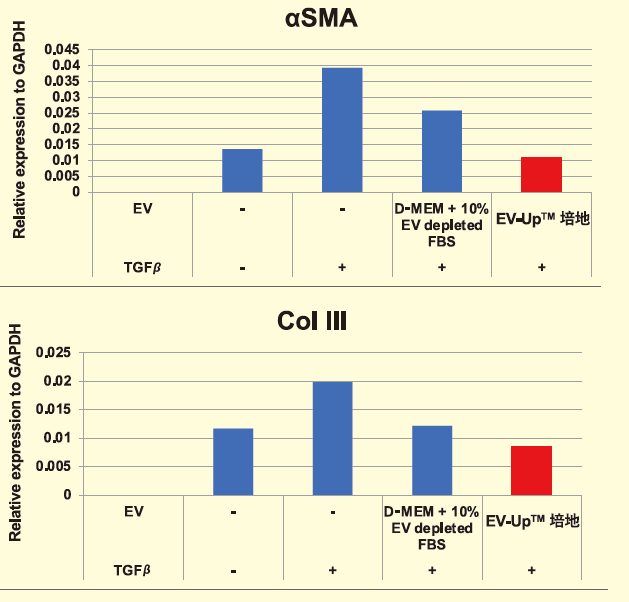
図4.EV-Up™ 培地を用いた培養後のエクソソーム生物活性比較(抗線維化活性)
PS アフィニティー精製したエクソソーム5 x 108particles/mL を、TGFβで刺激したヒト胎児肺由来線維芽細胞 (TIG3 細胞) に添加し、Real-Time PCR 法を用いた線維化マーカー (αSMA, Collagen Ⅲ) 遺伝子発現定量により、抗線維化活性を比較した。以上の結果より、EV-Up™培地は高い生物活性を保持したMSC由来エクソソームを高収量で調製可能な革新的な培地であることが明らかとなった。
おわりに
今回我々は、MSCに最適化した無血清かつアニマルフリーのエクソソーム産生用培地であるEV-Up™培地を開発した。本培地は高活性なエクソソームの産生量向上のみならず、無血清かつアニマルフリーという特長から、治療用製剤プロセスにおける品質の安定性向上においても寄与できる可能性が示唆される。今後エクソソームを利用した治療用製剤の実用化が世界中で進められていく中、我々が開発した培地は有用な製造技術のひとつとして広く活用されることが期待される。
参考文献
- Colombo, M. et al. : Annu. Rev. Cell Dev. Biol., 30, 255 (2014). DOI: 10.1146/annurev-cellbio-101512-122326
- Mathieu, M. et al. : Nat. Cell Biol., 21 (1), 9 (2019). DOI: 10.1038/s41556-018-0250-9
- Phinney, D. G. and Pittenger, M. F. : Stem Cells, 35 (4), 851 (2017). DOI: 10.1002/stem.2575
- Rajendran, R. L. et al. : Sci. Rep., 7 (1), 15560 (2017). DOI: 10.1038/s41598-017-15505-3
- Lai, R. C. et al. : Stem Cell Res., 4 (3), 214 (2010). DOI: 10.1016/j.scr.2009.12.003
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016). DOI: 10.1038/srep33935
- Ma, Y. et al. : Sci. Rep., 11 (1), 13471 (2021). DOI: 10.1038/s41598-021-92860-2















