NBSでのブロモ化に、酢酸アンモニウムをひとつまみ
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。
概要
芳香環のブロモ化といえば、構造活性相関の取得はもちろんの事、カップリング反応の足場としても活躍する頻出反応の一つです。さまざまなブロモ化試薬が市販されていますが、第一選択としては N-ブロモスクシンイミド (NBS) を用いる方も多いのではないでしょうか。
しかし安価なブロモ化試薬はその反応性の高さゆえ、位置選択性に悩まされることが多かったり、多置換反応が起きたり、予期せぬ酸化反応が進行したりするなど、困りごとも多く発生します。そんな時、(置換基によりますが) 安価で便利な "塩" (触媒) があります!
NBSを用いたブロモ化触媒としての酢酸アンモニウム
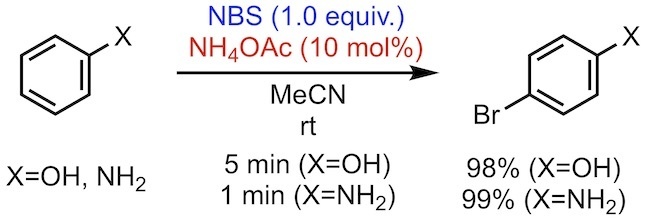
2007年、"A facile nuclear bromination of phenols and anilines using NBS in the presence of ammonium acetate as a catalyst" と題した論文1)が Journal of Molecular Catalysis A: Chemical 誌に掲載されました。酢酸アンモニウムを触媒とした、フェノールとアニリンの臭素化反応に関する論文です。以下のような反応式です (図1)。
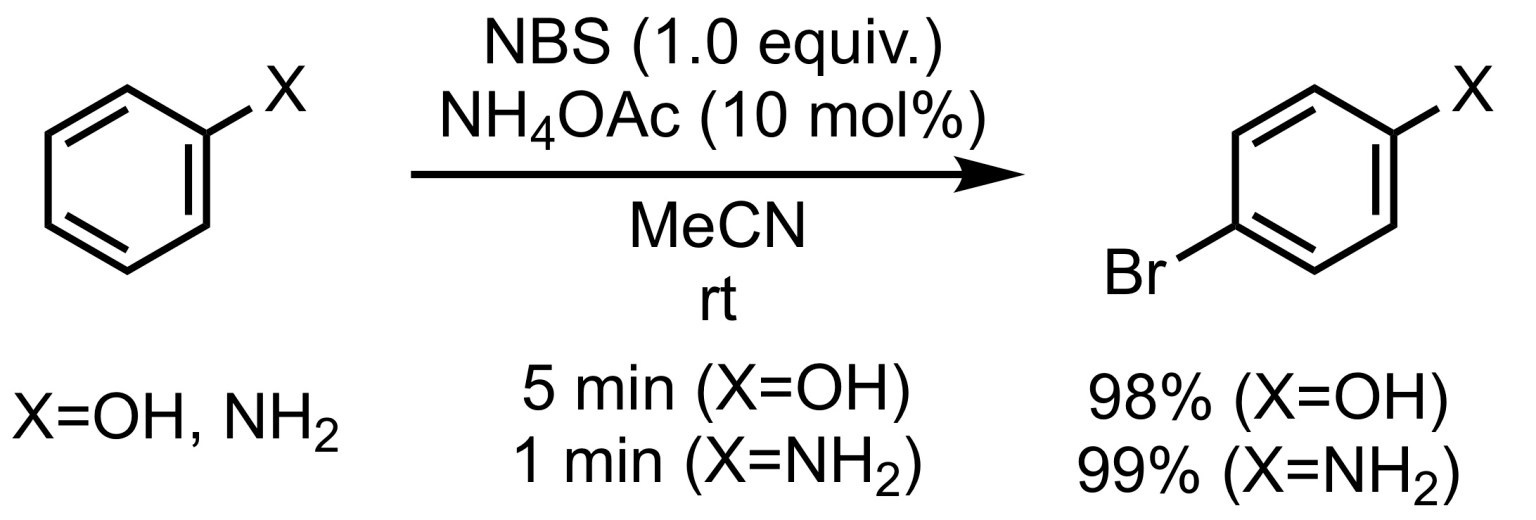
図1 NBS と酢酸アンモニウムを用いた芳香族ブロモ化反応
要はヒドロキシ基やアミノ基のような電子供与性基のパラ位 (パラ位が塞がれている場合はオルト位) のブロモ化反応です。それだけでは何て事ありませんが、位置選択性が高く、数分程度の短時間で完結し、しかも高収率であるというのが本反応の特筆すべき点です。
10 mol%の酢酸アンモニウムを基質と混ぜ、室温、アセトニトリル中で撹拌しながら1当量の NBS を加えるだけで、高収率で位置選択的なブロモ化が進行します。基質がアセトニトリルに溶解しなくても懸濁状態でしっかり撹拌すれば問題なく反応するようです。なお、NBS の添加は最後に行わないと副反応が進行する可能性があります。後処理は一般的な分液と必要に応じたカラム精製でOKです。また、生成物がアセトニトリルに溶解しなければ、吸引濾取しアセトニトリルで洗浄すれば完了です。酢酸アンモニウムはとても安価な試薬です。それを触媒量添加するだけなのでとてもコストパフォーマンスの良い反応です。以下に、論文から引用した実施例を抜粋します。
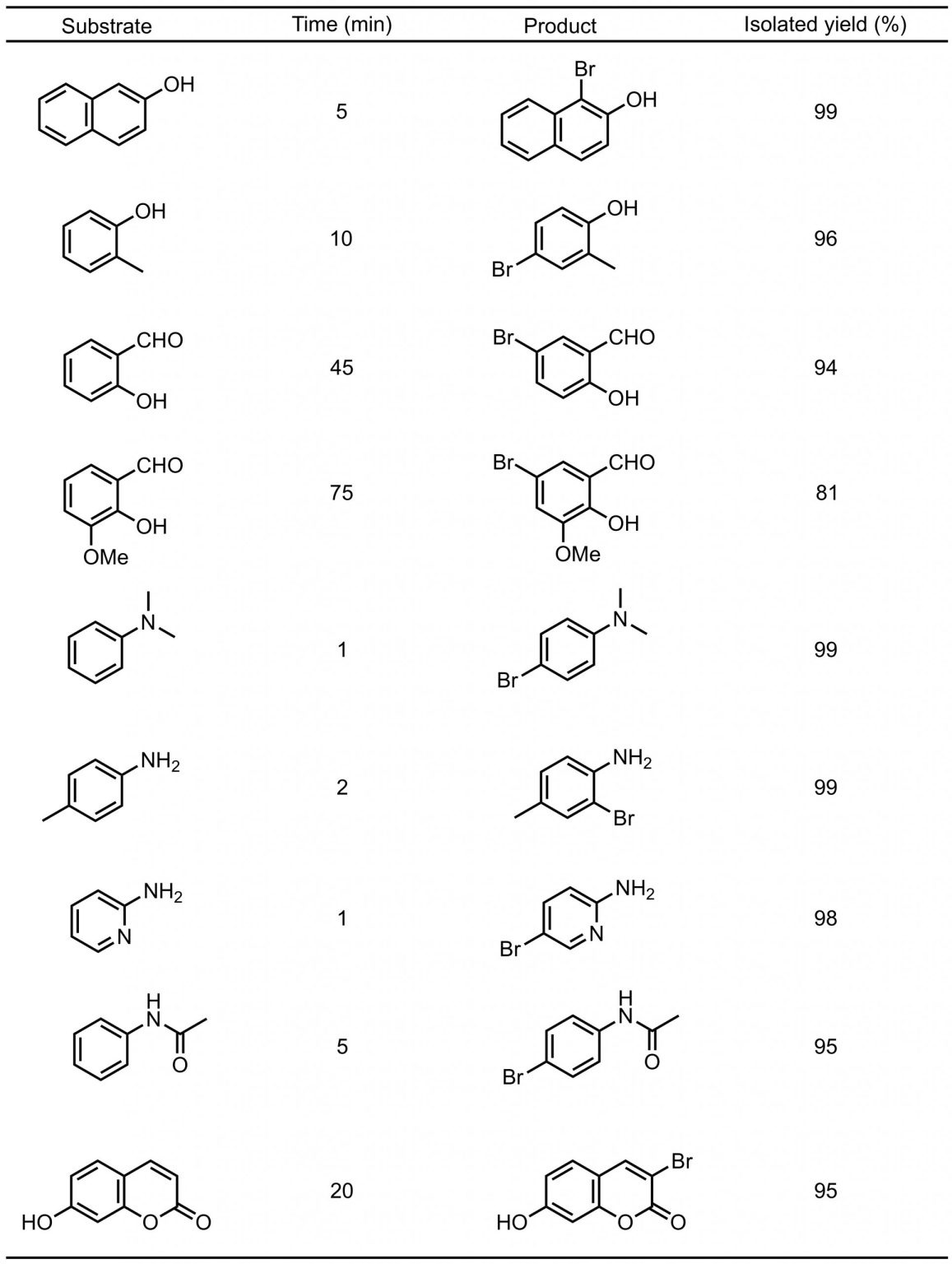
図2 NBS と酢酸アンモニウムによる芳香族ブロモ化の反応例
文献1)より抜粋して引用足掛かりとなる置換基が多数存在する場合、基本的にはハメット則に従い、強い電子供与性基の方が優先されるようです (-NH2 > -OH > -OMe > -NHAc)。
反応機構
この論文1)よりも前に、NBS と酢酸アンモニウムを用いたカルボニルα位のブロモ化反応が報告されています2)。提唱されたメカニズムはこちらです。
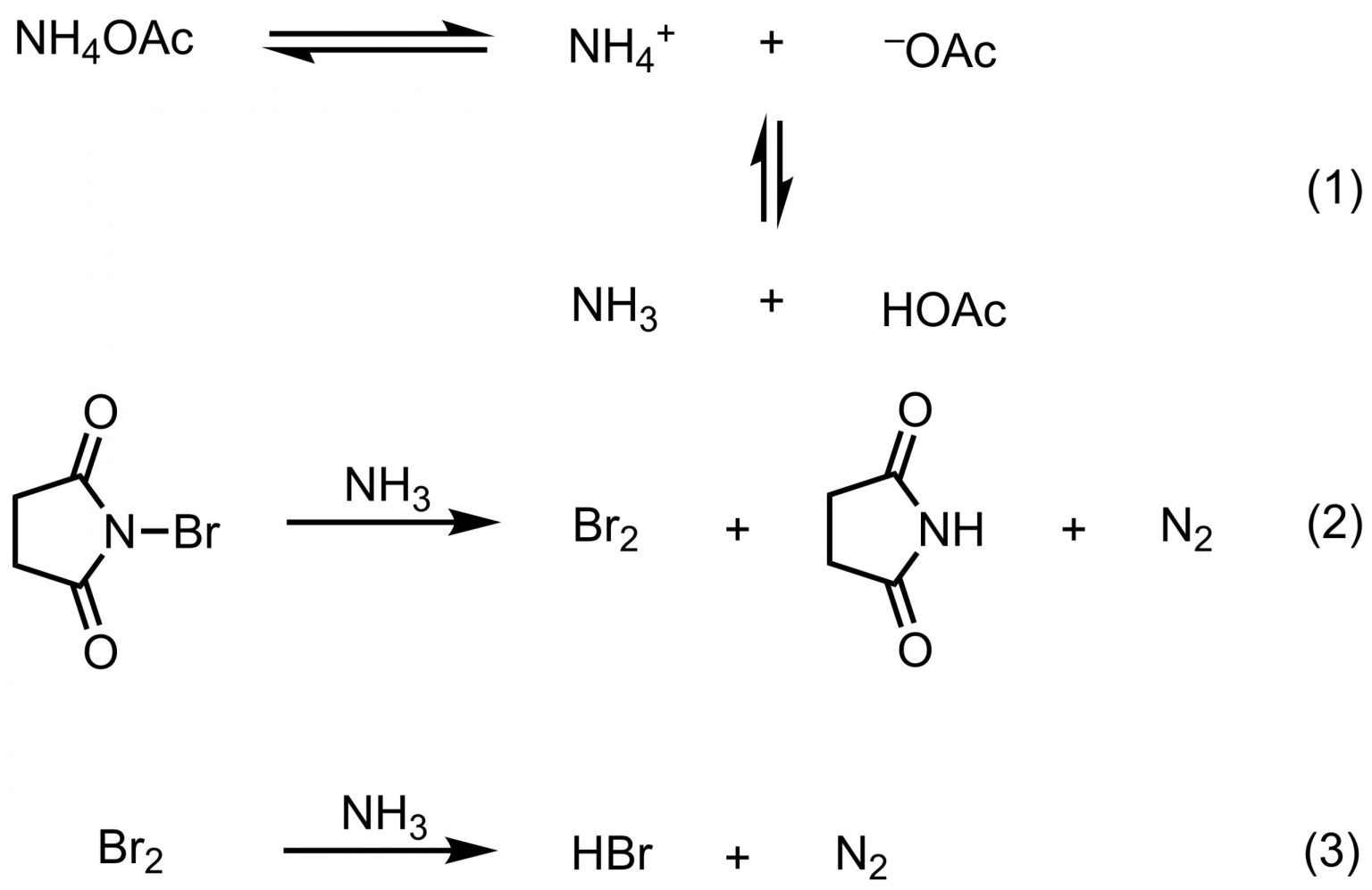
図3 NBS と酢酸アンモニウムの反応メカニズム2)
この式によると、まず (1) で酢酸アンモニウムが電離し、プロトン移動によりアンモニアが系中で生じます。そのアンモニアが NBS を還元し、臭素、スクシンイミド、窒素を生成します。さらに臭素がアンモニアと反応して臭化水素となります。ここで生じた臭素と臭化水素がブロモ化剤として作用します。論文1)の著者らもこの反応メカニズムを支持しています。ただし、この反応式だと量論量の酢酸アンモニウムが必要な気がしますので、触媒量でも高収率で反応は成功するという事実にはやや謎が残ります。
ケムステスタッフの Macy 氏による追記
この部分ですが、触媒量の強酸であるHBrが発生しているので、NBSのスクシンイミドのカルボニル基を活性化してBrの求電子性を上げていることが鍵だと思います。よくチオグリコシドの活性化にNISと触媒量のTfOHを入れますが、同じ機構です。
強酸の添加ではなく、中性の塩を入れるだけで同じような効果が得られるという素晴らしい反応だと思います。
他のハロゲン化剤ではどうなのか?
NBSと同じ条件で N-クロロスクシンイミド (NCS) を用いアニリン誘導体を処理したところ、位置選択的なクロロ化体は一応得られたものの、収率は30%程度かつ副生成物の残渣が大量に出てきて精製が困難でした。NCS は反応性が低いため酢酸アンモニウムではうまくいかず、代わりに触媒量の塩化鉄(III) が必要になるとのことです3)。
また、アセトニトリル中で NIS と酢酸アンモニウムを混合すると、爆発の危険性があるため避けるべきだということです2)。
実験例4)
4-ニトロ-1-ナフチルアミン (3.00 g, 15.9 mmol) をアセトニトリル (50 mL) に溶解 (一部懸濁) し、酢酸アンモニウム (133 mg, 10 mol%) およびN-ブロモスクシンイミド (2.98 g, 16.7 mmol, 1.05 equiv.) を加え室温で10分撹拌した。反応液を減圧下で濃縮し、水を加え酢酸エチルで2回抽出した。有機層を合わせて飽和食塩水で2回洗浄し、無水硫酸ナトリウムで乾燥後、溶媒を減圧留去して黄色固体 4.02 g (収率90%) を得た。
参考文献
- Das, B.,Venkateswarlu, K., Majhi, A., Siddaiah, V., Reddy, K. R.: J. Mol. Catal. A: Chem., 267, 30 (2007). DOI: 10.1016/j.molcata.2006.11.002
- Tanemura, K., Suzuki, T., Nishida, Y., Satsumabayashi, K., Horaguchi, T.: Chem. Commun., 470 (2004). DOI: 10.1039/b315340a
- 種村潔、有機化合物のハロゲン化反応の開発、日本歯科大学紀要,48, 1 (2019). DOI; 10.14983/00000852/
- Yasuda, D., Nakajima, M., Yuasa, A., Obata, R., Takahashi, K., Ohe, T., Ichimura, Y., Komatsu, M., Yamamoto, M., Imamura, R., Kojima, H., Okabe, T., Nagano, T., Mashino, T.: Bioorganic Med. Chem. Lett., 26, 5956 (2016). DOI: 10.1016/j.bmcl.2016.10.083




