【総説】PTS溶液の開発とEVへの応用
本記事は、和光純薬時報 Vol.89 No.3(2021年7月号)において、熊本大学大学院 生命科学研究部 薬学系 微生物薬学分野 増田 豪様に執筆いただいたものです。
PTS法の開発
タンパク質はその発現量や翻訳後修飾、相互作用の相手や局在を変えることで多様な生命現象を生み出している。生命現象において中心的役割を担う重要なタンパク質について、その発現プロファイルを得るプロテオミクスは近年の生命科学研究では欠かすことができない技術および研究分野である。プロテオミクスでタンパク質の発現プロファイルを得るには、試料からタンパク質を抽出後に、それらを消化酵素で断片化する必要がある。その後、液体クロマトグラフィータンデム質量分析計(liquid chromatography-tandem mass spectrometry, LC-MS/MS)で分析することでペプチドの構造情報を取得し定性および定量を行う。
近年はLCにおける分析カラムの微小化や充填剤の改良、MSの高感度化、高解像度化およびスキャンスピードの高速化などLC-MS/MSにおける技術的進展が著しい。また、安定同位体標識試薬を用いた複数試料の同時分析やdata independent acquisitionなど、これまでLC-MS/MSが不得意としてきた複雑性が高い試料中の低発現タンパク質の定性・定量ができるようになってきた。
一方で、タンパク質はDNAやRNAのように増幅させることができないため、試料から得られたタンパク質やペプチドが前処理工程で損失してしまうと、例え最新の分析機器を用いても検出することはできない。また同様に試料から抽出できなければ、そして消化酵素で断片化できなければ、それらは試料中に存在していたとしてもLC-MS/MSで検出されないため発現していないものとして取り扱われてしまう。つまり、プロテオミクスにとって、試料からのタンパク質抽出工程および消化工程は分析機器と同じくらい重要であることを示している。
Swiss-Protデータベースには20,395種類のヒトタンパク質が登録されている(2021年4月現在)。それらヒトタンパク質はそれぞれ、アミノ酸配列や翻訳後修飾に特徴を持つ。真のプロテオミクスを行うには、様々な生化学的な特徴を持つタンパク質を全て一様に可溶化する必要がある。特に膜貫通ドメインをもつタンパク質は疎水性が高く可溶化が難しいタンパク質である。これら膜タンパク質を含めすべてのタンパク質を抽出するには、可溶化能の高い界面活性剤などを用いる必要がある。
一方で強力な可溶化剤の多くは、その後の前処理で用いる消化酵素の活性を阻害してしまう。さらに、可溶化剤によってはLCにおけるペプチドの分離やMSにおけるイオンの検出に悪影響を与えてしまう。つまり、プロテオミクスの前処理では、タンパク質を偏りなく可溶化しつつも、消化酵素の活性を阻害せず、なおかつ除去が容易な可溶化剤を用いる必要がある。
これまで膜タンパク質のような難溶性のタンパク質に対して可溶化と消化を改善するプロトコルは数多く報告されている。可溶化剤として、有機溶媒、界面活性剤、カオトロピック試薬を用いた方法や、消化法として酵素を用いず化学反応で切断する方法、非選択的プロテアーゼを用いる方法などが報告されてきた。ドデシル硫酸ナトリウム(Sodium dodecyl sulfate, SDS) などのイオン性界面活性剤は、疎水性タンパク質を可溶化する強力なツールであるが消化酵素を不活性化させるため、限外ろ過膜やメタノール・クロロフォルム沈殿を用いてバッファー交換する方法が報告されている。様々な方法が報告されているが一長一短であった。
我々は可溶化能が高く、消化酵素の活性を阻害しない可溶化剤を探索するために、まずはスクリーニングを行った。可溶化能は大腸菌の膜画分を用い、可溶化されたタンパク質の量から評価した。各溶液中の消化酵素活性は、基質として消化分解後に呈色する化合物を用いて評価した。
可溶化剤として、計27種類の有機溶媒、イオン性界面活性剤、非イオン性界面活性剤およびカオトロピック試薬を評価に用いた。スクリーニングの結果、胆汁酸の一つであるデオキシコール酸ナトリウム(Sodium deoxycholate, SDC)がスクリーニングで選抜された。SDCはSDSに次いで可溶化能が高かった。また、1% (w/v) SDC存在下でも消化酵素の活性は阻害されず、逆に活性を促進した。
SDCはプロテオミクスにおけるタンパク質の抽出と消化工程にとって非常に理想的な可溶化剤だったものの、SDCは陰イオン性の界面活性剤であり、高濃度で用いるとLC-MS/MSに悪影響を与えてしまうため、消化後に試料溶液から除去する必要がある。そこで我々は酸性条件下でデオキシコール酸が水に不溶になることを利用して、液液分配で除去する方法を考案した。SDCを含む消化後の試料に酢酸エチルを添加し、トリフルオロ酢酸で酸性にする。その後、激しく攪拌することで、水に不溶化したデオキシコール酸が酢酸エチルに分配する(図1)。
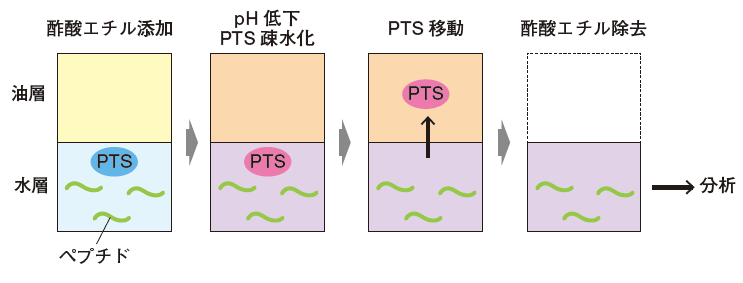
図1.
ペプチドは水に溶けるため、デオキシコール酸と分離できる。このような可溶化剤を相間移動溶解剤(Phase transfer surfactant, PTS)とし、この前処理方法をPTS法と名付けた1)。PTSになる可溶化剤はSDC以外にもあり、SDCとラウロイルサルコシン酸ナトリウム(Sodium lauroylsarcosinate, SLS)を混合することで、さらにタンパク質の同定数が増加することを我々は見出している2)。
PTS法を用いると、疎水性の高い膜タンパク質でも可溶性タンパク質と同等に定量的に抽出および消化できることが示された。PTS法はこれまで、膜タンパク質であるトランスポーターの絶対定量などにも用いられるなど疎水性タンパク質の前処理において多くの実績が報告されている。また、PTSは細胞分画にも用いられている3)。得られた画分をバッファー交換操作する必要がないため回収率が高く、微量細胞から得られた画分を用いて細胞内局在解析が可能となった。
PTS法のEVへの展開
がん細胞、内皮細胞やその他の様々な細胞間のコミュニケーションはかつて、サイトカインやケモカインなどの可溶性因子や細胞間の直接的な接触が仲介していたと考えられてきた。一方で近年、それら細胞間コミュニケーションには細胞外小胞(Extracellular vesicles, EV)によっても媒介されていることが明らかになってきた4)。EVは、そのサイズや形成過程によって複数種類に分類されるが、いずれも細胞内から放出される膜構造体であり、細胞が持つDNA、RNA、タンパク質や脂質などの様々な生体分子が含まれている。
分取されたEVを用いて、EVが仲介する生命現象が検証されてきた。各種免疫細胞やがん細胞が放出するEVにより、免疫調節やエピジェネティック調節など周辺細胞の表現型を変化させることが報告されている。また、EV中に含まれる特定のRNA量を調べることで疾患を診断できることも報告されている。EVが関与する生命現象は幅広く、それらを解析するためにEVに内包される生体成分を明らかにすることは非常に重要である。特にEV中のタンパク質を観察する意義は高い。細胞中のタンパク質の発現量はmRNAの発現量からある程度推測できるものの、EV中には遺伝子翻訳機構が備わっていないためタンパク質自体を観察する必要がある。
EVの機能を明らかにするために、EVを分取および濃縮する方法がいくつか報告されてきた4)。伝統的な方法として超遠心分離を用いる方法がある。細胞や死細胞などを除いた培養上清を100,000 x gで処理し、沈殿物がEV画分として利用されている5)。また、スクロース密度勾配を組合わせた超遠心で分取する方法も知られている。EVのサイズを利用して、ゲルろ過クロマトグラフィーを用いて分取することも可能である。
また、EVはCD9、CD63、CD81やTSG101などを表面に提示していることが知られており、これらを標的とした抗体でプルダウンすることで分取する方法も知られている。抗体を用いることで、選択性および純度高くEVを精製することが可能となった。一方で、抗体と抗原の親和性が高いため、比較的強力な可溶化剤を用いる必要があり、溶出時にEVを壊してしまう可能性がある。また、同じ細胞から分泌されるEVでも構成される異なる膜タンパク質を提示していることが知られており、単一の抗原を認識する抗体で濃縮してしまうと分取できないEVも出てくる。
一方で、EVの二重膜を構成するリン脂質としてホスファチジルセリンが外側に露出しており、これを利用してホスファチジルセリンと高い親和性を示すTim4タンパク質でEVをプルダウンする方法が報告されている6)。この方法は、EVを簡便かつ高純度に濃縮できる点や、EVの不均一性に左右されにくい点、ホスファチジルセリンとTim4との結合をキレート剤で解離することでEVを穏やかに回収できることから、他のEV濃縮方法に比べて利点が多い。
我々は、EVに内包されるタンパク質を網羅的に解析するために、PTS法を適用した。EVはHeLa細胞の培養上清を用い、EVの濃縮にはMagCapture™ エクソソームアイソレーションキット PS(富士フイルム和光純薬株式会社)を用いた。
まずはキット添付のElution bufferもしくはPTS溶液を用いてEVの回収もしくはEVタンパク質を可溶化した。Elution bufferで回収したEVはPTS溶液で可溶化した。タンパク質の 量をBCA assayで定量したところ、Elution bufferで回収されたタンパク質量に比べてPTS溶液で直接可溶化することでタンパク質の回収量は2.85倍に増加した。回収したEVタンパク質とビーズに残存したCD63の量から、Elution bufferおよびPTS溶液ではそれぞれ37.7および9.0%のEVが回収できずにビーズに残存していたことが示唆された。
PTS溶液を用いることで、プルダウンしたEVをキット添付のElution bufferよりも多く回収できることが示された。また、PTS溶液はTim4とストレプトアビジンの相互作用を解離しなかったことから、Tim4が試料溶液に混入してLC-MS/MSにおけるEVタンパク質の検出を阻害することはない。
次に得られたタンパク質を処理しLC-MS/MSで分析を行ったところ、317種類の膜貫通タンパク質を含む計1,766種類のタンパク質が定量された。PTS溶液で回収することで、Elution bufferで回収するよりも平均で3.24倍にタンパク質の定量値は増加した。Tim4非添加群と比較して、有意に2倍以上濃縮されたタンパク質をGO解析(Cellular component)したところ、Extracellular exosomeがもっとも有意に濃縮されていた。
さらに、ビオチン化Tim4を捕捉するAvidinビーズとして、製品キット添付のStreptavidinビーズではなくMagCapture™ Exosome Isolation Kit PS Ver.2(富士フイルム和光純薬株式会社)のBiotin Capture Magnet Beadsを用いた。両ビーズでEVを回収したところ、EVタンパク質はStreptavidinとVer.2ビーズでそれぞれ1,280および1,449種類同定された。両群で1,236種類のタンパク質が共通に定量され、44種類のタンパク質がStreptavidinでのみ定量されたのに対して、213種類のタンパク質がVer.2ビーズでのみ定量された。タンパク質の定量値をボルケーノプロットで比較したところ全体的にVer.2ビーズ群で高かった(図2A)。
このことから、期待していた通りVer.2ビーズではStreptavidinビーズに比べて捕捉量は増加していた。また、同様にコントロールであるTim4非添加群でも比較したところ、Ver.2 ビーズ群でタンパク質の定量値が低下した( 図2B)。CD9のTim4非添加群に対する濃縮率を見てみると、Streptavidinでは89.6倍だったのに対してVer.2ビーズでは149.1倍に濃縮されており、濃縮率が1.66倍に増加していた(図2C)。このことから、Ver.2ビーズでは非特異的な吸着が少ないものと考えられた。
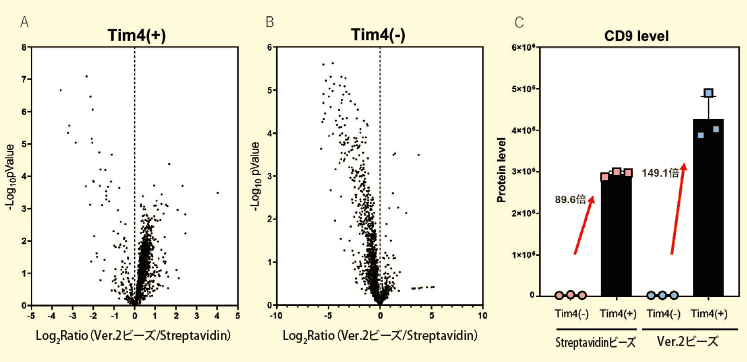
図2.
おわりに
以上の結果から、MagCapture™ エクソソームアイソレーションキットを用いてEVのプロテオミクスを行う場合、添付のElution bufferを用いるのではなく、プルダウン後のビーズからPTS溶液で直接タンパク質を可溶化することで回収量を増やすことができた。また、添付のStreptavidinビーズではなくVer.2ビーズを用いることで、さらに高回収率かつ高選択的にEVプロテオーム情報を取得できることが示された。
キーワード
液体クロマトグラフィータンデム質量分析計
プロテオミクスにおいてタンパク質およびペプチドの定性・定量に用いられる分析機器。ペプチドは自身が持つ特性に依存して液体クロマトグラフィーで分離される。分離されたペプチドは順次イオン化され、質量分析計に導入される。質量分析計内でペプチドの構造情報が取得される。
Swiss-Prot
様々な生物種のタンパク質情報を集積したデータベース。アミノ酸配列だけでなく翻訳後修飾や機能、他のデータベースにおける登録ID 情報などが掲載されている。
相間移動溶解剤(Phase transfer surfactant, PTS)
pH や塩類の添加で、水への溶解性が変化する化合物。デオキシコール酸およびラウロイルサルコシン酸は、酸性条件下でカルボン酸が分子型となり水への溶解性が劇的に低下する。プロテオミクスの前処理において、不要になったPTS は液液分配で除去できる。
参考文献
- Masuda, T. et al. : J. Proteome Res., 7 (2), 731 (2008). DOI: 10.1021/pr700658q
- Masuda, T. et al. : Mol. Cell. Proteomics, 8 (12), 2770 (2009). DOI: 10.1074/mcp.M900240-MCP200
- Masuda, T. et al. : J. Proteome Res., 19 (1), 75 (2020). DOI: 10.1021/acs.jproteome.9b00347
- Gandham, S. et al. : Trends. Biotechnol., 38 (10), 1066 (2020). DOI: 10.1016/j.tibtech.2020.05.012
- Linares, R. et al. : J. Extracell. Vesicles., 4, 29509 (2015). DOI: 10.3402/jev.v4.29509
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016). DOI: 10.1038/srep33935











