【連載】ミクログリア研究の最前線−基礎から臨床へ− 「第5回 ヒ ト血液を用いた脳内ミクログリア活動性予測による心のリバース・トランスレーショナル研究」
本記事は、和光純薬時報 Vol.89 No.3(2021年7月号)において、九州大学大学院 医学研究院 精神病態医学 加藤 隆弘様に執筆いただいたものです。
はじめに
近年、神経変性疾患に限らず様々な精神神経疾患において脳内炎症に重要な働きを担う免疫細胞ミクログリアの関与が示唆されているが、ヒトでの知見は限られている。従来、ミクログリアをターゲットとした臨床研究は、死後脳研究とPET研究が中心であった。こうした研究により、統合失調症患者、うつ病患者、自閉スペクトラム症患者、そして、自殺者の脳内でミクログリアの過剰活性化が報告されている。PET技術により生きている患者の脳内ミクログリア活性化を部分的に計測できるが、ミクログリア活性化は実際には多種多様であり、現在のPET技術で測定できる活性化の種類はTSPOなどごく一部の活性化計測に限られている。
解像度の課題も大きく、PETだけでダイナミックで多彩なミクログリア活性化を特にモレキュラーレベルで評価することは困難である。特に創薬においては分子基盤の解明が鍵になるため、その限界は無視できない。
患者の脳のミクログリア細胞を採取して解析することが理想的であるが、倫理的にも技術的にもハードルが高い。従って、齧歯類などモデル動物の脳から採取したフレッシュなミクログリア細胞の解析はミクログリア病態解明のためには不可欠であり、筆者の研究室でもミクログリアにフォーカスを当てたモデルマウス実験を推進している1)。しかしながら、精神疾患の表現型をすべて満たしうるモデル動物の作製は不可能である。こうした限界を打開するために、我々は、ヒトを対象として特にアクセスしやすい血液を用いた精神疾患リバース・トランスレーショナル研究を推進しているので紹介する。
ヒト血液由来 iMG 細胞の開発と応用
2016年以降、ヒトiPS細胞由来ミクログリア様細胞の開発が次々に報じられており、様々な脳疾患におけるミクログリアの病態理解への期待が高まっている2,3)。特に遺伝的影響の大きい疾患においてはiPS細胞由来ミクログリア様細胞の解析は有用であるが、精神疾患においては遺伝的因子よりは環境因子が大きい疾患も多く存在しており、ステイトを反映しうる疾患モデル細胞の解析が重要である。しかるに、筆者の研究室では、ステイト情報がリセットされるiPS細胞を用いずに体細胞から直接的にミクログリア様細胞を誘導する技術開発を進めてきた。
2014年、ヒト末梢血単球にGM-CSFとIL-34という2種類のサイトカインを投与することにより、わずか2週間で作製可能な直接誘導ミクログリア(iMG)細胞の作製に成功した(図1)4)。
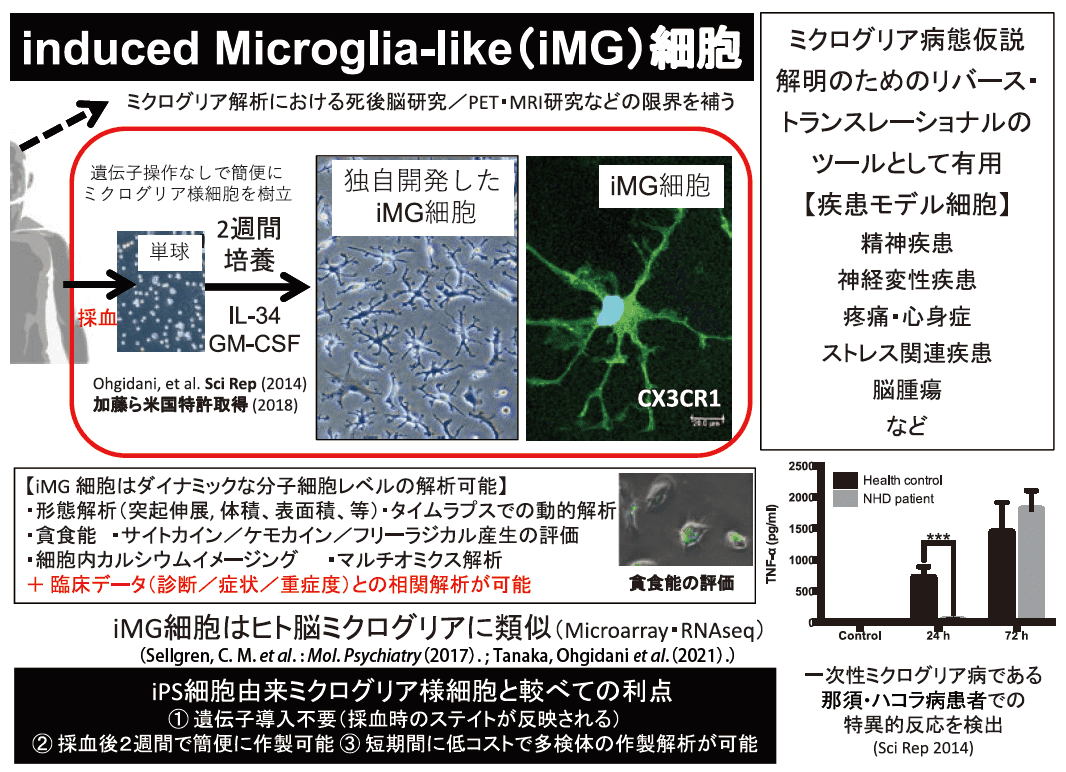
図1.ヒト血液由来直接誘導ミクログリア様(iMG)細胞の特徴
(文献4 および5 より改変)iPS 細胞と異なり、iMG細胞は遺伝子組み換え操作を一切必要とせずケミカル誘導により極めて短時間で作製可能であり、多くの検体数を比較的安価に作製可能である。さらに、iMG細胞は貪食能やサイトカイン産生能といったダイナミックな機能を計測可能であり、生きた細胞の多彩な分子レベルの解析が可能で、死後脳研究やPET研究のデメリットを補うことが期待される4,5)。
2014年の開発時点で、iMG細胞がヒトの脳ミクログリア細胞の性質の多くを有しており、単球やマクロファージとは異なる表現型を示すことを確認している4)。米国マサチューセッツ総合病院(MGH)の研究グループは、筆者らの助言を得て作製したiMG 細胞がヒト脳ミクログリアに最も類似していることをマイクロアレイ解析によって明らかにしている6)。筆者らも九大脳外科との連携により、末梢血由来iMG細胞が同一患者の同時期の脳ミクログリアと類似していることをRNAseqによる網羅的な遺伝子発現解析で見出している(Tanaka, S. et al. : Front. Immunol., in press)。
ヒトiMG細胞はすでに精神神経疾患や疼痛性疾患の病態解明研究やバイオマーカー開発研究に応用されている。筆者らが真っ先に注目したのは代表的な一次性ミクログリア病として知られる那須・ハコラ病である。精神病症状を30代で呈し40代で認知症症状が進行し寝たきり状態になった女性患者から作製したiMG細胞では、貪食刺激に対してTNF-α・IL-6など炎症性サイトカインの産生レスポンスが遅延する傾向があり、同時に、IL-10など保護的サイトカイン産生に関しては早期から産生が抑制される傾向を見出した4)。こうした患者由来iMG細胞の反応から、那須・ハコラ病における多彩な精神症状出現や若年性認知症発症にミクログリアによる慢性的な脳内炎症の関与が示唆される4)。
つぎに、筆者が臨床で関わっていた双極性障害Ⅰ型・急速交代型(ラピッドサイクラー)の患者のiMG細胞を解析したところ、1名の男性患者では躁状態の時にM1型優位のmRNAプロファイリングを示し、佐賀大学精神科の協力で3名での解析を試みたところ、M2型の代表的マーカーであるマンノースレセプターCD206のmRNA発現が「うつ状態」の時に共通して亢進していた7)。こうした結果から、双極性障害における「躁」と「うつ」のシフトにミクログリアの免疫応答の変化が重要な役割を果たしている可能性がある7)。
さらに、九大心療内科との連携により精神疾患に限らず身体疾患を有する患者からもiMG細胞を用いたリバース・トランスレーショナル研究を進めており5)、女性の線維筋痛症患者のiMG細胞においてTNF-α mRNAの高発現を見出しており、疼痛性障害の客観的バイオマーカーになる可能性を提案している8)。九大脳外科との連携により、iMG細胞のCD206の発現パターンが脳腫瘍(グリオーマ)の進行度を予測するマーカーになる可能性も萌芽的に見出している(Tanaka, S. et al. : Front. Immunol., in press)。
iMG細胞はすでに国外の研究機関でも活用されている。前述のMGHのグループは、統合失調症患者の血液由来iMG細胞と同一患者のiPS 細胞由来ニューロンとの共培養実験により、統合失調症患者において活性化ミクログリアが補体を介した神経シナプス傷害に重要であり、ミクログリア活性化阻害作用を有する抗菌剤ミノサイクリンによって神経シナプス傷害がレスキューされることを報じている9)。米国・オランダなどの国際共同研究チームも統合失調症患者由来のiMG細胞を用いた研究に着手しており、患者由来iMG細胞の方がLPSへの反応性が高く、TNF-αの産生も多かったと報じている10)。
ヒト血液メタボローム解析
筆者の研究室では血球成分ばかりでなく、血漿や血清からも脳内ミクログリア動態を把握するための糸口を探っている。例えば、血漿を用いた神経由来エクソソーム関連の解析を進めており、ミクログリア活動性に不可欠なサイトカインであるIL-34がうつ病の病態に関与する可能性を見出している11)。他方、九大検査部との連携により、抑うつを呈する患者から末梢血を採血しメタボローム解析を実施したところ、抑うつの重症度に関連する血中代謝物を幾つか同定し、さらに、自殺念慮の強さがミクログリア活性化と関連深いトリプトファン−キヌレニン代謝経路における複数の代謝物と相関することを見出している12,13)。
こうした結果は死後脳研究において自殺者の脳内ミクログリアが活性化していたという報告をサポートする知見である。しかるに、ミクログリア活性化の制御とその把握は、喫緊の社会的課題である自殺対策にも有用であると想定し、現在、様々な手法を組み合わせた双方向性研究を推進している14)(図2)。
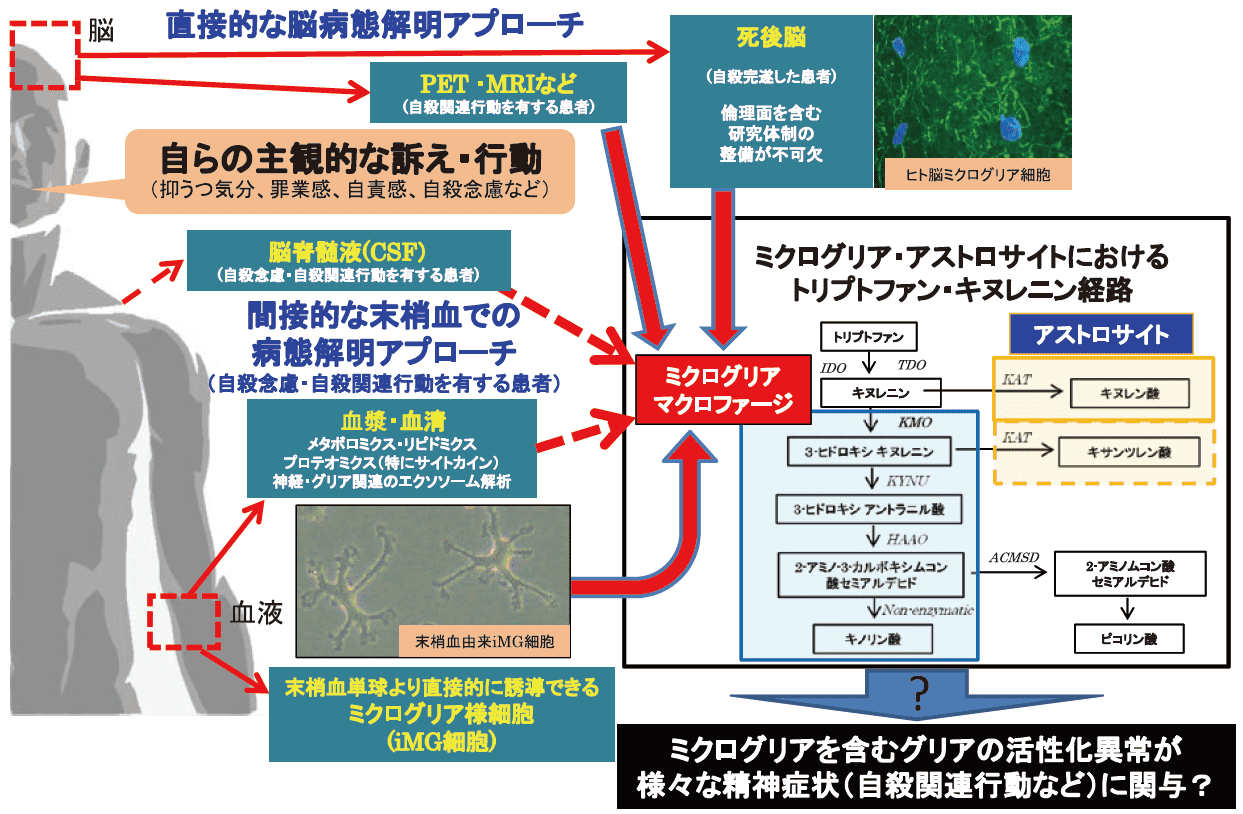
図2.精神疾患の病態解明とバイオマーカー開発のための多軸的アプローチ
(例:⾃殺関連行動へのアプローチ),文献14 より引用・改変おわりに
抑うつ・不安・妄想そして自殺念慮など様々な精神症状や精神病態にミクログリアの過剰活性化や活性化制御不全が関与している可能性がある。今後、様々な精神疾患を対象として、臨床データ取得、ヒト血液解析(iMG細胞解析やメタボローム解析)、およびヒト脳解析を組み合わせたリバース・トランスレーショナル研究が発展し、分子細胞レベルでのミクログリアを介した精神病態機序が解明されることで、ミクログリアをターゲットとした新しい治療薬の開発が期待される。採血により作製可能なiMG細胞の解析やメタボローム解析は、精神疾患に限らず、様々な疾患における脳内ミクログリア動態を反映する客観的バイオマーカーとしての活用も期待される。
参考文献
- Ohgidani, M. et al. : Brain Behav. Immun., 55, 17-24 (2016). DOI: 10.1016/j.bbi.2015.08.022
- Muffat, J. et al. : Nat. Med., 22, 1358-1367 (2016). DOI: 10.1038/nm.4189
- Pocock, J. M. and Piers, T. M. : Nat. Rev. Neurosci., 19, 445-452 (2018). DOI: 10.1038/s41583-018-0030-3
- Ohgidani, M. et al. : Sci. Rep., 4, 4957 (2014). 10.1038/srep04957
- Ohgidani, M. et al. : Front. Cell. Neurosci., 9, 184 (2015). DOI: 10.3389/fncel.2015.00184
- Sellgren, C. M. et al. : Mol. Psychiatry., 22, 170-177 (2017). DOI: 10.1038/mp.2016.220
- Ohgidani, M. et al. : Front. Immunol., 7, 676 (2017). DOI: 10.3389/fimmu.2016.00676
- Ohgidani, M. et al. ; Sci. Rep., 7, 11882 (2017). DOI: 10.1038/s41598-017-11506-4
- Sellgren, C. M. et al. : Nat. Neurosci., 22, 374-385 (2019). DOI: 10.1038/s41593-018-0334-7
- Ormel, P. R. et al. : Brain Behav. Immun., 90, 196-207 (2020). DOI: 10.1016/j.bbi.2020.08.012
- Kuwano, N. et al. : J. Affect. Disord., 240, 88-98 (2018). DOI: 10.1016/j.jad.2018.07.040
- Kuwano, N. et al. : J. Affect. Disord., 231, 74-82 (2018). DOI: 10.1016/j.jad.2018.01.014
- Setoyama, D. et al. : PLoS One, 11, e0165267 (2016). DOI: 10.1371/journal.pone.0165267
- Suzuki, H. et al. : Front. Cell. Neurosci., 13, 31 (2019). DOI: 10.3389/fncel.2019.00031









