【総説】ヒト iPS/ES 細胞除去試薬の開発
本記事は、和光純薬時報 Vol.83 No.3(2015年7月号)において、国立研究開発法人 産業技術総合研究所 創薬基盤研究部門 舘野 浩章 様に執筆いただいたものです。
はじめに
ヒト iPS/ES 細胞がもつ腫瘍形成能がヒト iPS/ES 細胞を用いた再生医療の大きな課題となっている。我々はこれまで高密度レクチンアレイを用いて網羅的グライコーム解析を行った結果、ヒト iPS/ES 細胞に選択的に反応するレクチン rBC2LCN(別名:AiLecS1)の発見に至っている。
今回、この rBC2LCN に緑膿菌由来毒素の触媒ドメイン(PE23)を融合させたレクチン-薬剤複合体(rBC2LCN-PE23)を開発した。rBC2LCN-PE23 を培養液に添加すると、ヒト iPS/ES 細胞に結合し、細胞内に移行して、ヒト iPS/ES 細胞をほぼ完全に死滅させることができた。しかし、調べた限りでは他の分化した細胞への影響はなかった。そのため、rBC2LCN-PE23 はヒト ES/iPS 細胞から作製した分化細胞に残存するヒト iPS/ES 細胞を除くための試薬として、今後広く活用されることが期待される。
ヒト iPS/ES 細胞を用いた再生医療の大きな課題
ヒト iPS 細胞やヒト ES 細胞は、無限に増殖できる能力(自己複製能)や、心筋細胞や神経細胞など、あらゆる細胞に分化する能力(多能性)を持つことから、再生医療のための細胞源として大きな期待が寄せられている。特にヒト iPS 細胞は 4 種の遺伝子を導入するだけで様々な体細胞から作製することができることから、再生医療のみならず、病態モデルや創薬開発などへの応用が期待されている。
現在、ヒト iPS/ES 細胞を用いた再生医療を実現化するために多くの研究が進められている。昨年の 9 月には、理研のグループにより加齢黄斑変性の治療を目的としたヒト iPS 細胞由来の網膜色素上皮細胞の移植が世界で初めて実施された。
しかしヒト iPS/ES 細胞の臨床応用が現実的になりつつある一方で、安全性における大きな課題が存在しており、それがヒト iPS/ES 細胞の腫瘍化である。マウスにヒト iPS 細胞を移植した場合、僅か数百個でもテラトーマを形成できると報告されている。それ故、ヒト ES/iPS 細胞を用いた再生医療を実現化するためには、残存するヒト iPS/ES 細胞を除くための技術が必要不可欠である。また、それはヒト iPS 細胞由来の分化細胞を用いた病態モデル構築のためにも重要である。
これまでに残存ヒト iPS/ES 細胞を除くための技術として、大きく 2 つ報告されている。1 つが化学阻害剤で死滅させる方法で、もう 1 つが抗体やレクチンを用いてセルソーターで分離する方法である。基本的には、ヒト iPS/ES 細胞は他の分化細胞と同じ代謝活性を有することから、前者を用いた場合には、他の細胞への影響といった選択性の面で課題がある。一方、後者は前もって 1 つ 1 つの細胞に解離してからセルソーターという特殊な装置を用いてヒト ES/iPS 細胞を取り除くため、細胞シートなどへの適用ができない、処理速度が遅い、移植用細胞の生存に悪影響を与える可能性がある、などの課題がある。
移植用細胞に残存するヒト iPS/ES 細胞を、安全、確実、かつ簡便に除去できる新たな技術が求められていた。
ヒト iPS/ES 細胞特異的レクチン rBC2LCN の開発の経緯
糖鎖は細胞の最表層を覆い、その構造は細胞の種類や性質に応じて劇的に変化することが知られている。実際に、癌マーカーや幹細胞マーカーの多くが糖鎖であることからも、糖鎖が細胞を見分ける際の目印として有効であることが分かる。ヒト iPS/ES 細胞表面ももちろん糖鎖で覆われているものの、その構造はほとんど理解されていなかった。
こうした中、我々はこれまで細胞表面を高密度に覆う糖鎖を迅速かつ高感度に解析する技術として高密度レクチンマイクロアレイを開発してきた。2007 年に京都大学の山中教授らによりヒト iPS 細胞が樹立された直後に、我々は本レクチンマイクロアレイを活用して、ヒト iPS/ES 細胞表面糖鎖を網羅的に解析した1)。その結果、ヒト ES/iPS 細胞表面糖鎖がどのような構造をしているかということを明らかにするとともに、レクチン(糖結合タンパク質の総称)の一種である rBC2LCN がヒト iPS/ES 細胞に特異的に結合することを見出した。
その後、和光純薬工業との共同研究により、rBC2LCN を用いてヒト iPS/ES 細胞を生きたまま染色できる試薬を開発した(非標識 rBC2LCN レクチン:2013年6月、rBC2LCN-FITC:2014年3月、rBC2LCN-635:2014年12月)2)。また、ヒト iPS/ES 細胞への結合機構を解析したところ、rBC2LCN はポドカリキシンという糖タンパク質上の特定の O 型糖鎖である H タイプ 3 に結合することを明らかにした3)。
さらに、ポドカリキシンがさまざまな種類のヒト iPS/ES 細胞から培養液中にも分泌されているという現象を見いだし、これを利用して細胞培養液を用いて移植用細胞に残存するヒト iPS/ES 細胞を簡便に測定する技術を開発してきた4)。
薬剤融合型 rBC2LCN(rBC2LCN-PE23)を用いたヒト iPS/ES 細胞除去技術の開発
上記したように、rBC2LCN はヒト iPS/ES 細胞に特異的に結合する。面白いことに rBC2LCN は、ヒト iPS/ES 細胞に結合した後に、細胞内に取り込まれることが分かった5)。この現象を活用すれば、ヒト iPS/ES 細胞内に薬剤を送り込むことができるはずである。
そこで、細胞内に取り込まれるとタンパク質合成を阻害して、細胞死を引き起こす緑膿菌由来外毒素を rBC2LCN の C 末端部分に融合させた組換えタンパク質(rBC2LCN-PE23)を考案した(図 1)。
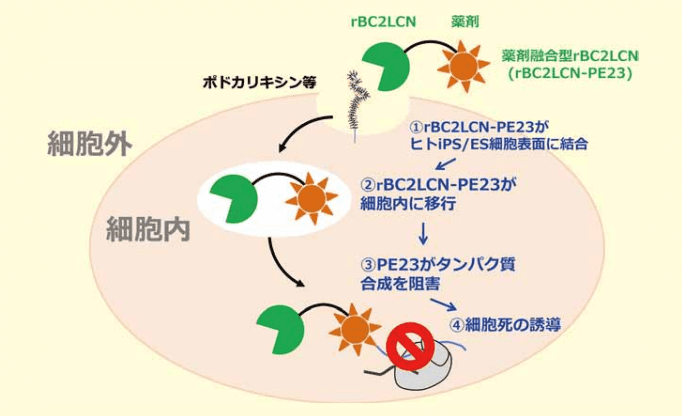
図1.rBC2LCN-PE23を用いたヒトiPS/ES細胞除去機構
rBC2LCN-PE23 をヒト iPS 細胞(201B7 株)に 0、6、24 時間反応させた後の顕微鏡写真像を図 2 に示す。生きた細胞を細胞質が緑色蛍光、死んだ細胞を核が赤色蛍光で染色処理して観察した。すると、rBC2LCN-PE23 を培養液に添加していない(0 µg/mL)場合は、多くのヒト iPS 細胞は培養皿に接着し、緑色蛍光で染色されたものの、赤色蛍光ではほとんど染色されなかった。つまりほとんどのヒト iPS 細胞が生きていることを示している。
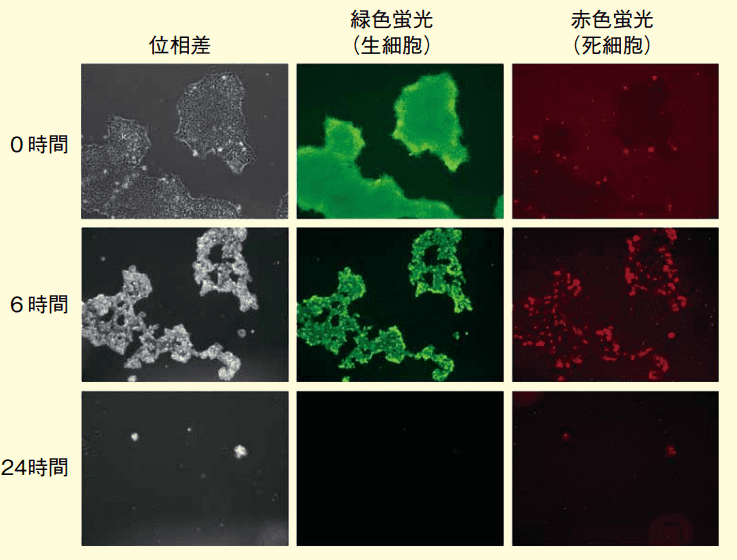
図2.rBC2LCN-PE23のヒトiPS細胞(291B7株)除去の経時的効果
位相差:実際の細胞の形態、緑色蛍光:生細胞が緑色に染色、赤色蛍光:死細胞が赤色に染色一方、10 µg/mL の rBC2LCN-PE23 を培養液に添加して 6 時間後、明らかに細胞の形態が変化し、赤色蛍光で染色される伸だ細胞の数が増加した。24 時間後にはほとんどの細胞が培養皿への接着能力を失い、培養液中に浮遊した。つまり、ほとんどのヒト iPS 細胞が死んだことを示している。rBC2LCN-PE23 はヒト ES 細胞でも同様の効果を示した。
また、ヒト iPS 細胞(201B7 株)とヒト皮膚繊維芽細胞を混合して培養した。10 µg/mL の rBC2LCN-PE23 の添加前、及び添加 24 時間後の顕微鏡写真像を図 3 に示す。24 時間後はヒト iPS 細胞(201B7 株)のみが選択的に死滅し、培養液中に浮遊した。一方、ヒト皮膚線維芽細胞の生存や増殖には影響を与えなかった。
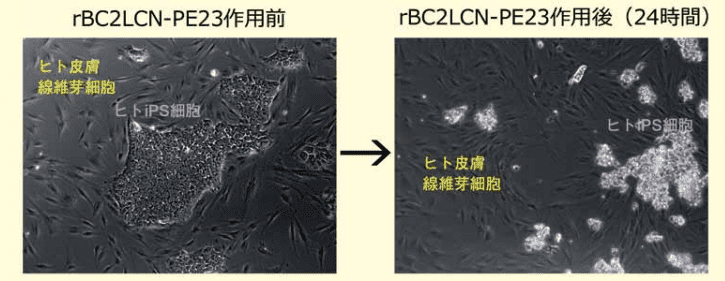
図3.rBC2LCN-PE23によるヒトiPS細胞(291B7株)の選択的除去
〈左図〉ヒト皮膚線維芽細胞(細長い細胞)とヒトiPS細胞(201B7株)を混合培養した顕微鏡写真(位相差像)。〈右図〉10 µg/mLのrBC2LCN-PE23を添加して24時間培養後の顕微鏡写真(位相差像)。ヒトiPS細胞のコロニーのみが選択的に死滅し、培養液中に浮遊しているのが分かる。除去効率を算出したところ、10 µg/mL の rBC2LCN-PE23 を添加して 24 時間後にはほぼ全てのヒト ES/iPS 細胞を死滅した。一方、ヒト皮膚線維芽細胞やヒト間葉系幹細胞の生存率には全く影響がなかった。
まとめ
今回開発した rBC2LCN-PE23 は以下 3 つの特徴をもつ。
(i) 培養液に添加するだけでヒト iPS/ES 細胞を除去できる。特殊な装置は必要ない。
(ii) 大量の細胞や細胞シートへの適用もできる。
(iii) 洗浄操作で薬剤融合型レクチンを簡単に除くことができるため、体内に持ち込まれることはない。
調べた限り、他の細胞への影響はない。しかし事前に目的の細胞への影響を調べてから使用する必要がある。rBC2LCN-PE23 はまず、未分かなヒト iPS/ES 細胞を除くための一般的な試薬として広く活用されることが期待される。
今後は、実際の再生医療に用いる移植用細胞の製造に活用できるよう、その効果や安全性についての検証を進める予定である。
参考文献
- Tateno, H., Toyota, M., Saito, S., Onuma, Y., Ito, Y., Hiemori, K., Fukumura, M., Matsushima, A., Nakanishi, M., Ohnuma, K., Akutsu, H., Umezawa, A., Horimoto, K., Hirabayashi, J. and Asashima, M. : J. Biol. Chem., 286, 20345 (2011). DOI: 10.1074/jbc.M111.231274
- Onuma, Y., Tateno, H., Hirabayashi, J., Ito, Y. and Asashima, M. : Biochem. Biophys. Commun., 431, 524 (2013). DOI: 10.1016/j.bbrc.2013.01.025
- Tateno, H., Matsushima, A., Hiemori, K., Onuma, Y., Ito, Y., Hasehira, K., Nishimura, K., Ohtaka, M., Takayasu, S., Nakanishi, M., Ikehara, Y., Ohnuma, K., Cham, T., Toyoda, M., Akutsu, H., Umezawa, A., Asashima, M. and Hirabayashi, J. : Stem Cells Transl. Med., 2, 265 (2013). DOI: 10.5966/sctm.2012-0154
- Tateno, H., Onuma, Y., Ito, Y., Hiemori, K., Aiki, Y., Shimizu, M., Higuchi, K., Fukuda, M., Warashina, M., Honda, S., Asashima, M. and Hirabayashi, J. : Sci Rep., 4, 4069 (2014). DOI: 10.1038/srep04069
- Tateno, H., Onuma, Y., Ito, Y., Minoshima, F., Saito, S., Shimizu, M., Aiki, Y., Asashima, M. and Hirabayashi, J. : Stem Cell Reports, in press.
キーワード
レクチン
糖鎖に結合するタンパク質の総称で、ヒトからウイルスまで全ての生物に存在する。1888 年にロシアのスティルマークにより、ヒマ種子の抽出液がいろいろな動物の血球を凝集することを発見したのが最初。特定の糖鎖に結合することから、古くから糖鎖解析のための試薬として応用されるほか、細胞間の相互作用を媒介することによりさまざまな生命現象に深く関与する機能を持つ。
レクチンマイクロアレイ
異なる糖結合特異性を持つ複数種のレクチンを同一基板(スライドグラスなど)上に固定化したもので、プロテインマイクロアレイの一種。複数種のレクチンの反応パターンから、サンプル中に存在する糖鎖を迅速、高感度にプロファイリングする技術。精製された糖鎖や糖タンパク質だけでなく、血清、細胞、組織などの生体試料の解析が可能。がん細胞や幹細胞を識別するための指標(マーカー)の探索に有効である。
緑膿菌由来外毒素
細胞内に取り込まれると真核生物のペプチド鎖伸張因子 eEF2 を ADP リボシル化することによりタンパク質合成を阻害して、細胞死を引き起こすタンパク質性の毒素。各種疾患の抗体医薬などにも応用が進んでいる。





