【連載】Wako Organic Chemical News No.08「フィンケルシュタイン反応とその関連反応」

今月の反応・試薬 「 フィンケルシュタイン反応とその関連反応 」
サイエンスライター : 佐藤 健太郎氏
筆者はかつて、製薬企業の研究所に勤務していた。医薬候補化合物の最適化段階においては、主骨格に多数の置換基を導入し、最も活性の高いものを探索する検討が行われる。このため、多数のアルキル化剤を用意しなければならなかった。この工程で多用したのが、塩化アルキルに対してヨウ化ナトリウムを作用させ、ヨウ化アルキルへ変換する、ハロゲン交換反応であった。溶媒としてはアセトンまたはメチルエチルケトン(MEK)、N,N-ジメチルホルムアミド(DMF)などが用いられることが多い。

この反応に「フィンケルシュタイン反応」という名がつけられていることは、だいぶ後になって知った。この反応は形式が極めてシンプルであるためか、人名反応の本などでも収録されていないことが多いようだ。ハロゲン交換反応自体は、H. W. Perkinが1880年代に報告しているが、詳細な検討を行って1910年に論文としてまとめた、H. Finkelsteinの名をとって呼ばれる1)。
筆者は昔、強いC-Cl結合が切れて、弱いC-I結合に組み変わるというのは、どうも不思議な気がしていた。原料と生成物が逆になるのでなければおかしいのではないかと思ったのだ。実のところ、この反応は平衡の関係にあるが、ヨウ化ナトリウムがアセトンに溶けるのに対し、塩化ナトリウムや臭化ナトリウムはアセトンには溶解しないため、結晶として析出してしまい、このため平衡がヨウ化アルキル側に偏っていくという原理だ。
ではなぜヨウ化ナトリウムだけが、アセトンに溶けるのか?これは、ナトリウムイオンにアセトンが6分子配位してできた周辺の空間に、ヨウ化物イオンがよくフィットするために起きる現象らしい。このおかげで、安価で入手容易な塩化アルキルや臭化アルキルから、合成的に有用なヨウ化アルキルへの簡便な変換が可能になっているのだ。
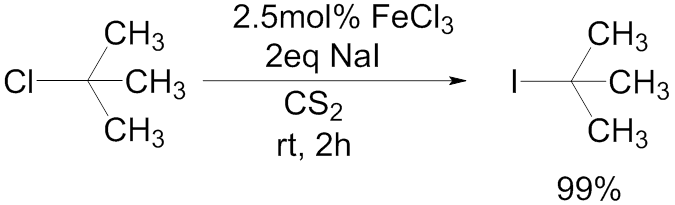
フィンケルシュタイン反応は、通常一級または二級のハロゲン化アルキル基に対して起こり、SN2型の反応形式で進行する。三級のハロゲン化アルキルに対しては、塩化鉄(III)を触媒とし、二硫化炭素中で反応を行う方法が報告されている2)。
近年では、塩化物からヨウ化物への反応のみならず、各種スルホン酸エステルなど擬ハロゲン化物を含め、ハロゲン交換反応全体を指してフィンケルシュタイン反応と呼ぶことが多い。下図のように、ヒドロキシ基のメタンスルホニル化、それに続くフィンケルシュタイン反応により、容易にヨウ化アルキル化合物を合成できる。
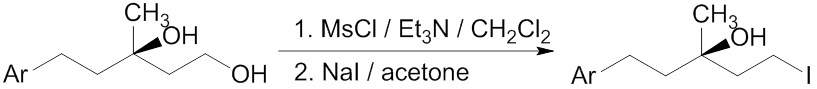
ヒドロキシ基からハロゲン化物への変換は、トリフェニルホスフィンと四ヨウ化炭素などのハロゲン源を組み合わせる、いわゆるアッペル反応などによっても達成できる。スルホニル化からフィンケルシュタイン反応を行う方法は、これに比べて2段階を要するため非効率に見えるが、操作の容易さ、収率の高さ、条件の温和さ、廃棄物の少なさなど優れた点も多い。
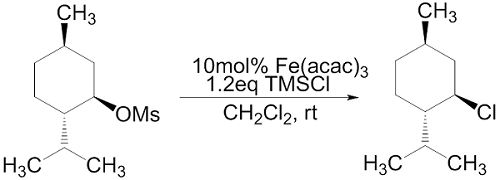
前述のように、フィンケルシュタイン反応はSN2型で起こり、立体反転を伴って進行する。ただし、条件によって転位や二量化などの副反応を伴うことがある。最近になり、メタンスルホン酸エステルを、立体保持しながらハロゲン化物に変換する方法が報告された。触媒量の鉄錯体(Fe(acac)3)を用い、ハロゲン源としてハロゲン化トリメチルシリルを用いるのが、この方法のミソだ3)。
芳香族フィンケルシュタイン反応
ヨウ化アリールは、クロスカップリング反応の基質などとして重要だが、合成法は案外少ない。フィンケルシュタイン反応が適用できればよいが、当然ながらハロゲン化アリールに対しては、同じ条件では反応は起こらない。
しかし2002年、S. L. Buchwaldらによって、芳香族フィンケルシュタイン反応というべき手法が報告された。臭化アリールに対し、5mol%のヨウ化銅(I)、10mol%のジアミン配位子、2当量のヨウ化ナトリウムを加え、ジオキサン中110℃で加熱するという条件により、収率よく基質がヨウ化アリールに変換されるというものだ4)。
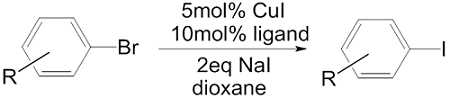
この方法は、さまざまに官能基化された芳香族化合物に対しても適用可能であり、ブロモピリジン類などヘテロ環化合物でも収率よく反応が進行する。また、臭化アルケニルも同様の条件で反応し、ヨウ化物へと変換される。ただし芳香族塩化物は反応が遅く、たとえばクロロベンゼンは、24時間後でも35%程度しか変換が進まない。
またごく最近になり、金属触媒を用いない芳香族フィンケルシュタイン反応が見出された5)。これは、アルキンとヨウ化アリールのカップリング反応の研究において、副反応として見つかったものだ。ヨウ化ナトリウム水溶液中、単に紫外線を照射するだけで、ブロモベンゼンがヨードベンゼンに変換されている。最適化の余地はあるが、今後有用な反応に成長する可能性がありそうだ。
というわけで、フィンケルシュタイン反応は地味ながらも有用な反応であり、適用範囲も広がっている。バリエーションも含め、合成化学者なら押さえておくべき反応ではないだろうか。
参考文献
- (総説)Chem. Rev., 56, 571 (1956).
- J. Chem. Soc., Perkin Trans., 1, 416 (1976).
- Adv. Synth. Catal., 353, 963 (2011).
- J. Am. Chem. Soc., 124, 14844 (2002).
- Nature Communications 6, 6526 (2015).
注目の論文
① Palladium-Catalyzed α,β-Dehydrogenation of Esters and Nitriles
Yifeng Chen , Justin P. Romaire , and Timothy R. Newhouse*
J. Am. Chem. Soc., Article ASAP DOI: 10.1021/jacs.5b02243
α,β-不飽和カルボニル化合物は、多くの天然物に含まれる他、有用な合成中間体でもある。しかしその合成法は、安全性やコスト、適用範囲などの面で問題のあるものが多かった。 今回著者らは、エステルやニトリルなどの電子求引基を含む化合物の、簡便な脱水素反応を報告している。リチウムテトラメチルピペリジドなどの強塩基、塩化亜鉛、ピバリン酸アリルと、パラジウム触媒を加えて-40℃で撹拌するという条件で、収率よく目的物を得ている。
② Arene Oxidation with Malonoyl Peroxides
Andrei Dragan, Tomasz M. Kubczyk, Julian H. Rowley, Stephen Sproules, and Nicholas C. O. Tomkinson *
Org. Lett., Article ASAP DOI: 10.1021/acs.orglett.5b00953
著者らはすでに、5員環型の環状マロン酸過酸化物誘導体が有用な酸化剤となることを見出しており、2012年にはオレフィンを1,2-ジオールに酸化できることを報告している(J. Org. Chem., 2012, 77, 921)。 今回、著者らはさらに、芳香族化合物をフェノールに酸化できることを報告している。トリフルオロイソプロパノール中、室温で反応は進行し、収率よく目的のフェノールを得ている。試薬の合成も簡便であり、有用な反応といえそうだ。
③ Practical olefin hydroamination with nitroarenes
Jinghan Gui, Chung-Mao Pan*, Ying Jin*, Tian Qin, Julian C. Lo, Bryan J. Lee, Steven H. Spergel, Michael E. Mertzman, William J. Pitts, Thomas E. La Cruz, Michael A. Schmidt, Nitin Darvatkar, Swaminathan R. Natarajan, Phil S. Baran
Science, 348, 886 (2015).
ニトロアレーンと単純なオレフィンを、還元的に結合させ、オレフィンのヒドロアミノ化を行う反応。触媒となるのは安価な鉄錯体(Fe(acac)3)、還元剤となるのはフェニルシラン(PhSiH3)。これらをエタノール中60℃で撹拌後、副反応を防ぐために亜鉛粉末と塩酸を加えて、やはり60℃で1時間撹拌することで、収率よく生成物が得られる。官能基許容性は極めて広く、ニトロアレーンはピリジン、チオフェン、ピロールなどヘテロ芳香環でも問題なく進行する。




