蛍光標識rBC2LCN
rBC2LCN (AiLecS1) はBurkholderia cenocepacia 由来のレクチンであるBC2L-CのN末端ドメインを大腸菌で発現させた組換え体レクチンです。rBC2LCNはヒトES/iPS細胞表面に存在するポドカリキシン上のムチン様O型糖鎖であるH-type3 (Fucα1-2Galβ1-3GalNAc) に高い親和性を持つため、ヒトES/iPS細胞の未分化マーカーとして報告されています。
本製品は、蛍光色素でラベル化されており、ヒトES/iPS細胞の培養液に添加することで、未分化細胞を生きたまま解析することができます。細胞染色、フローサイトメトリーのいずれにもご使用いただけます。また、本製品の共存下で数日間培養を続けても細胞毒性は確認されておりません。
緑色蛍光標識体 (FITC)、赤色蛍光標識体 (Cy5領域) の2種類をラインアップしております。
特長
- 培地に添加するのみで染色可能
- 細胞固定せず細胞を生きたまま明瞭に染色可能
- 細胞毒性が低く、染色した状態で培養可能
- Tra-1-60, Tra-1-81, SSEA-3, SSEA-4と同様に細胞表面上の糖鎖を認識
- 細胞染色、フローサイトメトリーに使用可能
製品概要
- 無菌試験済み (0.1 μmフィルターでろ過滅菌)
- PBS (-) 溶液
- 実用希釈倍率
Live Cell Imaging 1:100 - 1,000
Flow Cytometry 1:100 - 1,000 - 励起波長・発光波長
| Excitation | Emission | |
|---|---|---|
| rBC2LCN-FITC | 495 nm | 520 nm |
| rBC2LCN-635 | 634 nm | 654 nm |
使用方法
細胞染色
生細胞染色 (Live Cell Imaging)
- 培養中のヒトES/iPS細胞を準備する。
- 培地 1 mL あたり、蛍光標識rBC2LCNを 1 - 10 μL 添加する。
- 37℃、5%CO2下で30分間インキュベートする。
- 新しい培地あるいはHBSS(+)に交換する。
- 蛍光顕微鏡を用いて観察する。
固定細胞の染色
- 培養中のヒトES/iPS細胞を準備する。
- 培地を除去し、HBSS(+)で洗浄する。
- 4%パラホルムアルデヒド溶液 (PFA) を添加し、室温で10 - 20分間静置する。
- PFAを除去後、D-PBS(-)で3回洗浄する。
- D-PBS(-)を添加する。
- D-PBS(-) 1 mL あたり、蛍光標識rBC2LCNを 1 - 10 μL 添加する。
- 37℃、5%CO2下で30分間インキュベートする。
- D-PBS(-)に交換する。
- 蛍光顕微鏡を用いて観察する。
《 フローサイトメトリー 》
- 培養中のヒトES/iPS細胞を準備する。
- 細胞分散溶液を用いて、シングルセルに分散する。
- 細胞分散溶液をチューブに移し、1,000 rpmで3分間遠心する。
- 上清を除去後、FCM Buffer*で細胞を懸濁し、遠心後、上清を捨てる。
・* FCM Buffer:D-PBS(-)やHBSS(-)もしくはそれらに10 mmol/L EDTA、1% BSAを含むもの - 5×106cells/mLとなるようにFCM Bufferで懸濁する。
- 細胞懸濁液 1 mL あたり、蛍光標識rBC2LCNを 1 - 10 μL 添加する。
- 遮光して室温で30分間静置する。
- 1,000 rpmで3分間遠心し、上清を捨てる。
- FCM Bufferで細胞を懸濁し、遠心後、上清を捨てる。
- 適量のFCM Bufferで再懸濁する。
- フローサイトメトリーに供する。
〔使用上の注意〕
- rBC2LCNによる染色は、2、3日間は維持されます。
- 血清を含む培地を使用しているときは、シグナルのバックグラウンドが高くなる可能性があります。
- フローサイトメトリーにより細胞のソーティングを行う場合は、細胞分散時やFCM Bufferに終濃度10 μmol/LとなるようにY-27632を添加してください。
製品情報
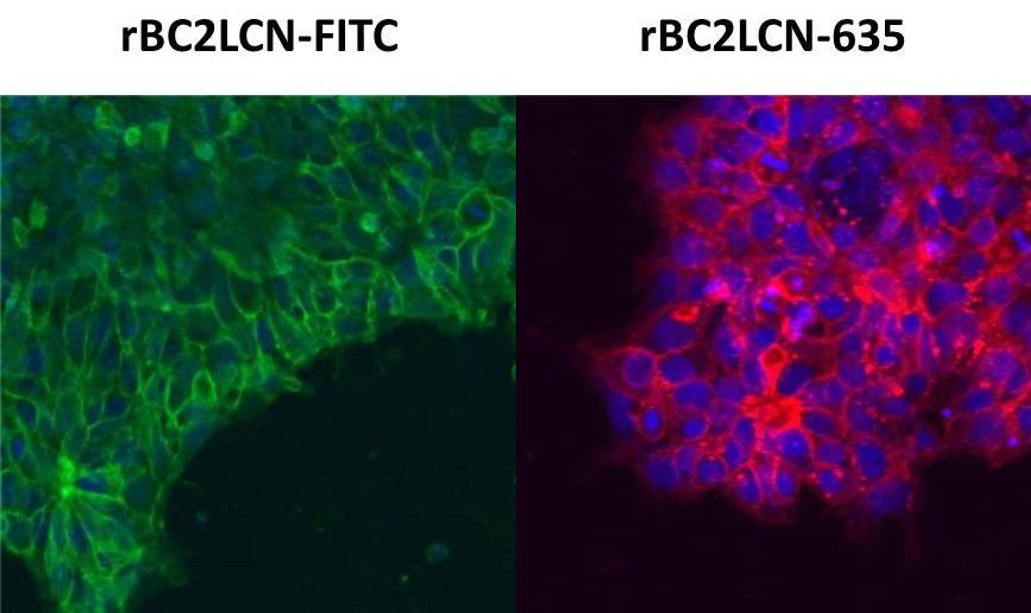
ヒトiPS細胞の生細胞染色(Live Cell Imaging)
rBC2LCN-FITCおよびrBC2LCN-635, Hoechst33342を用いてヒトiPS細胞201B7株を染色した (細胞固定無し)。

(希釈倍率 1:1,000)
rBC2LCN-FITC, Tra-1-60, Tra-1-81, SSEA-4を用いて、ヒトiPS細胞201B7株を染色し、2時間後に染色像を確認した (細胞固定無し)。
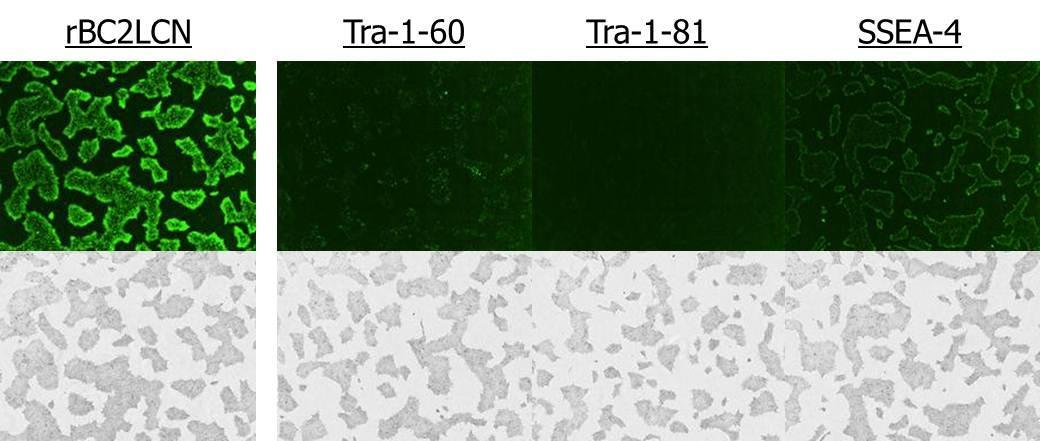
(希釈倍率 1:100)
- rBC2LCNはTra-1-60, Tra-1-81と比較して、生細胞染色強度が強い。
- rBC2LCNは培地交換後も2日目まで鮮明に染色が持続する。
ヒトES細胞の生細胞染色 (Live Cell Imaging)
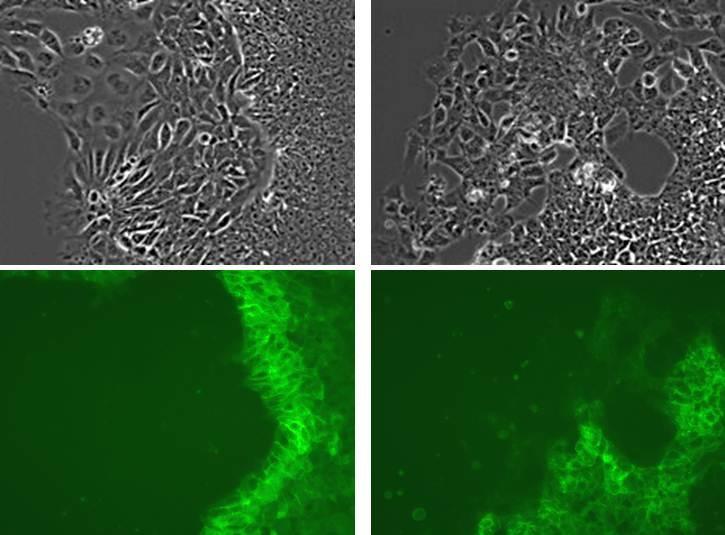
rBC2LCN-FITCを用いてヒトES細胞WA01株を染色した (細胞固定無し)。細胞の一部分が未分化状態を維持できず、分化している。rBC2LCN-FITCを用いて生細胞染色すると、未分化状態を維持している部分は染色されるが、分化している部分は染色されていないことが分かる。
<データご提供 国立研究開発法人 産業技術総合研究所 創薬基盤研究部門 幹細胞工学研究グループ 小沼泰子先生、伊藤弓弦先生 >
(所属はデータ提供時のものです)
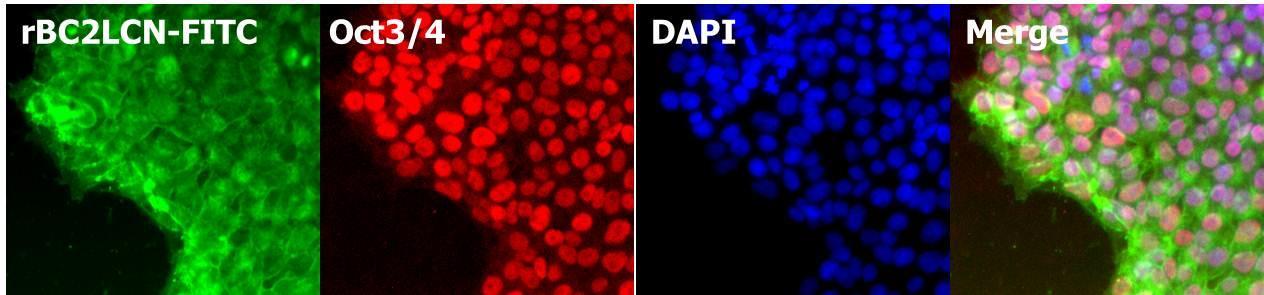
ヒトiPS細胞の固定後染色
ヒトiPS細胞201B7株をパラホルムアルデヒドで固定後、rBC2LCNとDAPIを用いて細胞染色した。
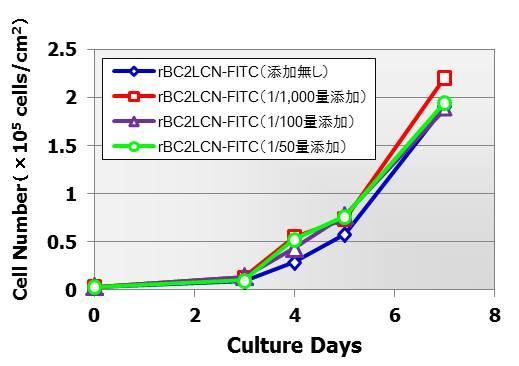
ヒトiPS細胞に対する細胞毒性評価
ヒトiPS細胞201B7株の培養液に培養液の1/1,000、1/100、1/50量のrBC2LCN-FITCを添加した状態で培養を続けた。その結果、いずれの濃度でもrBC2LCN-FITCの濃度に関わらず、同程度の細胞増殖を示すことを確認した。
〔細胞株〕
ヒトiPS細胞201B7株
〔培地組成〕
StemSure® hPSC培地Δ + 35 ng/mL bFGF
〔コーティング〕
Matrigel® hESC-Qualified Matrix
〔細胞播種数〕
4×104cells/well (12ウェルプレートを使用)
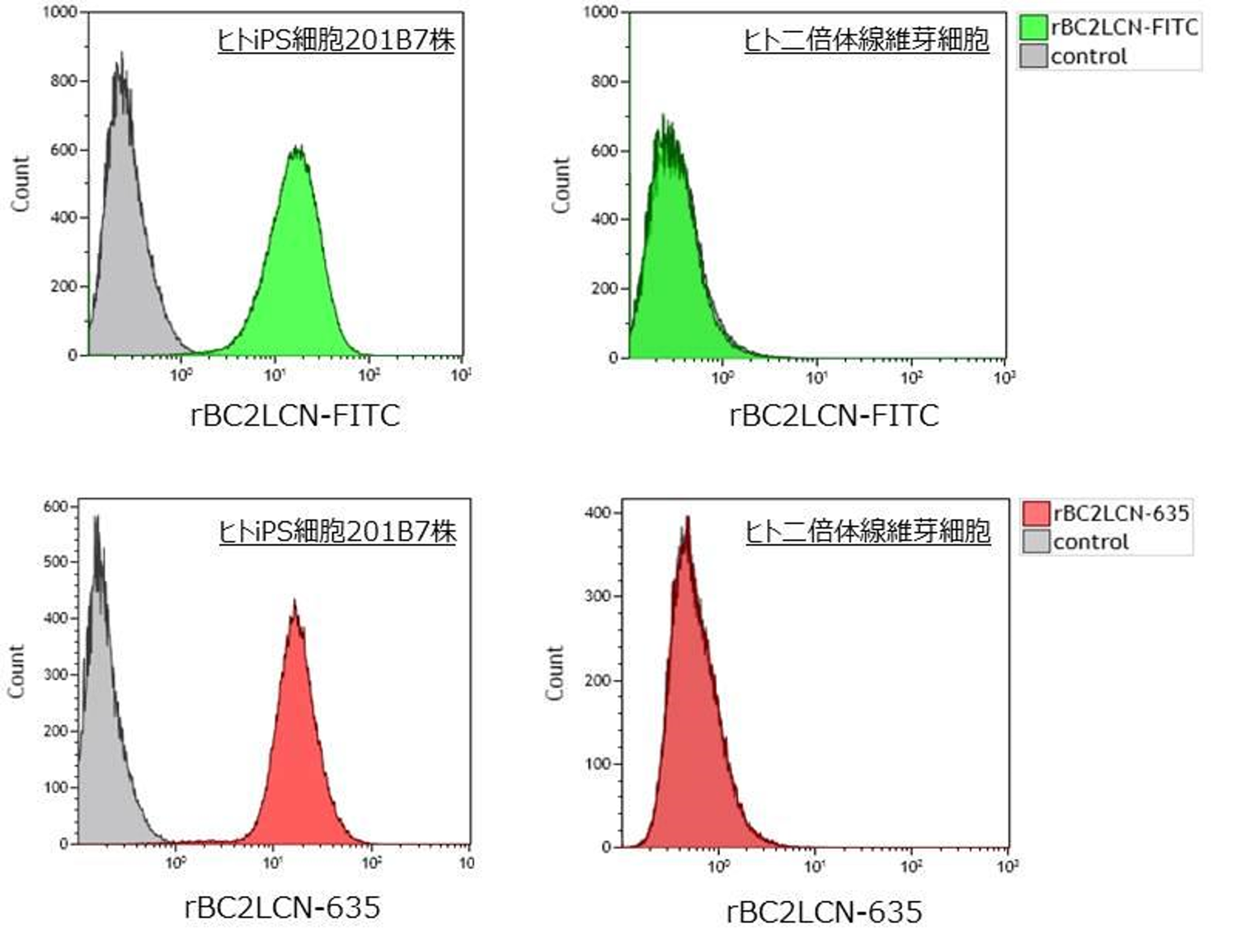
Flow Cytometryを用いたヒトiPS細胞の分離
rBC2LCN-FITCおよびrBC2LCN-635を用いてヒトiPS細胞201B7株とヒト正常二倍体線維芽細胞を染色し、フローサイトメトリーに供した。結果、未分化であるヒトiPS細胞と分化したヒト二倍体線維芽細胞を分離できた。
参考文献
Onuma, Y., et al.: Biochem. Biophys. Res. Commun., 431, 524, (2013).
Tateno, H., et al.: Stem Cells Transl. Med., 2, 265, (2013).
Tateno, H., et al.: Sci. Rep., 4, 4069, (2014).
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



