【総説】幹細胞標識用超低毒性量子ドット Fluclair™ 試薬の開発
本記事は、和光純薬時報 Vol.86 No.2(2018年4月号)において、名古屋大学 大学院工学研究科 生命分子工学専攻、名古屋大学 先端ナノバイオデバイス研究センター 湯川 博 様、馬場 嘉信 様に執筆いただいたものです。
はじめに
再生医療は、様々な幹細胞(iPS 細胞、ES 細胞、体性幹細胞など)から目的の細胞、組織、及び臓器を再構築し、それらを患者さんの体内に移植することで、これまで治療が極めて困難であった疾患の治療を可能とする。そのため、再生医療はこれまでの医療とは一線を画すものであり、全世界において非常に大きな期待を集めているのは言うまでもない。2006 年に京都大学の山中伸弥教授が樹立された iPS 細胞が登場して約 10 年の月日が経過し、数多の再生細胞が樹立されており、現在、これらを再生医療に応用する研究が非常に盛んに進められている 1)。
本総説では、幹細胞や再生細胞を簡便に高効率に標識し、移植後の幹細胞や再生細胞の生体内動態を蛍光イメージングで検出可能な超低毒性量子ドット Fluclair™ 試薬の開発経緯について紹介する。
再生医療実現への重要課題
再生医療においては、移植した幹細胞や再生細胞の患部への生着が治療効果に大きく反映されるため、移植細胞の生体内動態、組織・臓器への集積・生着効率を正確に診断することが、安全性や治療効果を高める上で極めて重要となる。そのため、再生医療の実現に向けては、生体イメージングによる画像診断技術が果たす役割は非常に大きい。しかし、移植細胞を生体内で高感度に検出して診断するための細胞イメージング手法の確立は十分ではないのが現状である。そのような現状において、注目を集めているのが蛍光イメージングである 2)。
蛍光イメージングは細胞レベルからの高感度イメージングが可能であり、細胞移植治療を基盤とする現在の再生医療の発展にも大きく貢献すると期待されている。蛍光イメージングを実現する上で重要となるのが蛍光プローブであるが、従来からの有機蛍光色素や蛍光タンパク質(GFP など)は安定性や蛍光強度の問題があり、適用が困難であった。
我々は、超高精細、超高感度、超長寿命、省エネ、低コストを実現し、4K、8K ディスプレイ材料として産業応用されている量子ドットに注目し、研究を進めてきた。しかし、量子ドットの幹細胞や再生細胞に対する簡便且つ高効率な標識方法に加え、一般的な量子ドットはカドミウムなどを含むことから、幹細胞や再生細胞に対する毒性の問題があった。従って、量子ドットを再生医療の研究に広く利用可能とするためには、簡便且つ高効率な標識手法の確立と超低毒性量子ドットを開発する必要があった 3)。
量子ドットによる幹細胞標識手法
量子ドットによる幹細胞ラベリングは、細胞表面に量子ドットを結合させる方法、もしくは細胞内に導入する方法に大別される。我々は、長期間の安定的なイメージングを可能にするため、幹細胞内に量子ドットを導入してラベリングする手法を選択して検討を進めてきた。
導入する方法としては、物理的や化学的手法が想定されるが、物理的手法であるエレクトロポレーションによる導入では、導入条件下において多くの幹細胞が死滅するのを確認し、利用が難しいことが分かった。化学的手法であり、細胞膜透過性が認められている正電荷のリポソームや膜透過性ペプチド(Cell Penetrating Peptide : CPP)による導入では、負電荷を有する量子ドットと最適比で混合し、それらを細胞培養液に添加するだけで、簡便に導入されることを確認した。CPP は、プラスに帯電したアミノ酸であるアルギニン、リジンを主に含むペプチド鎖であり、ヒト免疫不全ウイルス 1 型由来のペプチド(TAT)や単純ヘルペスウイルス由来のペプチド(VP22)などが良く知られている。
今回富士フイルム和光純薬から発売される幹細胞標識用超低毒性量子ドット Fluclair™ 試薬では、合成した CPP を最適濃度に調製しており、量子ドット試薬と混合するだけですぐに利用できるように設計されている 4)。
Fluclair™ 試薬の開発
我々は幹細胞や再生細胞に使用できるカドミウムなどを含まない超低毒性量子ドットの開発を進めた。具体的には、これまで開発を進めてきた銀(Ag)、インジウム(In)、亜鉛(Zn)、硫黄(S)から構成される ZnS-ZAIS 量子ドットの表面に 5)、カルボキシル基を導入することで新たに水溶性を付与した ZnS-ZAIS-COOH(Fluclair™)量子ドットの開発に成功した(図 1-a)6)。
なお、Fluclair™ 量子ドットは Ag、In、Zn、S の構成比を変えることで自在に蛍光波長を制御することが可能であり、先ずは 3 種類の Fluclair™ (Fluclair™ Green(緑色蛍光:525nm)、Fluclair™ Yellow(黄色蛍光:565nm)、Fluclair™ Red(赤色蛍光:670nm))が発売される(図 1-b)。
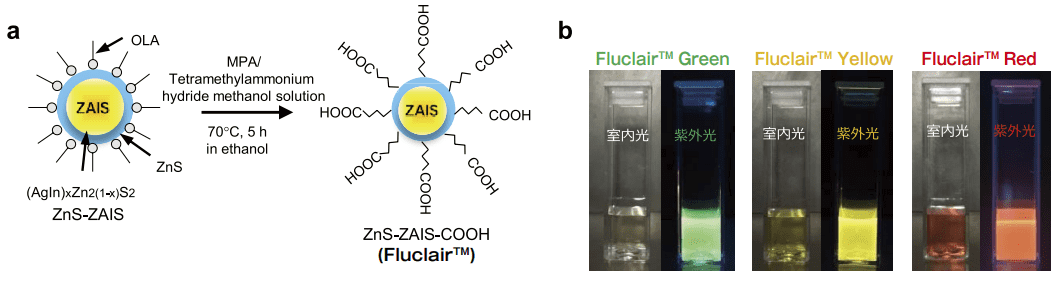
図1.Fluclair™ 量子ドットの合成方法と PBS 中における蛍光写真
量子ドットは非常に優れた蛍光特性を示し、バイオイメージングに応用が期待されてきたが、殊に細胞導入に関しては技術構築が必要であり、利用が制限されてきた。しかし、Fluclair™ 量子ドットによる幹細胞や再生細胞の蛍光標識は極めて簡便に実施可能であることを確認した。Fluclair™ 量子ドットと CPP を最適比で混合した後、15 分間静置させたものを幹細胞(今回は脂肪組織由来幹細胞(ASCs)を使用)に添加するだけで標識が可能であった(図 2-a)。
導入機構は主にエンドサイトーシス機構であり、添加 1 時間後から導入が認められるが、一晩静置させることで更に高効率に標識されることを確認した。導入された Fluclair™ 量子ドットは細胞膜を透過した後、核内には移行されず、細胞質内で安定に存在することを確認した(図 2-b)。
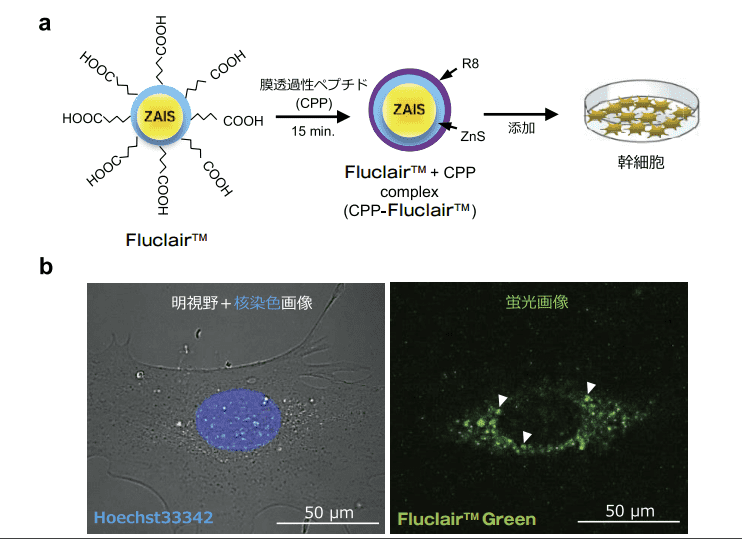
図2.Fluclair™ 量子ドットの細胞導入方法と Fluclair™ 標識 ASCs 蛍光画像
また、量子ドットの幹細胞や再生細胞への標識において非常に重要な評価項目である細胞毒性を ASCs を用いて評価した。最も代表的なカドミウムを含むコア・シェル型 CdSe/ZnS 量子ドット(CdSe/ZnS QDs)では、24 nM 以上の濃度で標識すると ASCs の生存率が有意差を持って減少することを認めた(図 3-a)7)。しかし、Fluclair™ 量子ドットでは、少なくとも 500 nM の濃度まで ASCs の生存率への影響を認めず(図 3-b)、更に、毒性が認められない濃度範囲では、ASCs の自己増殖能、多分化能に影響を及ぼさないことも確認した 6)。
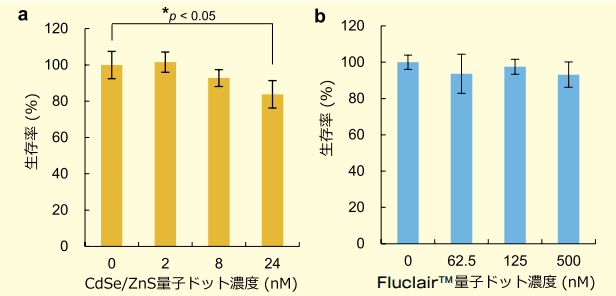
図3.CdSe/ZnS 及び Fluclair™ 量子ドットの ASCs に対する細胞毒性
これまでの研究結果から、細胞毒性に及ぼす量子ドット濃度は幹細胞の種類によって大きく異なる結果を認めておらず、Fluclair™ 量子ドットは幹細胞に対して超低毒性であり、極めて安全であることが示唆された。
Fluclair™ 試薬の利用 -移植幹細胞 in vivo 蛍光イメージング-
我々は、Fluclair™ 量子ドットを用いて、移植幹細胞 in vivo 蛍光イメージングに取り組んだ。先ず始めに、上記の方法で標識した C57BL/6 マウス由来 ASCs を脱毛処理した同系 C57BL/6 マウスの背中 6 か所に皮下移植した。移植直後に in vivo 蛍光イメージングシステム(IVIS LuminaK Series III)を用いて観察したところ、移植した ASCs 由来の蛍光を認め、移植細胞数に依存した蛍光強度の検出に成功した(図 4-a)6)。
次に、Fluclair™ 量子ドット標識した ASCs を同系 C57BL/6 マウスの尾静脈に移植した。移植された ASCs は、10 分後には肺及び肝臓に集積することを確認した。主要な 5 臓器(心臓、肺、肝臓、脾臓、腎臓)を切除して取り出し、in vivo 蛍光イメージングシステム(IVIS LuminaL Series III)を用いて観察しても、他の臓器への集積は認められず、移植された ASCs は、主に肺、肝臓に集積していることを確認した(図 4-b)6,8)。
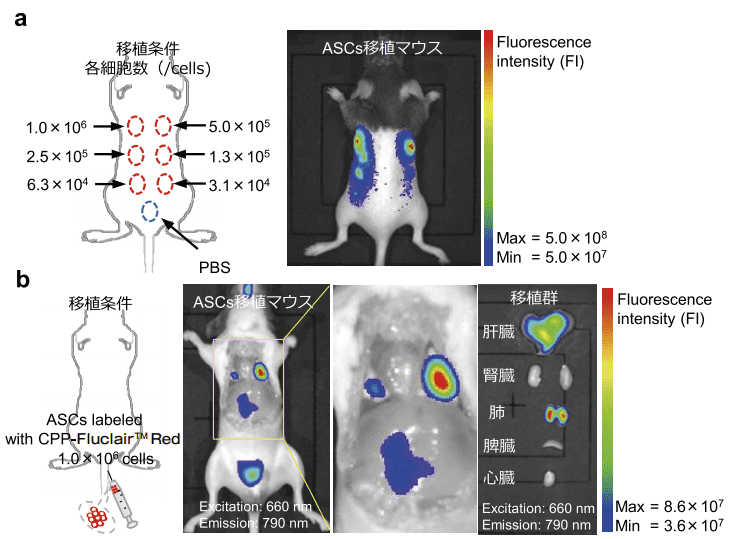
図4.Fluclair™ 量子ドット標識 ASCs のin vivo蛍光イメージング
更に、多光子励起レーザー励起顕微鏡を用いて、各組織・臓器内の移植 ASCs の 1 細胞観察を実施した。各組織・臓器の血管内皮細胞は Alexa Flour 488(緑色蛍光)で染色した。その結果、いずれも血管内皮細胞に接着するような状態で集積しているものの、両臓器間において ASCs の集積状態に違いが認められ、肺では比較的集団で ASCs が集積しているのを認めたのに対し、肝臓では ASCs のほとんどが 1 細胞状態で集積しているのを確認した。また、3D 画像より組織・臓器内での分布についての情報を取得することにも成功した(図 5-a, b)6)。
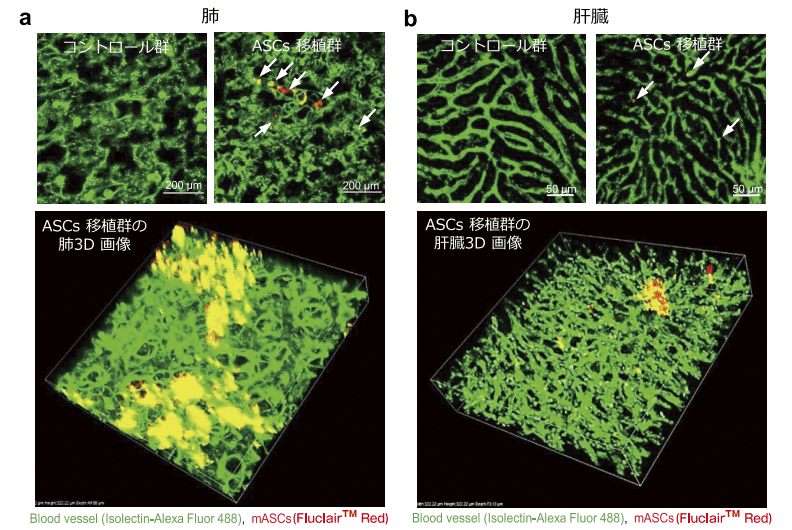
図5.Fluclair™ 量子ドット標識 ASCs の組織・臓器内 1 細胞蛍光イメージング
このように、移植細胞の in vivo 蛍光イメージングに Fluclair™ 試薬が有用であることを確認している。
おわりに
我々は、Fluclair™ 量子ドットを用いて、移植幹細胞 in vivo 蛍光イメージングに取り組んだ。冒頭にも述べたように、再生医療研究においては、移植幹細胞や再生細胞の生体内での挙動や集積・生着に関する解析・分析が非常に重要となっている。その中で、今回紹介した in vivo 蛍光イメージングに応用が期待できる幹細胞標識用超低毒性量子ドット Fluclair™ 試薬は非常に有効なツールの一つとして利用頂けると期待される。
量子ドットは他の蛍光分子と比較して優れた蛍光特性を有しており、その特性は in vivo 蛍光イメージングへの応用において、特に発揮されるものと考えられる。また、本試薬は量子ドットのバイオ応用にスムーズに展開できるように設計されているため、これまで量子ドットの使用経験が乏しい研究者の方々にも、非常に簡便に使用頂ける仕様となっている。更に、本試薬は幹細胞以外の細胞にも応用が可能であると期待され、他の細胞治療研究を進める研究者の方にも広くご利用頂ければと考えている。
参考文献
- 湯川博、馬場嘉信:Drug Delivery System, 31, 135 (2016). DOI: 10.2745/dds.31.135
- 湯川博、馬場嘉信:Organ Biology, 24, 201 (2017). DOI: 10.11378/organbio.24.201
- Onoshima, D., Yukawa, H. and Baba, Y. : Adv. Drug Deli. Rev., 95, 2 (2015). DOI: 10.1016/j.addr.2015.08.004
- Yukawa, H. and Baba, Y. : Anal. Chem., 89, 2671 (2017). DOI: 10.1021/acs.analchem.6b04763
- Torimoto, T., Adachi, T., Okazaki, K., Sakuraoka, M., Shibayama, T., Ohtani, B., Kudo, A. and Kuwabata, S. : J. Am. Chem. Soc., 129, 12388 (2007). DOI: 10.1021/ja0750470
- Ogihara, Y., Yukawa, H., Kameyama, T., Nishi, H., Onoshima, D., Ishikawa, T., Torimoto, T. and Baba, Y. : Sci. Rep., 7, 40047 (2017). DOI: 10.1038/srep40047
- Yukawa, H., Kagami, Y., Watanabe, M., Oishi, K., Kaji, N., Okamoto, Y., Tokeshi, M., Noguchi, H., Ono, K., Miyamoto, Y., Baba, Y., Hamajima, N. and Hayashi, S. : Biomaterials, 31, 4094 (2010). DOI: 10.1016/j.biomaterials.2010.01.134
- Yukawa, H., Watanabe, M., Kaji, N., Okamoto, Y., Tokeshi, M., Miyamoto, Y., Noguchi, H., Baba, Y. and Hayashi, S. : Biomaterials , 33, 2177 (2012). DOI: 10.1016/j.biomaterials.2011.12.009
キーワード
量子ドット
半導体や金属などの結晶サイズが直径 20 nm 以下のナノ材料である。この大きさになると電子が限られた領域に閉じ込められた状態になることにより量子サイズ効果を示すようになる。この効果により、高量子収率、高輝度、高安定性、蛍光色制御の容易性といった蛍光特性を有する。
幹細胞
自己複製能と多分化能の 2 つの能力を有する細胞として定義されている。幹細胞には、我々の体に備わる体性幹細胞(骨髄、脂肪由来幹細胞など)や胚性幹細胞(iPS 細胞、ES 細胞など)があり、対象とする組織・臓器や疾患の種類によって、それぞれ使い分けられている。
再生細胞
iPS 細胞や体性幹細胞から分化誘導されて獲得された分化細胞のこと。





