【総説】non-neuronal AChシステム誘導薬
本記事は、和光純薬時報 Vol.90 No.4(2022年10月号)において、日本医科大学 化学教室 中村 成夫様、生体統御科学分野 柿沼 由彦様に執筆いただいたものです。
はじめに
本化合物S -Nitroso-N -pivaloyl-D-penicillamine(SNPiP) は、既存のNOドナーであるS -Nitroso-N -acetyl-DL-penicillamine (SNAP) の基本骨格を参考に作製したものであり、心臓におけるnon-neuronal cholinergicsystem(非神経性コリン作動系と訳され、神経由来のアセチルコリン(ACh)とは別の、非神経細胞自らが産生するAChを表す)1)をより活性化させる化合物として見出されたものである。
今回、このSNPiPを提供するに当たり、まだ馴染みの少ない、心臓におけるnon-neuronal cholinergic systemについて、これをnon-neuronal cardiaccholinergic system (NNCCS)と名付け、このシステムの紹介と、その活性化能をもつ化合物という意味でNNCCS誘導薬として、SNPiPの性質・特徴について説明したい。なお、本化合物は現在、日本医科大学より特許申請中(特願2020-49467 出願人:学校法人日本医科大学)である。
NNCCS とは何か
心臓心筋細胞が自ら所有しているACh産生システムがNNCCSである1, 2, 3)。このシステムは心筋細胞にとって不可欠なものであり、以下の生理機能が明らかとなっている。
①心筋細胞のミトコンドリア機能亢進時に、より大量に暴露される活性酸素(ROS)から心筋細胞自らを守る機能1, 3, 4)、②心筋細胞におけるグルコーストランスポーター4蛋白発現を亢進させ、心筋細胞のエネルギー基質指向性を、よりグルコースに傾斜させる機能5)、③非低酸素状 況下であってもHIF-1α蛋白レベルを増加させ、その調節下流遺伝子群の中の血管新生促進因子遺伝子発現を亢進することで、血管新生を促進する機能5, 6)、④ギャップ結合機能構成蛋白であるコネキシン43の低酸素による分解を抑制し、ギャップ結合機能を維持する機能4, 7)、等である。
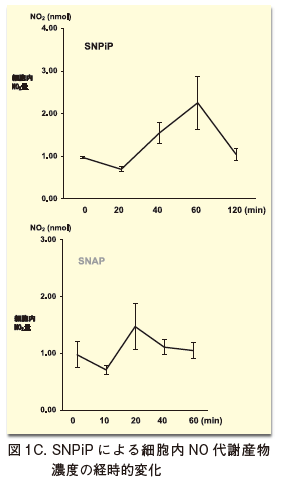
以上の結果は、このNNCCSを亢進またはノックダウンさせたin vitro /in vivo 研究結果から明らかになっている4, 5, 8)。特に、後者の心臓特異的NNCCSノックダウンマウスでは、NNCCS機能の50%以上の低下により心機能低下と同時に心不全マーカーの増加が認められた。心機能低下に随伴する表現型には、心臓NOS1によるNO産生障害・迷走神経活動低下・SOD活性低下によるROS産生増加、さらに解糖系からTCAサイクルへのピルビン酸流入移行障害・脂肪酸代謝障害等の心筋代謝障害を伴い、NNCCSが心筋代謝・NO産生等に深く影響していることが示唆されている8)。
また一方で、NNCCS機能亢進マウスでは心筋梗塞後慢性期の生存率が野生型の2倍以上の93%と驚異の虚血耐性を示し、その一つの要因として血管新生促進が顕著に認められた5)。以上の互いに相補する表現型から、本NNCCSを亢進させる介入方法は虚血性心疾患治療戦略上有意義な選択肢の一つであることが示唆された。
SNPiP の発見にいたる背景
これまでの先行研究を基盤とし、虚血耐性能を亢進させるためには転写因子HIF-1αを最終的に誘導(その蛋白レベルを増加させる)することが必要と考えられるが、それには低酸素または非低酸素誘導経路の2種類が報告されている。
外的環境が低酸素状態になることで、それへの適応としてHIF-1α蛋白レベルを増加させるのが前者であり、一方、低酸素に起因せずにHIF-1αの蛋白レベルを増加させるのが後者である6)。後者には種々の因子が含まれ、その一つとして一酸化窒素(NO)が報告されている9)。
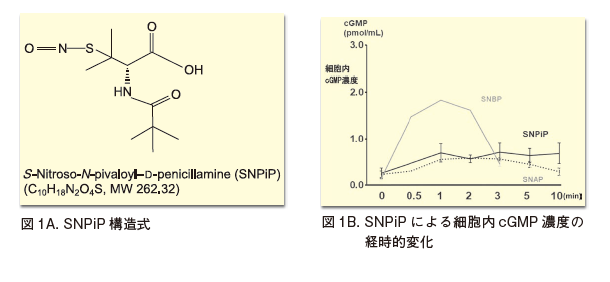
NOドナーとして知られる低分子化合物SNAPにコリンアセチルトランスフェラーゼ(ChAT)蛋白発現亢進機能があることを予備実験で確認後、それをリファレンスとして、SNAP基本骨格をベースに側鎖を修飾させ、我々はよりChAT蛋白発現亢進能の高い化合物をスクリーニングしSNPiPを得ることができた(図1A)10)。
しかし、このスクリーニングでの留意するポイントとして、個体レベルへの投与を想定し、その血行動態への影響を最小限に抑えるため、HEK293細胞における細胞内cGMP濃度(図1B)、細胞内NO2濃度(図1C)のタイムコースがより緩徐に変化することを念頭に、つまりピーク到達時間がより緩徐であることを基準として検討した10)。なぜなら急激なNO産生は血圧低下・反射性頻脈を惹起する可能性が懸念されるからである。
SNPiP の合成
SNAPはS -ニトロソチオールの中では化学的に極めて安定であり(通常のS -ニトロソチオールは数秒から数分で分解するものが多い)、溶液中では徐々にNOを放出することから前述のようにNOドナーとして知られている。
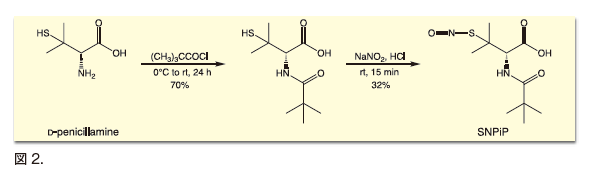
SNAPはN -acetyl-DL-penicillamineに亜硝酸ナトリウムを反応させることにより合成される11)。SNPiPの場合も同様に、D-Penicillamineを塩化ピバロイルでN -pivaloyl-D-penicillamineにした後、亜硝酸ナトリウムでS -ニトロソ化して合成した( 図2)。
SNPiPはSNAPのアセチル基をピバロイル基に変換したものであるが、SNPiPもSNAPと同様に結晶状態では極めて安定である。ピバロイル基はアセチル基に比べて嵩高く、また脂溶性も高いため、SNPiPはSNAPとは異なる薬理効果を発現したと思われる。
SNPiP の薬理効果
SNPiPは脂溶性が高く水には難溶性である。したがって、通常DMSO(propylene glycolでも溶解可能である)にて易溶性である10)。
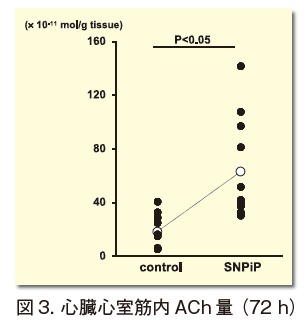
1) SNPiP溶液(1 nmol)をC57BL6/J雄成獣マウスの腹腔または経静脈的に投与すると、心房を切除した心臓心室筋でのChAT蛋白発現レベルの増大と心臓心室筋内ACh産生量が増大する(図3)。その応答は緩徐で投与後48-72時間後が顕著である。すなわちNNCCSの機能亢進が認められる。
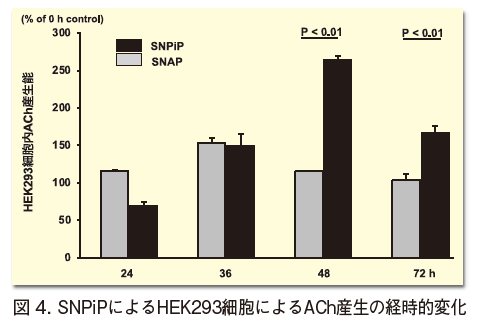
この特徴的効果はin vitro 細胞レベルでも認められ、心筋細胞のみに限らず、少なくとも細胞内ACh産生能を保持する細胞(例えばHEK293細胞)では、細胞内ACh産生能は亢進され、その効果のピークは緩徐で48時間以降に認められる(図4)10)。
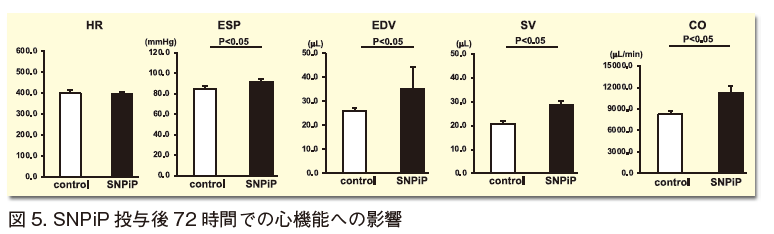
2) SNPiPのC57BL6/J雄成獣マウスへの投与(腹腔または経静脈)24時間後から薬理効果が認められ、48-72時間後により心機能亢進が惹起され、最終的に心拍出量が増大する。しかし、この時心拍数への影響は極めて少ない。SNPiPの心拍出量増大効果は、したがって、拡張末期容積量の増大つまり一回拍出量の増大に起因する(図5)。その結果として心拍出量が非投与群よりも増大することになる。すなわちSNPiPの特徴的機能は、これまでにない心臓拡張能を亢進させる点であると考えられる10)。
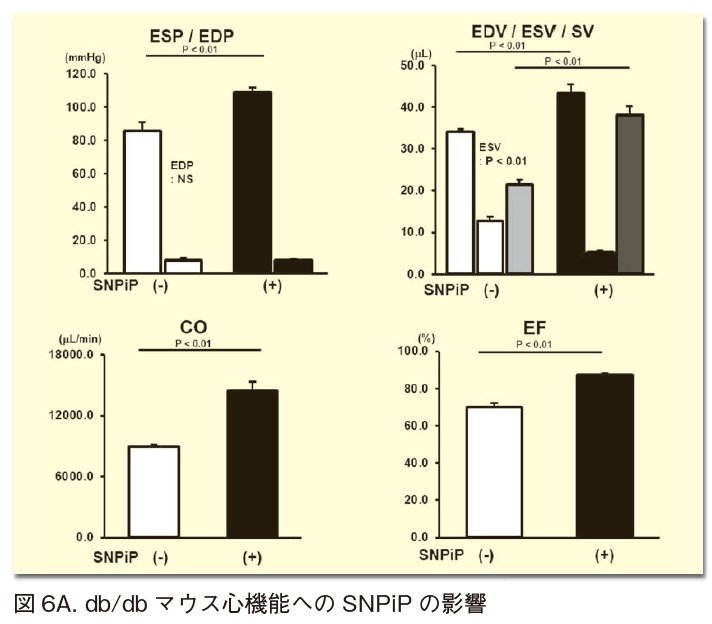
3) この心臓拡張能亢進効果によって、心臓拡張能障害を主病態とするdb/dbマウス心機能障害に対してSNPiPの効果の有無を検討したところ、肥満・高血糖を呈する心臓拡張能低下を伴うdb/dbマウスにおいても、SNPiPはより心臓拡張能を是正し心拍出量を増大させることが認められている(図6A)12)。
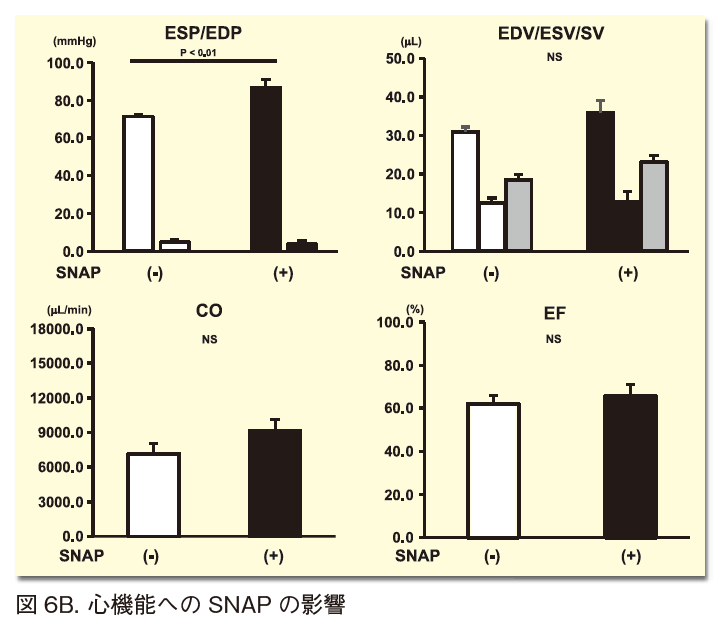
以上のSNPiPの効果はすべて対照群であるSNAPと比較して、有意差をもって顕著である。なぜなら、SNAP投与時の細胞レベルのACh産生量はSNPiPと比較し、その量は低く早期に応答するため持続性がより低いことが明らかとなっている(図4)12)。さらに、C57BL6/Jマウスにおける心臓拡張能の比較では、SNAPはより拡張能亢進能が劣っており、SNPiPに顕著な一回拍出量増加あるいは拡張末期容積量増加はSNAPでは認められず、したがって有意な心拍出量の増大もSNAPでは認められていない(図6B)12)。
まとめ
以上から、SNPiPはNOドナーとしての性格を持ちつつも、細胞レベルでのACh産生能を亢進させ、その結果NNCCSを活性化させ心室でのACh産生を増大させた。それにより心臓拡張能を亢進させる特異的な機能を持つ化合物であることが示唆された。このような心臓拡張機能をもつ化合物の報告は循環器領域においてはなく、薬効分類においてもユニークなものと考えられる。現在、他の薬理効果についてはさらに解析進行中であり、今後新たな効能の追加が期待される。
参考文献
- Kakinuma, Y., Akiyama, T. and Sato, T. :FEBS J ., 276, 5111( 2009).
- Rana, O. R., Schauerte, P., Kluttig, R.,Schröder, J. W., Koenen, R. R., Weber, C.,Nolte, K. W., Weis, J., Hoff mann, R., Marx, N.and Saygili, E. : Auton. Neurosci ., 156, 82(2010).
- Rocha-Resende, C., Roy, A., Resende, R.,Ladeira, M. S., Lara, A., de Morais Gomes, E.R., Prado, V. F., Gros, R., Guatimosim, C.,Prado, M. A. and Guatimosim, S. : J. Mol.Cell. Cardiol ., 53, 206( 2012)
- Kakinuma, Y., Akiyama, T., Okazaki, K.,Arikawa, M., Noguchi, T. and Sato, T. :PLoS One , 7, e50761( 2012).
- Kakinuma, Y., Tsuda, M., Okazaki, K.,Akiyama, T., Arikawa, M., Noguchi, T. andSato, T. : J. Am. Heart Assoc ., 2, e004887(2013).
- Kakinuma, Y., Ando, M., Kuwabara, M.,Katare, R. G., Okudela, K., Kobayashi, M.and Sato, T. : FEBS Lett ., 579, 2111( 2005).
- Zhang, Y., Kakinuma, Y., Ando, M., Katare,R. G., Yamasaki, F., Sugiura, T. and Sato, T. :J. Pharmacol. Sci ., 101, 214( 2006).
- Oikawa, S., Kai, Y., Mano, A., Ohata, H.,Kurabayashi, A., Tsuda, M. and Kakinuma,Y. : J. Physiol. Sci ., 71, 2( 2021).
- Kuwabara, M., Kakinuma, Y., Ando, M.,Katare, R. G., Yamasaki, F., Doi, Y. and Sato,T. : J. Physiol. Sci ., 56, 95( 2006).
- Oikawa, S., Kai, Y., Mano, A., Nakamura, S.and Kakinuma, Y. : Cell. Physiol. Biochem .,52, 922( 2019).
- Field, L., Dilts, R. V., Ravichandran, R.,Lenhert, P. G. and Carnahan, G. E. : J. Chem.Soc. Chem. Commun ., 249( 1978).
- Oikawa, S., Kai, Y., Mano, A., Nakamura, S.and Kakinuma, Y. : Int. Immunopharmacol .,84, 106459( 2020)




