【総説】細胞外小胞の臨床プロテオミクス解析 -血液を巡る細胞外小胞の多検体自動精製技術の開発-
本記事は、和光純薬時報 Vol.90 No.2(2022年4月号)において、医薬基盤・健康・栄養研究所 プロテオームリサーチプロジェクト 村岡 賢様、足立 淳様に執筆いただいたものです。
はじめに
近年、がん、神経疾患、心血管疾患、感染症など様々な医学研究分野において、細胞外小胞の研究が進められている。細胞外小胞は、タンパク質、核酸や脂質などを内包しており、これらの構成成分が細胞や疾患ごとに違いを示し、様々な機能を持ち疾患の病態変化に大きく影響を与えていることが知られている。そのため、血液などから採取した細胞外小胞は、病気の早期発見、モニタリング、薬効効果などのバイオマーカーを含むのではないかと期待されている。
本稿では、筆者が現在までに行ってきた神経変性疾患における細胞外小胞の機能解析とバイオマーカー探索、大規模なプロテオミクス解析に向けた血液由来細胞外小胞の多検体自動精製技術について紹介する。
細胞外小胞
細胞外小胞は、様々な組織、細胞により分泌される脂質二重膜で囲まれた膜小胞の総称であり、分泌経路、生合成、サイズの違いから、多胞体と細胞膜が融合し細胞外へ分泌されるエクソソーム(40-200nm)、細胞膜から直接出芽し細胞外へ分泌されるマイクロベシクル(200-1000nm)、アポトーシスを起こした細胞から分泌されるアポトーシス小胞(1000-5000nm)に分類されている。細胞外小胞は血液、尿、唾液、脳脊髄液などの体液中で観察され、様々なタンパク質、核酸、脂質などが含まれており、細胞間の情報伝達に重要であることが報告されている1)。
近年、悪性腫瘍、炎症性疾患や神経疾患などの疾患との関連性が数多く報告されており、疾患の診断、予後予測のバイオマーカー探索、治療への応用研究に期待が集まっている2)。また、血液中の細胞外小胞を用いた診断は、低侵襲的であることから継続的な観察において患者の負担が軽減され、疾患の変化を捉えることができるため開発が急がれている。
神経変性疾患における細胞外小胞
加齢にともないリスクが高くなる神経変性疾患は、高齢化が進む日本において、目を背けることができない疾患の一つとなっている。アルツハイマー病、筋萎縮性側索硬化症、パーキンソン病を含む神経変性疾患における細胞外小胞の役割についての研究は、ここ10年ほどで目覚ましい進展が見られた。
2006年にRajendranらによりアルツハイマー疾患の原因因子の一つであるアミロイドベータが細胞外小胞の内外に存在すること、細胞外小胞の特異的タンパク質であるALIXがアルツハイマー患者の脳内のアミロイド斑に存在することが報告された3)。2012年にはSamanらによってもう一つの原因因子であるタウタンパク質の過剰発現細胞由来の細胞外小胞にタウタンパク質が内包されていることが確認された4)。
筆者は、アルツハイマー病疾患の脳組織由来の細胞外小胞に内包されているタウタンパク質は、凝集体の形成に重要であるSerine396のリン酸化(pS396 tau)が確認され、コントロール群と比較して有意に上昇していることを見出した(図1a, b)5)。更には、それらのタウタンパク質はオリゴマーを形成した状態で細胞外小胞に内包されていることが確認され、マウス、細胞の実験でタウの凝集、伝播のためのseed(種)として細胞外小胞と共に重要な機能を持つことを報告した6)。
また、アルツハイマー病の脳組織由来(スクロース濃度勾配遠心法)、脳脊髄液由来(MagCapture™ Exosome Isolation Kit PS;富士フイルム和光純薬、293-77601)の細胞外小胞のプロテオミクス解析によりANXA5、PTGFRNがコントロール群と比較して発現が上昇していることを示した(図1c, d, e)5, 7)。
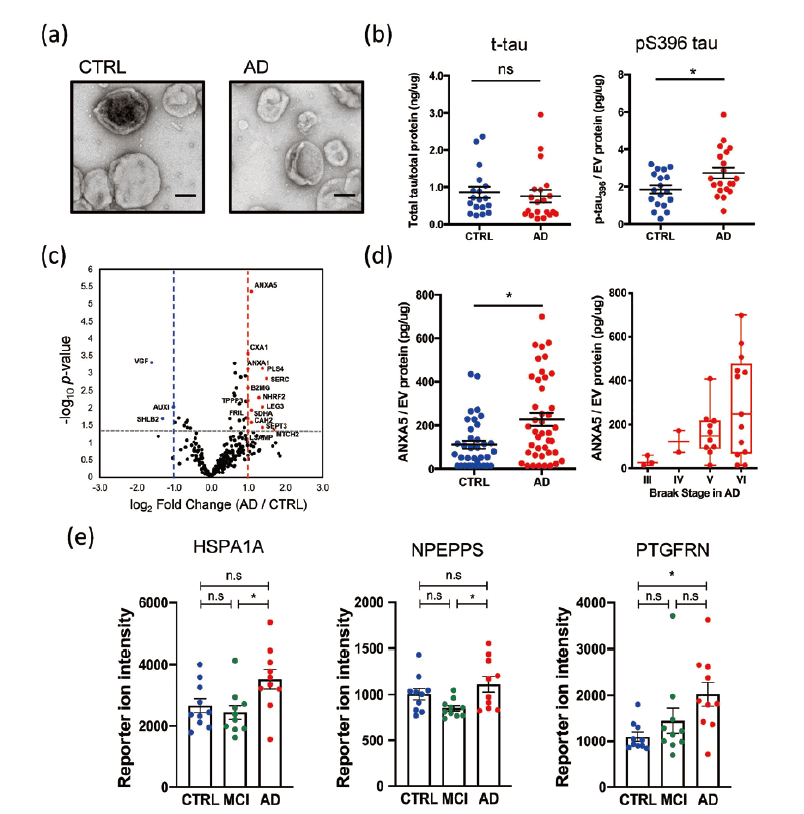
図1.神経変性疾患における細胞外小胞の機能とバイオマーカー開発
(a)透過型電子顕微鏡による細胞外小胞 (b)細胞外小胞の内外に存在するタウ、リン酸化タウ (c)プロテオーム解析によるタンパク質の発現比較 (d)アルツハイマー疾患脳組織由来細胞外小胞のANXA5 の発現上昇 (e)脳脊髄液由来細胞外小胞のバイオマーカー候補タンパク質CTRL:健常者 MCI:軽度認知障害 AD:アルツハイマー認知症 *:p < 0.05
脳髄液は疾患をモニタリングするには最適であるが、脳髄液をその都度採取するのは患者への負担が大きく、侵襲性が低い血液による検査が望まれている。そこで筆者らは、多検体の血液サンプルの細胞外小胞を用いて候補タンパク質を解析、評価することを考え、多検体の処理が可能でかつ、人為的ブレをなくすために、体液由来の細胞外小胞を自動精製可能な技術開発を行った。
血清・血漿由来細胞外小胞の自動精製技術開発
細胞外小胞が体液中に多数含まれており、由来する細胞の変化を包含していると考えられることから、大規模な臨床検体を用いた細胞外小胞のタンパク質の網羅的プロテオミクス解析が盛んに行われている。血液から細胞外小胞を濃縮する方法は、遠心を組み合わせる方法や、平衡密度勾配遠心法、サイズ排除クロマトグラフィー法、親和性を利用した精製法など数多くの方法が報告されている8)。
細胞外小胞を単離する方法によって、単離される細胞外小胞は異なり、また、夾雑物が含まれる割合も異なることから、純度の高い細胞外小胞の精製方法、及び精製方法の標準化も必要となっている。その中でも細胞外小胞のホスファチジルセリンと高い親和性を示すTim4タンパク質を介して精製する方法は、他の方法と比較しても夾雑物を最小限に抑制して高純度に濃縮することができる9, 10)。
細胞外小胞を高純度で精製、濃縮することは、タンパク質のダイナミックレンジを低くすることができ、プロテオミクス解析において微量なタンパク質の同定・定量を可能とする。また、大規模な臨床検体をプロテオミクス解析するためには、再現性高く精製するシステムの開発が重要となる。
筆者らは、96検体の血清、血漿を96ウェルプレート用加圧送液プロセッサーによりfiltrationの前処理を行い、KingFisher Flex向けにアレンジしたMagCapture™ Exosome Isolation Kit PSにより96検体を一度に精製する自動精製技術の開発に成功した(図2)。
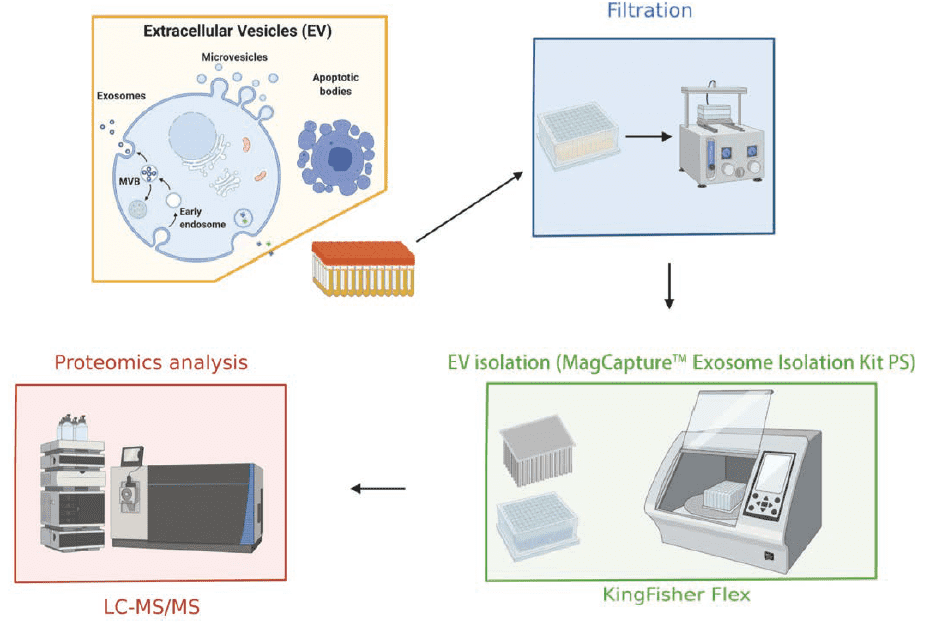
図2.MagCapture™ Exosome Isolation Kit PS を用いた細胞外小胞の自動精製技術開発
血清・血漿細胞外小胞のプロテオミクス解析
筆者らは、自動精製技術により精製した細胞外小胞の網羅的プロテオミクス解析を行ったところ、手動精製と比較して自動精製技術では、サンプル間のブレを低く抑えられること、細胞外小胞マーカーのイオン強度が上昇する一方で、血液タンパク質であるアポリポプロテインBのイオン強度が大幅に減少していることを確認した(図3a)。
臨床検体を用いた解析では、細胞外小胞マーカーを含む4079種類のタンパク質の同定に成功し、血清、血漿由来の細胞外小胞にはいくつかのタンパク質で定量値に大きな違いが見られた(図3b)11)。評価するタンパク質において血清、血漿のどちらを選択すべきか目的に応じて議論が必要である。
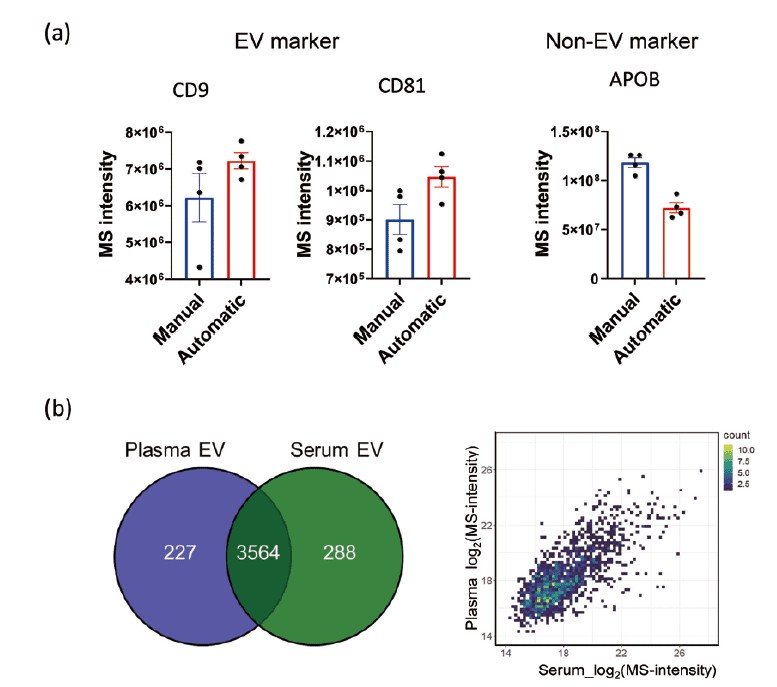
図3.自動精製した血清、血漿由来細胞外小胞のプロテオミクス解析
(a) 手動・自動精製した細胞外小胞のマーカー比較 (b) 血清、血漿由来細胞外小胞のプロテオーム解析の結果現在は、自動精製技術を用いて、大規模な臨床検体のプロテオミクス解析を行っており、脳組織由来の細胞外小胞特異的マーカータンパク質候補の同定に成功している11)。
おわりに
リキッドバイオプシーは、血液や尿を含む体液中でがん、変性疾患、感染症などの検出やモニタリングができると期待される検査方法であり、細胞外小胞のリキッドバイオプシーへの応用が期待されており、研究開発が益々盛んになることが予測される。血液の細胞外小胞のプロテオミクス解析は、マーカーの探索だけではなく病態の機能解明にも役立つことが期待され、大規模な臨床検体を解析することは非常に重要となる。
我々が開発した自動精製技術は一度に多検体処理が可能であり、再現性に優れ、血液中のタンパク質のコンタミネーションも抑えることが確認されている。さらに、現在はプロテオミクス解析のための前処理の自動化にも成功しており(論文投稿中)、疾患のバイオマーカー探索、診断キットの開発に大きく貢献することが期待される。
謝辞
神経変性疾患の細胞外小胞の研究は、ボストン大学(現Mayo clinic)の池津庸哉先生の下で行った研究であり、細胞外小胞の自動化精製については富士フイルム和光純薬株式会社の協力の下医薬基盤研究所にて進められたものである。この場を借りて、心からお礼申し上げます。
参考文献
- Kowal, J. et al. : Proc. Natl. Acad. Sci. U.S.A., 113, E968 (2016).
- Shiromizu, T. et al. : Sci. Rep., 7, 12782 (2017).
- Rajendran, L. et al. : Proc. Natl. Acad. Sci. U.S.A., 103, 11172 (2006).
- Saman, S. et al. : J. Biol. Chem., 287, 3842 (2012).
- Muraoka, S. et al. : Alzheimers Dement., 16, 896 (2020).
- Ruan, Z. et al. : Brain, 21, 72 (2020).
- Muraoka, S. et al. : Cells, 9, 1959 (2020).
- Li, P. et al. : Theranostics, 7, 789 (2017).
- Nakai, W. et al. : Sci. Rep., 6, 33935 (2016).
- Muraoka, S. et al. : Methods, 177, 35 (2020).
- Muraoka, S. et al. : iScieuce, (2022) in press, DOI 10.1016/j.isci.2022.104012




