【連載】よくわかるBDNF -基礎から臨床まで-「第1回 BDNF概論」
本記事は、和光純薬時報 Vol.89 No.3(2021年7月号)において、新潟大学 脳研究所腫瘍病態学 武井 延之様に執筆いただいたものです。
「よくわかるBDNF ―基礎から臨床まで―」シリーズ開始にあたって
金沢工業大学 バイオ・化学部 応用バイオ学科 小島 正己
神経栄養因子研究は、Rita Levi-Montalcini博士、Stanley Cohen博士たちにより1950 年代に拓かれた。両氏によるNGF(nerve growth factor)の発見につづき、Yves-Alain Barde はBDNF(brain-derived neurotrophic factor)を発見した。BDNFとNGFの間には高い相同性があり生物活性も同様であった。BDNFは中枢で発現が高いことから、記憶・学習との関係、脳疾患との関係の研究に発展している。BDNFの寄与を知るためにはBDNF 測定技術は重要でありBDNFシグナルの解析技術も大切である。
本シリーズでは、最初にBDNF と神経栄養因子の研究を概要し、脳と発達、精神疾患との関係について、本邦の気鋭の研究者に、その現状と展望を存分に開陳いただくことになりました。どうぞご期待ください。
はじめに
BDNF研究は神経細胞の生存維持、分化誘導といった「古典的」作用に始まり、神経伝達、シナプス可塑性の制御という新たな作用へと展開されてきた。それに伴い、疾患との関係でも細胞死を伴う神経変性疾患への関与と治療への応用の試みから、神経機能異常(あるいは回路形成異常)と考えられる精神疾患や発達障害への関与や治療へと関心が変化してきている。図1に時系列に沿ったBDNF研究の流れを示し、本項ではBDNFの概略を解説する。
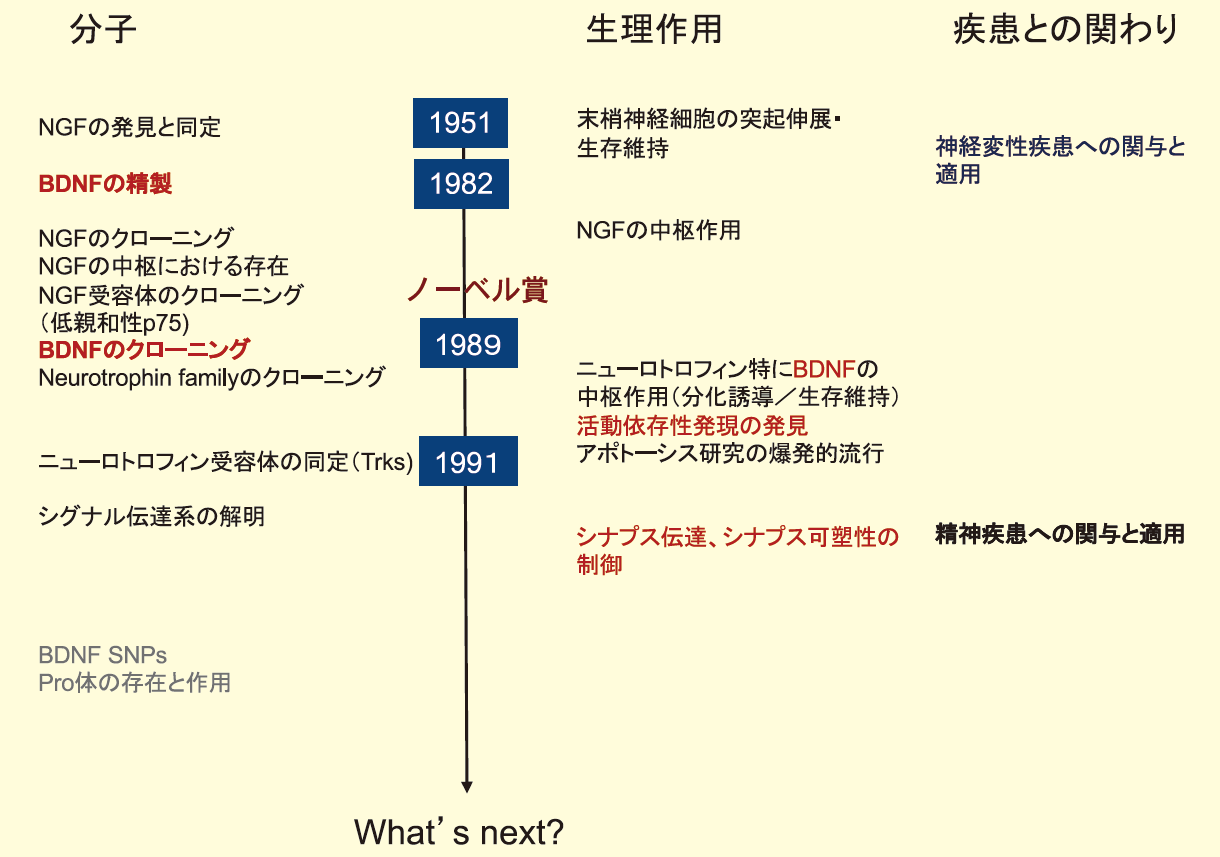
図1.BDNF(ニューロトロフィン)研究の歴史とトレンド
BDNFと受容体分子
BDNF(Brain-Derived Neurotrophic Factor : 脳由来神経栄養因子)は脳における最も主要な神経栄養因子である。神経栄養因子(neurotrophic factor)とは神経細胞の生存維持や分化誘導(突起伸展や神経伝達物質合成酵素発現誘導など)、成熟促進、機能調節などの働きを持つ蛋白分子の総称であり、Levi-MontalciniによるNGF(Nerve Growth Factor : 神経成長因子)の発見同定を端緒として研究が始まった。NGFは特定の神経細胞にしか効果を示さなかったため、他にも同様の働きをする分子が存在すると考えられた。
BDNFはBardeとThoenenによって1982年にブタ脳から精製された1)。その後1983年にNGFの、89年にBDNFのクローニング2)がなされ2つの分子は50%以上のホモロジーを示すことがわかった。この相同領域を利用して第3の因子NT-3がクローニングされ、その後第4の因子としてNT-4が同定された。NTはneurotrophinの略で、neurotrophin familyと呼ばれる。
BDNFはpreproBDNFからプロセッシングされ、matureBDNF( いわゆるBDNF)となる。BDNFは112アミノ酸残基からなり、分子量は13.5kDa、等電点は9.99でNGFと同様に分子内に3箇所のS-S結合がある。NGFの結晶構造解析から3つの平板なβシートを持ち、ここを介してホモ二量体を形成して生理作用を持つと考えられている。ファミリー間で保存されていないドメインが受容体との特異的結合を規定していると考えられる3)。
受容体はNGF結合実験の結果から低親和性と高親和性の2種類の受容体が示唆され、低親和性受容体はp75(あるいはp75NTR)として同定された。この分子は全てのneurotrophinと低親和性(Kd=10-9)で結合する。TNF受容体ファミリーに属し、アポトーシスに関与する。neurotrophinのpro体が作用する受容体として再び注目されている。1991年になって高親和性(Kd=10-11)の受容体が同定された。それがTrk(トラックと読む:Tropomyosin Receptor Kinase) で、もともとは癌で見出されたtrkプロトオンコジーンの遺伝子産物として同定されていたが、リガンドはわかっていなかった。
TrkはA、B、Cの三種あり、TrkA(遺伝子名 NTRK1)はNGFの、TrkB(NTRK2)はBDNFとNT-4の、TrkC(NTRK3)はNT-3の特異的受容体である。
TrkはA、B、Cともアミノ酸約800個からなり、糖鎖付加を受けて分子量140-145kDaの機能分子となる。受容体型チロシンキナーゼであり、細胞内にキナーゼドメインを持つ。二量体リガンドが結合するとTrk自体も二量体化し、細胞のチロシン残基を互いにリン酸化する。このリン酸化チロシンに種々の分子が結合し、細胞内にシグナルを伝達することによってBDNFをはじめとしたneurotrophinの生理活性が発揮される4)。細胞内の主要なシグナル系は受容体型チロシンキナーゼに共通で、1)アポトーシスや翻訳を制御するPI3K-Akt系、2)主に転写調節を通じ分化誘導などを担うRas-MAPK系、3)細胞内のカルシウムシグナルを駆動するPLCγ-Ca2+系がある5)。
BDNFの生理作用
BDNF研究も当初は末梢神経系における作用の研究が中心で、NGFは交感神経後根神経節の一部、BDNFは節状神経節の感覚神経と後根神経節の一部と互いに重複しない神経細胞に対して作用を示すことがわかった。末梢神経系に対するneurotrophinの作用は絶対的で、生存維持、突起進展に必須である。このため各ノックアウトマウスでは末梢神経不全のため致死となる。このような点から神経細胞の生存維持や突起伸展といった作用は神経栄養因子の「古典的作用」とも呼ばれる。
その後研究の中心は中枢神経系へと移り、NGFは大脳基底野のアセチルコリン作働性神経細胞に作用し、BDNFは黒質ドーパミン作働性神経細胞や脊髄運動神経細胞に作用することが明らかとなった。これらはやはり古典的作用で、各神経伝達物質の合成酵素の発現誘導や伝達物質量の増加、生存維持作用などが報告された。NGFとTrkAの発現は脳内では一部の細胞に限られていたが、BDNFと特にTrkBの発現は脳内の幅広い(ほぼ全ての)神経細胞で見られた。このこともあってBDNFの中枢神経細胞への作用がさらに広範に研究され、生存維持、分化誘導といった古典的作用の他に神経活動に依存した神経可塑性に関与することが明らかとなった。
神経可塑性とは、伝達物質放出や受容体機能の制御を通じた伝達効率の変化や、シナプスの再構成などにより特定の神経回路が強化されたり消去されたりする可逆的な変化のことである。形態的変化を必須とせず、転写、翻訳、分解の調節によってシナプスで働く分子の量的変化(特定の分子の数や分子の種類)、翻訳後修飾(リン酸化など)の変化、位置の変化(トランスロケーション)などによってもたらされる。BDNFは中枢神経細胞に対し、神経伝達物質の放出の誘起/増強や、受容体の機能増強を行うことが明らかとなり、長期的には神経回路の形成/安定化に作用していると考えられるようになってきた。その結果として学習記憶などに関与していると考えられる6, 7)。
BDNFの発現と放出
BDNFの発現は神経活動と密接に関係している。初代培養神経細胞をグルタミン酸で刺激するとBDNFmRNAの発現が大きく誘導され、GABA刺激によっては発現が低下した8)。BDNFは生理的条件下では神経細胞で発現していて、興奮性神経伝達によって上昇し、抑制性神経伝達によって低下する。BDNFの発現は記憶の細胞基盤と考えられている長期増強(LTP)でも誘導される。個体レベルでも感覚(視覚)入力に依存したBDNFmRNA発現レベルの変動が視覚野で観察されている。また学習訓練、習得によってラットやサルの脳でBDNFの発現が上昇することなどから、神経回路の活性化による活動依存的な発現誘導が明らかになった7)。
発現調節だけでなく、BDNFの放出もまた神経活動依存的である。従来の古典的作用では、BDNFに限らず神経栄養因子は構成的に分泌されると考えられていた。常に一定量供給されることが生存維持などでは合理的であるからである。しかし神経伝達に関与するような速い反応を引き起こすには調節的放出が必要である。実際BDNFは脱分極刺激に応答して放出される。末梢神経系におけるNGFの作用形態から、神経栄養因子は軸索の投射先である標的細胞によって産生・分泌され、神経細胞はそこに向かって軸索を伸ばすという作用形態が考えられていた。しかしBDNFはシナプス前部の小胞に含まれ、伝達物質と同じように刺激に応答して放出されている。このような発現・放出の機構も神経可塑性への関与を支持しており、神経活動とBDNFが相互に作用していることを示している9)。
BDNFと疾患
神経栄養因子の生存維持作用から、神経変性疾患への治療が試みられてきた。培養細胞や動物実験では非常に有効ではあるが、治験まで行った例でも成功していない10)。まず分子量の問題で、蛋白であるため血液脳関門を通過できないことが大きい。低分子アゴニストなども開発されているが、作用が確定しているとは言い難い。一方、BDNFが神経機能に直接関与することから、本特集でも取り上げられるように、機能性の脳疾患と言われる精神疾患や発達障害での役割に注目が集まっている。直接治療に用いることは上記の理由で難しいかもしれないが、バイオマーカーとしての役割や、BDNFの作用をミミックする薬剤の開発なども期待されている。
BDNFは中枢性の摂食抑制作用もあり11)、また何故か血小板に多く含まれ、調節的放出がなされている。このため肥満や生活習慣病とも言える糖尿病や心臓血管系疾患などとの関連も報告され、非中枢性作用も明らかにされ研究はさらに広がっている12)。
参考文献
- Barde, Y. A. et al. : EMBO. J., 1, 549 (1982).
- Leibrock, J. et al. : Nature, 14, 341149 (1989). DOI: 10.1038/341149a0
- Lewin, G. R. and Barde, Y. A. : Annu. Rev. Neurosci., 19, 289 (1996). DOI: 10.1146/annurev.ne.19.030196.001445
- 武井延之:脳科学辞典(2020).https://bsd.neuroinf.jp/wiki/高親和性ニューロトロフィン受容体,DOI:10.14931/bsd.9306(2021年6月21日閲覧)
- Huang, E. J. and Reichardt, L. F. : Annu. Rev. Biochem., 72, 609 (2003). DOI: 10.1146/annurev.biochem.72.121801.161629
- Thoenen, H. : Prog. Brain. Res., 128, 183 (2000). DOI: 10.1016/S0079-6123(00)28016-3
- 武井延之、那波宏之:生化学,76,111(2004).
- Lindholm, D. et al. : J. Neurobiol., 25, 1362 (1994). DOI: 10.1002/neu.480251105
- Nawa, H. and Takei, N. : Trends Neurosci., 24 (12), 683 (2001). DOI: 10.1016/s0166-2236(00)01955-x
- Thoenen, H. and Sendtner, M. : Nat. Neurosci., 1046 (2002). DOI: 10.1038/nn938
- Takei, N. et al. : Front Psychol., 5, 1093 (2014). DOI: 10.3389/fpsyg.2014.01093
- Marosi, K. and Mattson, M. P. : Trends. Endocrinol. Metab., 25, 89 (2014). DOI: 10.1016/j.tem.2013.10.006