【連載】微量元素分析 -さまざまな分野での活用事例とその重要性-「第1回 医薬品の元素不純物ガイドラインにおけるリスクアセスメント及び管理について」
本記事は、和光純薬時報 Vol.89 No.3(2021年7月号)において、株式会社 住化分析センター TS 本部 大阪ラボラトリー 物性特性 G 西岡 利奈様、花河 奏一郎様に執筆いただいたものです。

1.はじめに
医薬品中の元素不純物規制は、医薬品規制調和国際会議(ICH)にて元素不純物のガイドラインが作成され、日本においては平成27年9月30日付けで「医薬品の元素不純物ガイドラインについて」(薬食審査発0930第4号)として公報された。近年では第十七改正日本薬局方第二追補(令和元年6月28日 厚生労働省告示第49号)に、元素不純物ガイドラインの内容を踏まえた参考情報「製剤中の元素不純物の管理」が収載されている。さらに令和3年6月に告示された第十八改正にて、元素不純物管理の通則への追加、一般試験法の改正があった。次項にて改正点の概要を紹介する。
続いて本稿では、元素不純物の管理において重要な製品のリスクアセスメントとその手順について概略を解説する。また、リスクアセスメントのアプローチの一例を紹介する。
2.第十八改正日本薬局方の改正点
第十八改正では通則34に元素不純物管理の項目が新規収載され、日本薬局方の製剤は、原則として一般試験法の元素不純物に係る規定に従って適切に管理を行うという内容が追加された。製剤、原薬及び添加材などにおいて、告示施行後36箇月の間(令和6年6月まで)にガイドラインを踏まえた管理へ対応することが求められる。
試験法については、一般試験法「2.66 元素不純物試験法」と参考情報「製剤中の元素不純物の管理」を統合し改正された。内容については、ICH Q3D「医薬品の元素不純物ガイドラインの改正について」(令和2年6月26日付け薬生薬審査発0626第1号)におけるカドミウムの許容一日暴露量の見直しに伴う数値等の修正が反映されている。
ガイドラインの公表後36箇月を経過したことを鑑み、既存製剤も適用範囲に含まれることが決定しており、今後ますます元素不純物の評価・管理が重要視されている。
なお、ICHの元素不純物ガイドラインは新医薬品の製造販売承認申請に際して検討される新製剤に適用されるが、局方収載以外の医療用医薬品製剤については令和2年12月28日付けで「医療用医薬品に係る元素不純物の取扱いについて」(薬生薬審発1228第7号)により本ガイドライン通知が適用拡大され、同様の管理が求められている。
3.リスクアセスメント
元素不純物のリスクアセスメントのプロセスは次のステップで実施する。
特定
製剤の製造過程での元素不純物の混入源の特定
評価
製剤中の元素不純物につき実測値又は予測値と許容一日暴露量(PDE:permitted daily exposure)との比較により評価
まとめ
リスクアセスメントの結果を要約して文書化し、管理方法が十分であるか確認
さらに元素不純物を低減する追加の管理方法の必要性を検討
これらのステップを繰り返し行うことで、適切な管理方法の設定を行う。
3. 1.元素不純物の混入源の特定
製剤の製造過程において考えるべき元素不純物の潜在的な混入源には以下のものがある。
- 原薬、添加剤など製剤構成成分の製造時において意図的に添加された元素(触媒など)による残留不純物
- 原薬、水又は添加剤に意図的には添加されないが、それらの中に存在する可能性がある元素不純物
- 製造設備・器具から原薬及び/又は製剤中に移行する可能性がある元素不純物
- 容器施栓系から原薬及び製剤中に溶出する可能性がある元素不純物
図1は、製剤の製造過程の構成要素を示したものである。リスクアセスメントでは、それぞれの要素における潜在的な混入源からの元素不純物量が製剤の元素不純物の総量に影響することを考慮しなければならない。
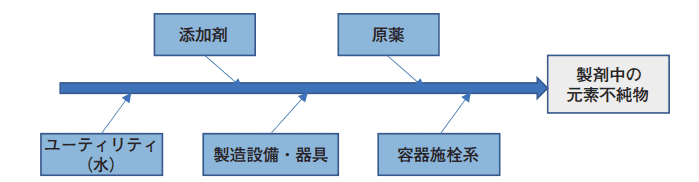
図1.元素不純物の潜在的な混入源
リスクアセスメントに着手する一般的なアプローチ手法として、各構成成分の元素不純物に着目する「構成成分アプローチ」と最終製品の元素不純物に着目する「製剤アプローチ」がある。各アプローチで考慮する混入源などを図2にまとめた。これらの混入源についてそれぞれ公表文献や供給者からの情報又は試験結果など、根拠となるデータを入手し影響の大きいものを特定する。
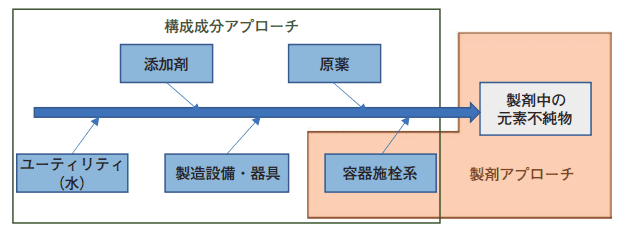
図2.リスクアセスメントのアプローチ
余談ではあるが、元素不純物ガイドラインには、より理解を深めるために10のモジュール(0 ~ 9)で構成されるトレーニングメソッドが用意されている。アプローチ方法についてはトレーニングメソッド モジュール5で詳細に紹介されているので、参考にしていただきたい。
3. 2. 元素不純物の評価(PDE 値と許容濃度との間の換算)
混入源の特定と対象元素が決定できれば、製剤中の個々の元素不純物に関して、実測値又は予測値と設定PDE値を比較し評価を実施する。PDE値を実測値又は予測値と比較するために許容濃度へ換算する手法として、ガイドラインではオプション1、2a、2b及び3の4つの手法が記載されている。構成成分アプローチではオプション1、2a及び2bから適した方法を選択し、製剤アプローチでは最終製品の評価になるため、オプション3を用いて換算する。(評価に関する詳細はガイドライン7項を参照)
3. 3.元素不純物の管理
ガイドラインでは管理閾値はPDE値の30%と定義されている。元素不純物量が管理閾値を下回る場合、追加の管理は必要とされていない。管理閾値を超える可能性があるがPDE値より低い場合には、元素不純物量の低減対策を実施する必要がある。対策の一例としては、上流管理、構成成分や容器施栓系の再選択、規格の設定などがある。
PDE値を超える場合にはさらなる対策を実施する必要がある。ただし、対策が技術的に実現不可能な場合に、トレーニングメソッド モジュール6で示すような、特定の状況下では妥当性を説明することで容認される可能性がある。
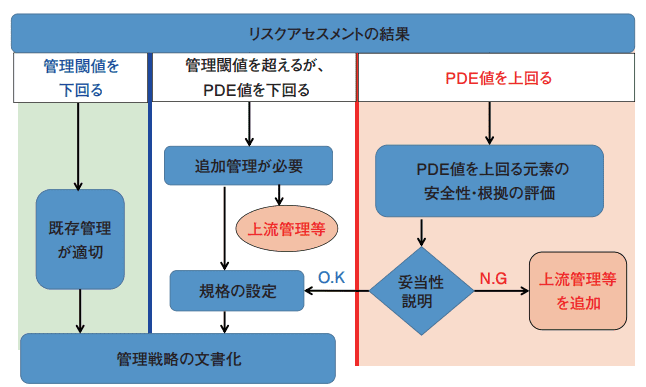
図3.元素不純物の管理
4.スクリーニングによる一次評価
リスクアセスメントの方法は多々あるが、製剤アプローチで実施する場合、まずは製剤中の元素不純物量に関するデータを収集し、アセスメントが必要な元素を決定する。元素不純物量に関する十分なデータがない場合などは、製剤中の元素不純物量を実際に測定する必要がある。ICH Q3Dの対象24元素について設定した許容濃度の管理閾値との比較分析(スクリーニング分析)を実施することは対象元素を絞り込む有効な手段の一つである。
ここでは注射剤を例に、仮想のスクリーニング分析例を紹介する。
投与経路:注射
最大一日投与量:2 mL
対象元素: クラス1、2A、2B及び3(24元素)
オプション:3
定量限界: PDE値から求めた許容濃度の10%又はそれ以下
使用装置:ICP質量分析計
表1にスクリーニング分析で実施した対象元素の一部について許容濃度、管理閾値、定量限界及び結果を示す。
表1.スクリーニング分析の許容濃度、管理閾値、定量限界及び結果
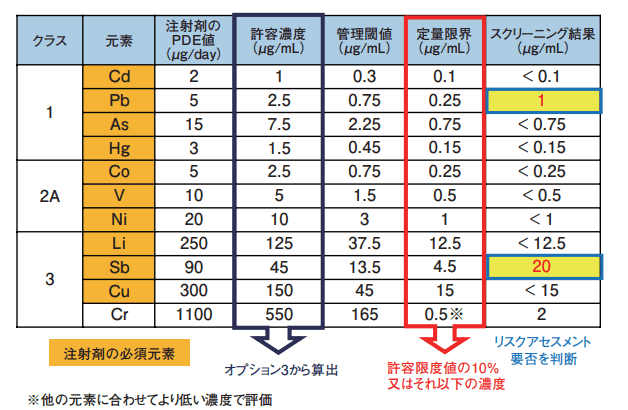
許容濃度はオプション3にて注射剤のPDE値を最大一日投与量(2mL)で除し換算した。この例では定量限界を、許容濃度の10%又はそれ以下としている。Crの様な許容濃度が他より特に高い元素は、測定時の定量限界を他の元素に合わせて、より低い濃度で評価することで、元素不純物の混入を確認することができる。また、例に示す通り対象元素ごとに許容濃度が異なるため、標準溶液の調液にはICH Q3D用に濃度設定された市販の混合標準溶液を使用することで希釈作業が削減され精度よく調液することが容易になるだろう。
この例ではスクリーニングの結果、Pb及びSbで管理閾値以上に検出されているため、混入起源の特定、上流管理、場合によっては本剤での規格の設定など追加の管理が必要になるだろう。注射剤では製剤中の元素不純物のみならず、製剤の有効期間中に包材成分の溶出のリスクが懸念される。容器施栓系からの混入リスクは安定性試験や苛酷条件での試験データ、又は部材メーカーからの情報収集などによって別途評価する必要がある。
5.まとめ
リスクアセスメントの内容、アプローチの一例として注射剤を例にスクリーニングによる一次評価方法を紹介した。元素不純物のリスクアセスメントは、投与経路や構成成分などで様々なケースがあり、それぞれの状況に合わせた対応が必要となる。ガイドラインのみならず詳細について提示しているトレーニングモジュール、海外の添加剤の文献データなど様々な情報を参考にすることを推奨する。2項で述べたように第十八改正日本薬局方の告示施行後36箇月までに、日局品製剤及び局外品製剤についてもガイドライン通知及び当該新薬局方の規定に基づく元素不純物の管理が求められるので留意されたい。
「微量元素分析 ―さまざまな分野での活用事例とその重要性―」シリーズ開始にあたって
電子材料(半導体)や水質分析の他、食品や医薬品でも微量元素の管理が必要とされています。第十八改正日本薬局方(JP 18)では、製剤中の元素不純物の管理・試験法が収載されており、今後ますます微量元素分析の重要性が増してくると考えられます。
本シリーズでは、全4回の連載で半導体・環境・医薬品・食品の視点から、各分野における微量元素分析の例をご紹介します。
本連載が読者の皆様のご研究の一助になりましたら幸いです。