【連載】よくわかるBDNF -基礎から臨床まで-「第2回 BDNF発生発達期の機能と発達障害との関係」
本記事は、和光純薬時報 Vol.89 No.4(2021年10月号)において、香川大学 医学部 鈴木 辰吾様に執筆いただいたものです。
はじめに
BDNFは神経活動依存的に神経細胞から放出される栄養因子であり、シナプスの再編を誘導して記憶や学習に関与する。一方、BDNFは、発達期の脳において、神経細胞の生存の維持や分化誘導、シナプス形成やシナプス結合の誘導などのさまざまな作用を有するため、その重要性は理解されているものの、その機能の本体を捉えることが難しい。近年の研究より、発達期におけるBDNFの発現低下が神経回路の形成異常に関連する可能性が示唆されており、その異常が発達障害に繋がる可能性も指摘されている。そこで今回は、発達期の脳におけるBDNFの発現、機能、役割について記したのち、BDNFと発達障害との関係について解説を行う。
発達期の脳におけるBDNFの発現
BDNFは脳の広範な領域において発現しており、特に、海馬、扁桃体、大脳、小脳などにおける発現が高い1, 2)。大脳皮質や海馬では、主に興奮性の神経細胞において強く発現しており、神経細胞以外では、ミクログリアなどに発現している。BDNFはマウスの胎生11.5日齢から脳で発現が確認できるが、特に生後において発現が上昇する3-5)。
BDNFの発現は、神経伝達物質であるGABAやグルタミン酸、そして脱分極を起因とする細胞内カルシウムシグナルに影響されることから、これらの神経科学的要因と発生に依存した転写因子の発現変化との組み合わせにより、BDNFの発現が生後の発達に従い上昇してくるものと考えられる。一方、この時期における、BDNFの高親和性受容体であるTrkBの発現は大きく変動しない。
BDNFの発現は、DNAのメチル化によって抑制されることが広く知られている6)。ストレスを負荷した動物モデルやヒトの病態において観察されるBDNFの発現低下とDNAのメチル化の関連を示唆する報告は多数存在している。
一方、BDNFの発現を抑制しうる因子として、miRNAや内因性のBDNFアンチセンスRNAの存在が明らかになっている7, 8)。BDNFは、それぞれ異なる発現調整を受けた多数の転写物として発現されるが、全てのmRNAは同一のコーディング領域を持つため、同一のアミノ酸配列を持つBDNF蛋白質のみを生成する。そのためBDNFの転写物の多様性は、蛋白質としての配列の多様性を生むのではなく、時空間的な発現パターンの多様性に寄与するものと考えられる9)。
例えば、BDNFのmRNAは恒常的にも神経活動依存的にも転写されるが、これらは異なる転写物として生成される。また、BDNFはプロ体として合成され、切断により成熟型BDNFとなる10)。プロセッシングを受けた成熟型BDNFの部位にあたるアミノ酸配列は高度に保存されており、ヒト、マウス、ラット間では全く相違がない。
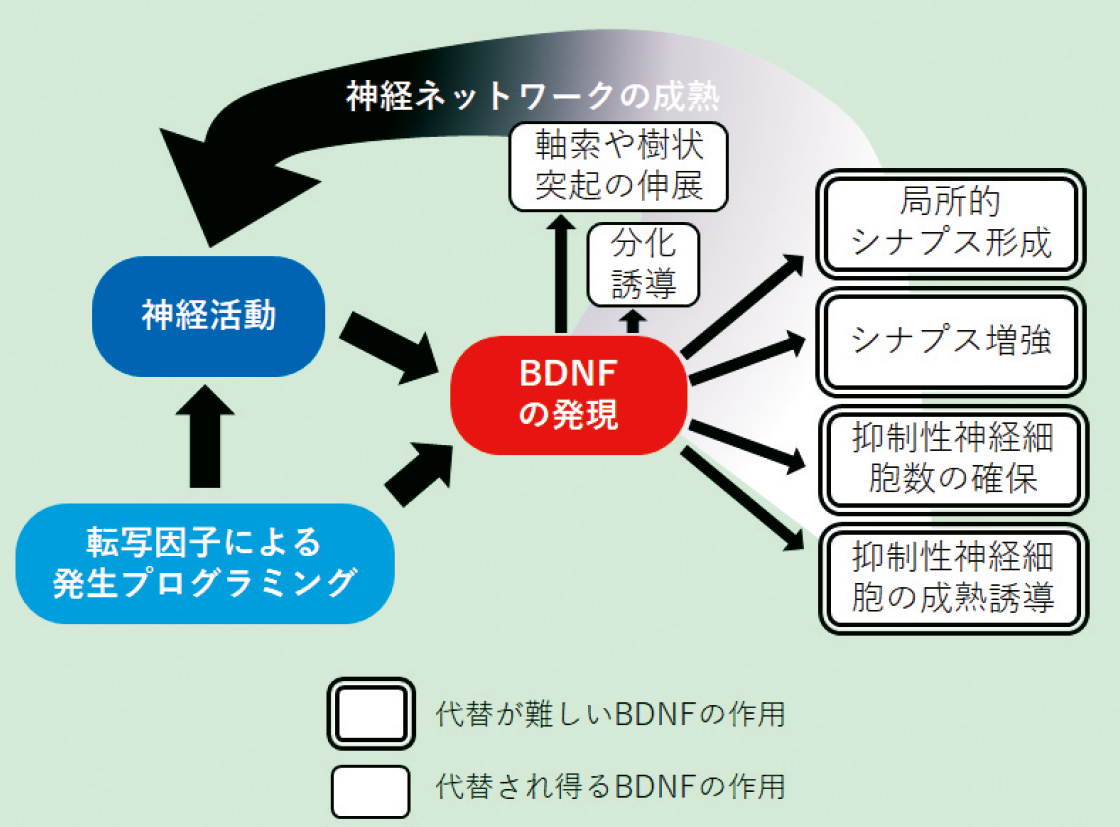
図.発達期におけるBDNF の作用
BDNFが持つ神経細胞への活性
発達過程の神経細胞に与えることができるBDNFの活性は多岐にわたる。まず、神経幹細胞の増殖や神経細胞への分化を促すことができる。また、BDNFは神経細胞の生存維持、細胞移動を誘導し、そして軸索や樹状突起の分岐、樹状突起数などを増やすことができる11)。さらに、BDNFはシナプスの成熟を誘導するとともに、シナプス数の増加、後シナプスの肥大化、シナプス間の神経科学的な結合の調整、長期増強の促進を誘導することができる12)。
一方、組織によっては、軸索の刈込みの促進などの作用を持つことも報告されている13)。これらの多岐にわたる作用は、さまざまな時期における脳のさまざまな部位、そしてさまざまな実験系において観察された現象である。
発達期におけるBDNFの特筆すべき役割
これだけの作用があるため、BDNFが欠損すると神経回路を作ることなど到底できないように思える。しかし意外にも、BDNFノックアウトマウスにおける脳の構造は我々の予想よりも正常に近い。もちろん、BDNF欠損の影響は大きく、ほとんどのBDNFノックアウトマウスは心臓の形成不全などの脳ではない組織の影響により生後数日で死んでしまうが、なかには2-4週間生存できる個体も存在する14)。
その脳において、BDNFが高発現する大脳皮質や海馬を観察してみても、一部が欠損したり、層構造が大きく乱れたりするような変化は見られない。これはBDNFの持つ活性の多くが、他の内的因子によって代替され得ることを示している。BDNFは生後に発現上昇する蛋白質であるため、脳の発達におけるその特異的な機能は、生後において発揮されると考えられる。
実際、生き残ったBDNFノックアウトマウスやヘテロノックアウトマウス、またBDNFを神経細胞において特異的に欠損させたマウスでは、生後に形成される神経回路や神経回路形成後におけるシナプス間情報伝達の異常が見られる15)。そして個体においては、これらの異常が学習および記憶障害や行動異常として観察される。そのため、代替の難しいBDNFの最も中心的な機能は、生後における神経回路の形成と脳の機能維持への寄与と捉えることができる。胎児期に大まかな未熟なものとして作られた脳の神経回路は、生後に、環境からの刺激や経験を反映させた上で成熟し、完成する。BDNFはこの後半の過程とそれ以降に最も特性を発揮する因子と言える。
BDNFの欠損によって表出する現象の一つとして、海馬や大脳皮質における抑制性神経細胞数の減少が挙げられる14)。抑制性神経細胞は、細胞移動の後、静止し、局所の回路に取り込まれるが、その際、生存競争にさらされる。一方、BDNFのノックアウトマウスにおいて、興奮性神経細胞の数には変化が見られない。BDNFは興奮性神経細胞において高発現しているため、興奮性神経細胞から分泌されたBDNFが抑制性神経細胞の移動を促し、その後、生存競争を促すことによって、局所的な抑制性神経細胞の数を調整しているものと考えられる。神経細胞の生存を誘導できる因子は多数あると考えられるため、この時期の抑制性神経細胞の生存が特にBDNFに依存しているものと思われる。
また、BDNFのヘテロノックアウトマウスやコンディショナルノックアウトマウスにおける大脳皮質や海馬の観察から、BDNFは軸索の進展と誘導よりも、末梢における分岐、そしてシナプス形成自体に最も影響を与えることが示唆されている16)。同様に、樹状突起の数や分岐数にもBDNFは影響を及ぼすことから、BDNFは軸索と樹状突起の分岐を促進してシナプス数を増やすための土台をまず作り、その上で、シナプス形成を誘導することによって、シナプス数を実際に増加させているのであろう。
ただし、小脳や網膜などでは、BDNFがシナプスや軸索の刈込みに寄与することも知られているため、脳全体におけるBDNFのシナプス形成への作用を一義的に捉えることはできない。また、成熟後の海馬のスライスを用いた研究より、BDNFは単一の樹状突起上のスパインから選択的に放出され、シナプス特異的な長期増強を誘導できること17)、樹状突起や細胞体から放出されたBDNFは近傍に存在する神経細胞に最も作用すること18, 19)が報告されている。このことから、発生の過程においても、BDNFは局所的に放出されることによって、限局的な範囲におけるシナプスの数を相対的に増加させるために機能している可能性が考えられる。
また、BDNFは抑制性神経細胞の成熟にも強く関与している。BDNFを強制発現させたマウスでは、抑制性神経細胞の発達が促進され、抑制性神経細胞の発達に依存した視覚野の臨界期の終了が前倒しされる5)。実際には、感覚刺激が入力するようになって活性化した神経細胞が放出するBDNFと発生の遺伝子プログラムによって発現が上昇してきたBDNFの総和により、抑制性神経細胞の発達が調整され、臨界期の終了が決定されているのであろう。
また、臨界期に入る前のBDNFノックアウトマウスのバレル皮質では、パルブアルブミン陽性の抑制性神経細胞の電気生理的性質や形態の未熟さが観察される20)。このことから、臨界期の前段階における局所回路形成においても、BDNFによる抑制性神経細胞への成熟誘導作用が重要であることが理解できる。大脳皮質の局所回路が正しく形成されるためには、順番に従った神経細胞種別の活性化が必要であると考えられていることから21)、発達期における一過的なBDNFの発現変動が、局所回路の構造に影響を与え、成熟後の脳機能に影響を与える可能性が十分に考えられる。
また、成熟した大脳では、パルブアルブミン陽性の抑制性神経細胞同士がギャップジャンクションで結合されており、同期的活動やリズムの生成を主導している。そのため、発達期におけるBDNFの発現低下が、局所的な回路形成に加えて、同期的発火にも影響を及ぼし、脳の機能に影響を与える可能性も考えられる。実際、パルブアルブミン陽性の抑制性神経細胞において、BDNFのシグナル伝達を遺伝子組み換えマウスを用いて特異的に阻害すると、同期的活動やリズム形成に影響を及ぼすことが報告されている22)。
一方、BDNFは成熟後の海馬における興奮性神経細胞が作る神経ネットワーク内のシナプス増強に関与することが古くから研究されているが23)、発達期におけるBDNFの役割は十分に解明されていない。しかし、BDNFは、海馬や大脳皮質における興奮性神経細胞の樹状突起上に存在するスパインの数や成熟に対して正に影響を及ぼし得ることから、興奮性神経細胞同士の結合にも影響を及ぼしていると考えられる。興奮性神経細胞が作る神経ネットワークは情報処理系の主幹であり、広域ネットワークの接続にも関わるため、BDNFがこれらの回路形成に果たす役割の解明が強く望まれる。
BDNFと発達障害との関係
胎児期を含めた発達期におけるストレスが、BDNFの発現低下を誘導し、その結果として正常な脳の発達が阻害され、発達障害や精神疾患の発病の素因となり得るという仮説が広く知られている。この仮説を裏打ちするように、さまざまなストレスを負荷したモデル動物においてBDNFの発現変動が確認されている24)。胎生期においては、母体への拘束ストレスや心理的ストレスの負荷により、海馬におけるBDNFの発現低下とDNAのメチル化が観察されている24)。また、生後における母子分離ストレスによっても海馬や前頭前皮質においてBDNFの発現は低下し、シナプス数の減少なども観察される4)。
母子分離ストレスによるBDNFの発現低下においては、これに伴ったヒストンのメチル化状態の変化やBDNFの発現を制御するmiRNAの発現増加も報告されている24)。そして、胎生期や新生児期においてストレスを受容した動物では、発達後における社会性低下や不安様行動が観察されるため、発達期におけるBDNFの発現低下が、発達過程の神経回路形成になんらかの影響を及ぼし、その影響が成熟後にまで及ぶという可能性が考えられる。また、発達期におけるBDNFの作用を考えると、ストレスによるBDNFの発現低下が、例え一過的、局所的なものであっても、個体に永続的な影響をもたらす可能性が考えられる。
一方、ヒトでは、血中BDNF濃度と精神疾患との関連を調べた研究成果が多数報告されている。血中BDNFは血小板由来と考えられているが、それ自身の意味は不明である。しかし、脳内におけるBDNFのメチル化状態と血中におけるBDNFのメチル化状態が、個体内ではばらつきがあり相関は見られないものの、集団としては相関することが動物実験によって確認されている25)ことから、ヒトにおける血中BDNF濃度を扱った実験結果は、集団としては、脳の反応として外挿できるものと考えられている。
精神疾患の中でも、血中BDNFとの関連がより研究されているのが自閉症スペクトラム障害である。自閉症スペクトラム障害の患者では血中BDNFの上昇が確認されている一方、新生児における検査では、血中BDNF濃度の低下と自閉症スペクトラム障害の発症の優位な関連が示されている26)。そのため、自閉症スペクトラム障害においては、脳が発達する段階においてはBDNFの発現が低く、脳が成熟した後に発現が高くなると考えられる。
興味深いことに、このような現象は、母子分離ストレスを負荷した動物においても観察される。母子分離ストレスを与えた動物では、前述のように発達期におけるBDNFの発現低下が観察される一方、母子分離ストレス負荷を終了した後にBDNFの発現が正常群に対して上昇する4)。理解されている事象を繋げて考えると、発達期におけるBDNFの一過的な発現低下が抑制性神経細胞の成熟を抑制し、結果的に興奮性神経細胞の活動が盛んになることにより、BDNFがより放出されるようになるモデルが考えられるが、未解明な部分が多く、想像の域を超える仮説とは言えない。
また注意欠陥多動性障害(ADHD)と血中BDNFとの関係には、発達期から大人にかけての低下などが報告されているものの27)、まだ見解は定まってはいない。BDNFの低下とADHDとの関連は、BDNFの機能低下が黒質ドパミン作動性神経細胞の発達低下につながり、ADHDの発症に関与するという仮説によって補完されている。この仮説は、BDNFが黒質のドパミン作動性神経細胞の生存維持や発達、分化に強い影響を与えることを示した多くの研究によって支えられている。
おわりに
これまでの多くの基礎研究より、発達期のBDNFの働きが明らかになってきた。しかしながら、神経回路が構築される際の役割の全貌はまだ明らかになっていない。これは、神経回路の構造と動作原理の解明が現在進行中であることが何よりの理由であるが、その中でBDNFが果たす役割の重要性に疑いの余地はなさそうである。このブラックボックスの中で働くBDNFの役割の解明が進むことにより、発達障害との関連も明らかになり、治療法や介入法の開発へと繋がることが期待される。
参考文献
- Hofer, M. et al. : EMBO J., 9, 2459 (1990).
- Timmusk, T. et al. : Neuron, 10, 475 (1993). DOI: 10.1016/0896-6273(93)90335-o
- Pöyhönen, S. et al. : Front. Physiol., 10, 486 (2019). DOI: 10.3389/fphys.2019.00486
- Ohta, K. I. et al. : J. Neurochem., 141, 179 (2017). DOI: 10.1111/jnc.13977
- Huang, Z. J. et al. : Cell, 98, 739 (1999). DOI: 10.1016/s0092-8674(00)81509-3
- Zheleznyakova, G. Y. et al. : Behav. Brain Funct., 12, 17 (2016). DOI: 10.1186/s12993-016-0101-4
- Zhang, Y, et al. : Biomed. Pharmacother., 80, 207 (2016). DOI: 10.1016/j.biopha.2016.03.003
- Lee, S. T. et al. : Ann. Neurol., 72, 269 (2012). DOI: 10.1002/ana.23588
- West, A. E. et al. : Handb. Exp. Pharmacol., 220, 67 (2014). DOI: 10.1007/978-3-642-45106-5_4
- Deinhardt, K. and Chao, M. V. : Neuropharmacology, 76, 603 (2014). DOI: 10.1016/j.neuropharm.2013.04.054
- Numakawa, T. et al. : Histol. Histopathol., 25, 237 (2010). DOI: 10.14670/HH-25.237
- Zagrebelsky, M. and Korte, M. : Neuropharmacology, 76, 628 (2014). DOI: 10.1016/j.neuropharm.2013.05.029
- Choo, M. et al. : Nat. Commun., 8, 195 (2017). DOI: 10.1038/s41467-017-00260-w
- Jones, K. R. et al. : Cell, 76, 989 (1994). DOI: 10.1016/0092-8674(94)90377-8
- Cunha, C. et al. : Front. Mol. Neurosci., 3, 1 (2010). DOI: 10.3389/neuro.02.001.2010
- Cohen-Cory, S. et al. : Dev. Neurobiol., 70, 271 (2010). DOI: 10.1002/dneu.20774
- Harward, S. C. et al. : Nature, 538, 99 (2016). DOI: 10.1038/nature19766
- Horch, H. W. et al. : Neuron, 23, 353 (1999). DOI: 10.1016/S0896-6273(00)80785-0
- Horch, H. W. and Katz, L. C. : Nat. Neurosci., 5, 1177 (2002). DOI: 10.1038/nn927
- Itami, C. et al. : J. Neurosci., 27, 2241 (2007). DOI: 10.1523/JNEUROSCI.3345-06.2007
- Kimura, F. and Itami, C. : J. Neurosci., 39, 3784 (2019). DOI: 10.1523/JNEUROSCI.1684-18.2019
- Xenos, D. et al. : Cereb. Cortex, 28, 3399 (2018). DOI: 10.1093/cercor/bhx173
- Lu, Y. et al. : Neurobiol. Learn. Mem., 89, 312 (2008). DOI: 10.1016/j.nlm.2007.08.018
- Miao, Z. et al. : Int. J. Mol. Sci., 21, 1375 (2020). DOI: 10.3390/ijms21041375
- Duffy, H. B. D. and Roth, T. : Front. Hum. Neurosci., 14, 594244 (2020). DOI: 10.3389/fnhum.2020.594244
- Skogstrand, K. et al. : Transl. Psychiatry, 9, 252 (2019). DOI: 10.1038/s41398-019-0587-2
- Galvez-Contreras, A. Y. et al. : Front. Psychiatry, 8, 126 (2017). DOI: 10.3389/fpsyt.2017.00126