【連載】ヒトiPS 細胞由来分化細胞の創薬応用「第1回 ヒトiPS 細胞由来心筋細胞を用いた心収縮評価システムの最新動向」
本記事は、和光純薬時報 Vol.89 No.2(2021年4月号)において、東京大学大学院 薬学系研究科 化学物質安全性評価システム構築社会連携講座 澤田 光平様に執筆いただいたものです。

初めに
心筋の収縮を正常に保つことは、全身に血液を送り出す心臓のポンプ機能にとって極めて重要である。心筋症などの心疾患、薬物誘発の心毒性、COVID-19 などのウイルスによる心筋障害、更には環境汚染物質PM2. 5 など様々な原因が心筋の収縮性に障害をもたらす要因となる。これらの要因は心不全の誘発、悪化につながる臨床上重要な課題として認識されており、高齢者の心不全増加の原因に少なからず関与していると考えられる。これらの課題を解決するために、ヒト心筋細胞を用いた病態の解明、治療法の開発、薬剤の副作用軽減を目指した研究が今後とも必要であり、成体心筋により近づいたヒトiPS 細胞由来心筋細胞の重要性はますます増加してくると考えられる。
ヒトiPS 細胞由来心筋細胞は分化初期から電気的活動のみならず収縮機能を有することから、ヒト心機能に対する薬物作用予測に大きく役立つと考えられてきた。実際、心筋細胞として未成熟な状態であっても薬物による不整脈誘発リスクの予測においては、臨床における催不整脈リスクレベルにかなり一致した予測性を示すことが明らかとなった1)。これは、薬物による催不整脈作用の作用点となる細胞膜上のイオンチャネルに関しては、未成熟性を有しているiPS 細胞由来心筋細胞でも成体心筋と同じように機能しているためと考えられる。
一方、収縮機能に関しては、iPS 細胞由来心筋細胞とヒト成体心筋標本で生理学的特性や薬理学的特性に関しての違いが、種々指摘されている2)。例えば、iPS 細胞由来心筋細胞では収縮力は小さく、成体心筋では収縮頻度と収縮力の関係(頻度−収縮関係、forcefrequency relationship、FFR)が正の関係であるのに対し、iPS 細胞由来心筋細胞では負の関係を示す。また、成体心筋組織ではβ-受容体刺激により収縮力が大きく増加する陽性変力作用(positive inotropy)が認められるが、iPS 細胞由来心筋細胞では陽性変力作用が明確でないことも多い。
これらの特性はiPS 細胞由来心筋細胞の収縮システムの未成熟性、特に細胞内Ca 制御にかかわるタンパク質の低発現、エネルギー供給にかかわるミトコンドリアの未発達、更には筋線維のランダムな配向性などが原因であると推察されている。現在、これらの性質をより成体心筋に近づけるため成熟化の方法が様々検討されている3)。
2D/3D 収縮評価系の新たな展開
近年、iPS 細胞由来心筋細胞の収縮評価において、成体心筋に近い収縮性を示す標本を作製する目的で、成体の細胞外基質と同様な柔軟性を有する基材を用いて2D/3D の心筋モデルを作製することが進められている。プラスチックプレートのように固い素材上に播種された心筋細胞でも、長時間の高頻度電気的ペーシング、配向性の付与あるいは成熟化促進物質を与えることによって、FFR やβ-受容体刺激などに対する薬理的応答が改善されることが示されている。これらの方策に加え、柔軟な基材を用いることによって更に成熟化が促進され収縮特性が改善されることが期待される。
表には柔軟な細胞外基質を用いた心筋組織標本作製法をまとめた。
表.柔軟な細胞外基質を用いた2D/3D 心筋組織標本
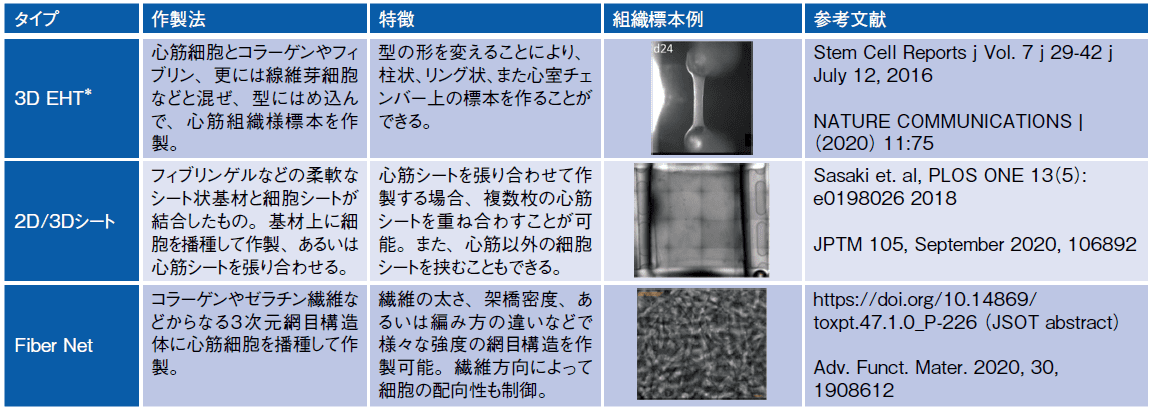
* Engineered Heart Tissue
EHT(Engineered Heart Tissue)は20 年以上前に心筋梗塞で失われた心筋組織に移植する目的で作製された人工的心筋組織で、ハイドロゲルマトリックスの中に心筋細胞を封じ込めたものである。この技術をヒトiPS 細胞由来心筋細胞に適用し、ハイドロゲルマトリックスとしては生体成分のフィブリン、コラーゲンあるいは人工的高分子を用い、心筋以外の線維芽細胞なども加えて、必要な形状に成形して、収縮評価に用いている。EHT 標本に長期ペーシングを行うことで、成体心筋組織に近い生理的、薬理的応答が得られることも報告されている4)。
心筋シート標本はフィブリンゲルやPDMS(Polydimethylsiloxane) などで作られた柔軟なシート状基材の上に心筋層が張り付いた形状で、心筋細胞の収縮によってもたらされるシートの変形を収縮力あるいは変異として検出するものである。再生医療応用のために開発された細胞シート作製技術を用いて作られた心筋シートを張り合わせる場合には、複数の心筋シートや他の細胞シートを重ね合わせた多層の心筋組織を作製することも可能である。
コラーゲンやゼラチンなど柔軟な繊維をネット状に成形して作られた3D の足場材を用いて心筋細胞の培養を行う取り組みも活発になっている。この技術では繊維の素材、太さ、方向性、密度などそれぞれの特性を変更することができ、組み合わせの自由度も大きいことから、様々な細胞や目的に応じた足場を作ることができる。心筋は繊維長軸方向に沿って配向する特性がある。また網目構造のため厚い3D 標本中心部でも十分に酸素や栄養成分を受け取ることができるなど非常に魅力的な技術である。
心筋の収縮評価においては、まだ始まったばかりであるが、今後の発展が期待できる。次に3D 網目構造足場材を用い現在行っている研究について紹介する。
ゼラチン繊維不織布を用いた収縮評価系の取り組み
これまでの研究から、成熟を促すとされている種々の方法を同時に与えることにより、心筋細胞成熟が加速されることが予測される。ゼラチンは動物の皮膚などの結合組織の主成分であるコラーゲンから抽出されたアミノ酸ポリマーで、親水性、細胞接着性などに優れているため、細胞培養の基材として古くから用いられていた。心筋細胞が長軸方向に配向できるような直径を有したゼラチン繊維を3D 網目構造に加工することにより、大きな収縮変化を得るだけでなく、成熟を促すことのできる足場材となることが期待される。
日本毛織(株)が開発したゼラチンハイドロゲル繊維不織布(Genocel®)は繊維同士が結合したネットワーク構造を有し、長期培養にも安定で、収縮変形能と変形回復能に優れていることも示されており、心筋収縮を評価する目的に適している素材であると考えられる。ただし、今回実験には心筋細胞が長軸方向に配向しやすいように市販のGenocel®より繊維径の細いゼラチン繊維から構成されたゼラチン繊維不織布(GHFN)を用いた。
ヒトiPS 細胞由来心筋細胞(iCell® Cardiomyocytes2)をGHFN に播種すると、3 日目からゼラチン繊維長軸方向に縦長の心筋細胞が整列し、サルコメアの縞模様も観察できた。また、アクチン繊維はゼラチン繊維に沿って伸展し、ゼラチン繊維の交点を介して連結し、ネットワーク構造を形成した。培養7日目以降ではGHFN 全体が同期拍動を示した。15 日間培養することで、心筋の拍動がより大きくなり、ゼラチン繊維長軸に沿って配向したサルコメア構造もさらに明確になり、サルコメア長はおよそ2 μm で成体心筋細胞と同様な構造的特性を示した(図A)。
タイムラプス動画からカルシウムトランジェントと動きを同時に測定することで、1つの像からカルシウムレベルと心筋の動きを評価することが可能であった(図B)。
2 週間培養の標本において、Isoproterenol(β- 受容体作動薬)、Milrinone(PDE3 阻害薬)およびDigoxin(Na-K ポンプ抑制薬)の陽性変力作用が確認できた(図C)。
iCell® Cardiomyocytes2 を用いたこれまでの報告では、長期ペーシングなどで成熟化促進を行わない標本においては、これらの陽性変力作用はとらえにくいことが報告されている。今回の結果はゼラチン繊維3D 足場材上で培養しただけでペーシングと同様の効果があることを示唆する。また、ゼラチンは無色透明で、薬物によるサルコメア、ミトコンドリアまた核など細胞内小器官への影響を調べる場合にも適していると考えられる。
Digoxin 高濃度による細胞内局所でのCa 振動(図D、下段)は催不整脈性の副作用メカニズムと関連している可能性がある。また、抗がん剤Nilotinib長期暴露によるミトコンドリアの断片化の像(図E、b)下段)は心毒性との関連性を示唆する。ゼラチン繊維3D 足場材を用いた検討はまだ進行中であるが、今後さらに広い応用性が示されると考えられる。
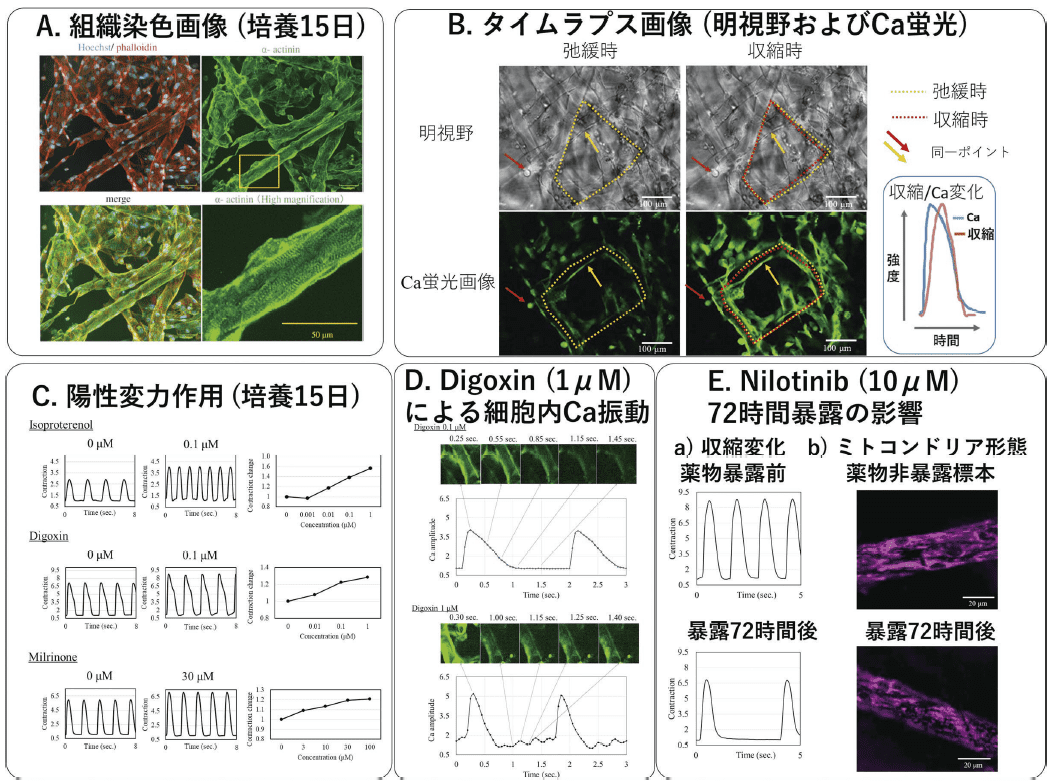
図.ゼラチンハイドロゲル繊維不織布(GHFN)上で培養したヒトiPS 細胞由来心筋細胞標本を用いた薬理評価
実験にはiCell® Cardiomyocytes2をGHFN 足場に対し、6,000 cells/mm2 の濃度で播種し、2 週間培養した標本を用いた。画像記録および解析にはそれぞれ共焦点イメージング装置(CQ1, 横河電機)およびCellPathfinder(横河電機)を用いた。(A)組織染色(培養15 日目):細胞核(Hoechst)、アクチンフィラメント(phalloidin)、アクチン結合タンパク質(α-actinin)を蛍光染色。アクチンフィラメント画像より広範なネットワーク構造、α-actinin 画像よりゼラチン繊維長軸方向に整列したサルコメア構造が確認できる。
(B)収縮およびCa 蛍光強度測定 : 明視野(上段)およびCa 蛍光(下段、蛍光色素EarlyTox)タイムラプス画像を同一視野から記録した(20 frame/ 秒)。収縮波形の数値化にはMUSCLEMOTION Software5)を、Ca 蛍光強度変化はCellPathfinderを用いた。細胞内Ca の上昇に伴い細胞収縮が開始し、ゼラチン繊維の変形がみられる。
(C)陽性変力作用:上段からβ-受容体作動薬(Isoproterenol)、強心配糖体(Digoxin、Na-Kポンプ阻害薬)およびホスホジエステラーゼ3 阻害剤(Milrinone)。Isoproterenol およびMilrinone は収縮力および拍動数を濃度依存的に増加させた。Digoxin は収縮力を濃度依存的に増加させた。
(D)Digoxin 1μM による細胞内Ca振動:0.1μM では細胞内Ca は急速に増加した後、ゆっくりと減少し静止時には低値を維持した(上段)。一方、1μM では細胞内Ca は急速に増加後、速やかに減少し たが、その後小さな増減を繰り返した(下段)。
(E)抗がん剤Nilotinib 72 時間暴露の影響:収縮力は72 時時間後25%程度低下し、拍動数も低下した(a)下段)。MitoTracker® によるミトコンドリアの形態観察においてNilotinib 暴露標本ではミトコンドリアの断片化の像が見られた(b)下段)。
最後に
心毒性をもたらすメカニズムは多様で、複雑に絡み合っている。臨床での心機能リスクを正しく予測するためには、収縮機能のみならず組織学的変化も併せて検討できる総合的 in vitro 細胞実験システムの開発が重要であろう。また、抗がん剤などの薬物による心筋収縮力抑制を検討する時には長期の薬物暴露が必要であり、成熟化などを進めた心筋細胞でもその状態を長期に維持できるかなどの課題を解決することも重要である。
参考文献
- Blinova, K. et al. : Cell Rep., 24, 3582 (2018). DOI: 10.1016/j.celrep.2018.08.079
- Karbassi, E. et al. : Nat. Rev. Cardiol., 17, 341 (2020). DOI: 10.1038/s41569-019-0331-x
- Guo, Y. and Pu, W. T. : Circ. Res., 126, 1086 (2020). DOI: 10.1161/CIRCRESAHA.119.315862
- Feric, N. T. et al. : Toxicol. Sci., 172, 89 (2019). DOI: 10.1093/toxsci/kfz168
- Sala, L. et al. : Circ. Res., 122, e5 (2018). DOI: 10.1161/CIRCRESAHA.117.312067
−シリーズ開始にあたって−
2007 年にヒトiPS細胞技術が確立されて以来、現在まで種々のヒトiPS細胞由来分化細胞が報告されています。ヒト細胞であることから、種差の壁を越え臨床予測性向上の期待のもと、創薬応用が展開されています。
本号からの「ヒトiPS細胞由来分化細胞の創薬応用」は、全4回の連載で創薬に対するヒトiPS細胞由来心筋、神経細胞、オルガノイド、肝細胞の応用例を、トップランナーの研究者からご紹介頂きます。
本連載が読者の皆様のご研究の一助になりましたら幸いです。








