【総説】温和な条件下での核水添を実現する不均一系ロジウムー白金ナノ粒子触媒
本記事は、和光純薬時報 Vol.88 No.4(2020年10月号)において、東京大学大学院理学系研究科 宮村 浩之様、小林 修様に執筆いただいたものです。
はじめに
不均一系触媒は、簡便な操作のみで回収、再使用が可能なことから、環境調和型の有機合成において中心的な役割を果たすことが期待される。また、不均一系触媒は連続フロー合成やコンビナトリアル合成などの次世代型の有機合成にも応用される。そのような中、金属ナノ粒子が精密有機合成において、高活性で頑強性の高い不均一系触媒として注目を集めている。金属ナノ粒子は単独では不安定で速やかに凝集を起こしてしまうことから、触媒として用いる場合は安定化が必須であり、我々は、金属ナノ粒子触媒を精密有機合成化学に用いることを目的に、担体として有機高分子に注目した 1)。
高分子を金属ナノ粒子の安定化剤として用いる場合、高分子残基と金属ナノ粒子との相互作用が強すぎると、反応基質のナノ粒子表面への相互作用が阻害され、高い触媒回転が期待できない。そこで、比較的弱い多点での相互作用で金属ナノ粒子を安定化することのできるポリシランを用いることで、基質が容易にクラスター表面にアクセス可能となると考えた。
ポリシランを担体として用いた場合、ポリフェニルメチルシラン(MPPSi)に加え 2)、芳香環を有しないポリジメチルシラン(DMPSi)を担体として用いた場合でも金属ナノ粒子が安定に担持されることから、ポリシラン中のケイ素−ケイ素結合もナノ粒子の安定化に寄与していると考えられる 3)。実際、透過型電子顕微鏡分析における走査像観測装置及び、エネルギー分散型 X 線分析装置によって金属ナノ粒子は主にポリシラン部位に担持、安定化されていることが明らかとなっている 3)。
芳香環の水素化(核水添)反応は、石油化学、水素貯蔵−輸送技術をはじめ、医薬品合成や天然物合成等の有機合成化学においても重要である 4)。中でも複数の官能基が存在する複雑な有機化合物において、芳香環やヘテロ芳香環を選択的に水素化する反応は、医薬品原薬(API)等の生物活性化合物の合成においても新たな戦略を与える。しかし、このような生物活性物質に多く含まれるピリジン、アミド、エステル、カルボン酸、アミン、アルコールといった極性官能基は、金属との相互作用が強く触媒毒となり得る。
ベンゼンやトルエンといった比較的単純な芳香族化合物の水素化反応は均一系、不均一系遷移金属触媒によって進行することが見出されているが 5)、様々な官能基を有する芳香族化合物の水素化を可能とする不均一系触媒の例は非常に限られている。さらに、2つ以上の芳香環を有する化合物における選択的な水素化反応についての一般的な知見は少なく、その予測も難しい。したがって、そのような選択的な水素化が可能となれば、多段階合成における終盤での選択的な芳香環の還元も可能となり、合成戦略が広がると考えられる。
一方で、不均一系触媒をカラムに充填して基質を流通させることで目的物を連続的に得る連続フロー合成は、通常のバッチ法に比べて数々の利点があり、不均一系触媒を用いる反応としても理想的である 2, 3, 6)。ここで用いる触媒には、触媒カラム内で反応を完結させることができる高い触媒回転頻度(TOF)、および、長時間の反応において活性の低下なく反応を連続的に進行させることができる高い耐久性と触媒回転数(TON)が求められる。
ポリシラン固定化金属ナノ粒子による芳香環の水素化反応
ロジウム、白金、パラジウム、およびロジウム−白金合金ナノ粒子をポリシラン−アルミナ複合担体に担持した触媒を、トルエンの水素化反応で活性を評価した(Table 1)。
その結果、白金、パラジウムの単金属ナノ粒子触媒はほとんど活性を示さなかったが(Entries 2 and 3)、0.025 mol% の ロジウムナノ粒子触媒を用いることで、目的のメチルシクロヘキサンが常温、常圧水素といった穏和な条件下、中程度の収率で得られた(Entry 1)。一方、DMPSi および MPPSi に担持したロジウム−白金合金ナノ粒子触媒は、同反応条件下、どちらも良好な収率で目的物を与えた(Entries 4 and 5)。
反応温度を 50℃に上昇させて、これら二種類の触媒の活性を比較したところ、DMPSi に担持した触媒は定量的に目的物を与えたのに対し、MPPSi に担持した触媒は中程度の収率にとどまった(Entries 6 and 7)。Rh-Pt/(DMPSi-Al2O3)触媒(0.00625 mol%)を用いて反応を行ったところ、60 時間で定量的に目的物が得られ、その時の触媒回転数(TON)は 16,000 (トルエンを基準として)であった (Entry 8)。また、水素吸着によって Rh-Pt/(DMPSi-Al2O3)触媒の活性点を測定したところ、0.0155 mmol/g であり、活性点あたりの反応した水素のモル数は 198,193 であった。
Table 1.ポリシラン触媒の活性評価
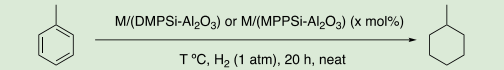
| Entry | Catalyst (M; ポリシラン) |
Rh(M)(x, mol%) | Temp(℃) | Yield(%)[a] | TON[c] |
|---|---|---|---|---|---|
| 1 | Rh; DMPSi | 0.025 | 30 | 40 | 1,600 |
| 2 | Pt; DMPSi | 0.025 | 30 | 2 | 64(/Pt) |
| 3 | Pd; DMPSi | 0.025 | 30 | 0 | 0 |
| 4 | Rh-Pt; DMPSi | 0.025(0.008 Pt) | 30 | 76 | 3,020 |
| 5 | Rh-Pt; MPPSi | 0.025(0.008 Pt) | 30 | 72 | 2,880 |
| 6 | Rh-Pt; DMPSi | 0.025(0.008 Pt) | 50 | 99 | 3,960 |
| 7 | Rh-Pt; MPPSi | 0.025(0.008 Pt) | 50 | 77 | 3,080 |
| 8[b] | Rh-Pt; DMPSi | 0.00625(0.0021 Pt) | 50 | >99 | 16,000 (198,193)[d] |
[a] Determined by GC analysis. [b] Reaction time 60 h. [c] Defined as moles of reacted toluene per mole of Rh. [d] Defined as moles of reacted H2 per mole of active site of catalyst.
連続フロー系における触媒の高耐久性と基質一般性
次に、触媒をカラムに充填して、基質であるトルエンと水素ガスを直接流通させることで反応を行う連続フロー系で反応を行った(Figure 1)。触媒を充填したカラムは 70℃に維持し反応を行ったところ、50 日以上にわたって定量的に目的のメチルシクロヘキサンを与えた。その時の触媒回転数(TON)は 347,149 (トルエンを基準として)、活性点あたりの反応した水素のモル数は 9,981,553 で、約一千万に達することがわかった。
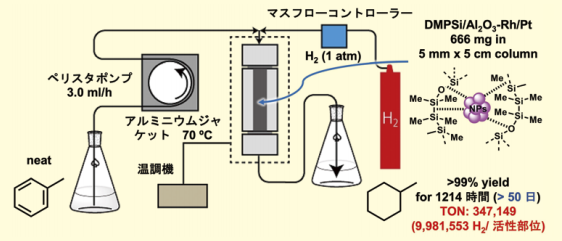
Figure 1.連続フロー系での芳香環水素化反応
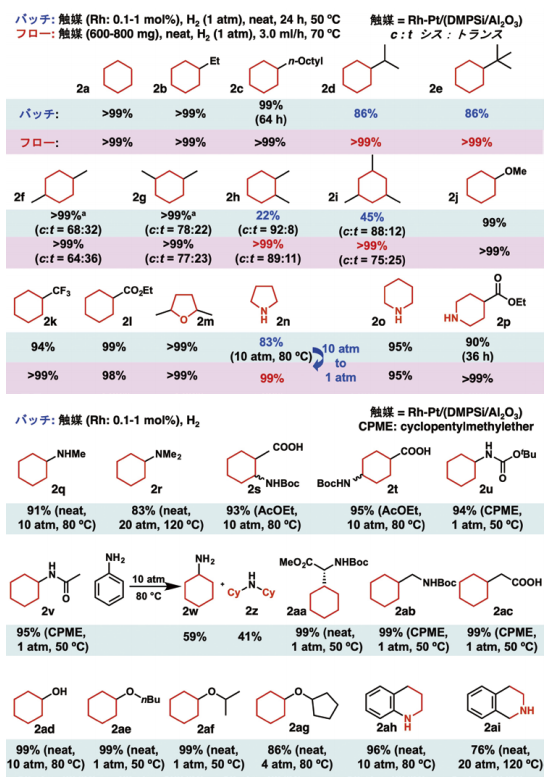
次にバッチ、およびフロー系にて基質一般性の検討を行った(Table 2)。ベンゼンおよび一置換ベンゼンは、バッチ、フロー系どちらも高い収率で水素化反応が進行した(2a-2e)。嵩高い置換基を有する2d、2eにおいては、バッチ系では原料が残存したのに対し、フロー系では定量的に目的物が得られた。para-、meta- キシレンはどちらの系でも定量的に目的物が得られたが、ortho- キシレンやメシチレンについては、フロー系では定量的に目的物が得られたのに対し、バッチ系では低収率にとどまった(2f-2i)。いずれも、立体的な障害が大きい基質においては、フロー系が良い結果を与えた。
電子供与基、吸引基を有する基質では、いずれもバッチ、フロー系共に良好な結果が得られた(2j-2l)。ヘテロ芳香環を有する基質は、フロー系のほうが良い結果を与えた(2m-2p)。特に、ピロールについてはバッチ系では高圧条件を必要とするのに対し、フロー系では1気圧水素で定量的に反応が進行した。
アミノ基やカルボキシル基を有する基質では、いずれの場合も良好な収率で水素化反応が進行した(2q-2v、2aa-2ac)。アニリンを用いた場合は、シクロヘキシルアミンと、ジシクロヘキシルアミンの混合物として得られた(2w、2z)。フェノールやフェニルエーテルでは、いずれも良好な収率で目的物を与えた(2ad-2ag)。キノリンやイソキノリンは二分子の水素と反応し、いずれもヘテロ芳香環のみが還元された(2ah、2ai)。
Table 2. 基質一般性
一方、3-エチルニコチネートの水素化反応は、得られる生成物が様々な生理活性物質に誘導できることから、重要な反応である。これまで、本反応のいくつかの触媒が開発されてきたが、いずれも100気圧を超える水素を必要としていた 4e, 7)。それに対し、Rh-Pt/(DMPSi-Al2O3)触媒においては、10気圧の水素で反応が進行し、バッチ系では良好な収率で、フロー系ではほぼ定量的に目的物が得られた(Scheme 1)。
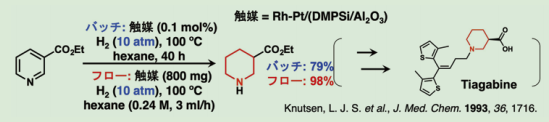
Scheme 1.生理活性物質合成中間体合成
フロー系における特異な反応加速
基質一般性の検討においても、バッチ系に比べフロー系が高い収率を与えることが多かったが、より定量的にバッチ系とフロー系での触媒回転頻度(TOF)の違いを4つの異なる種類の基質に対して計測し、比較することとした(Table 3)。
Table 3. バッチ系とフロー系でのTOF比較
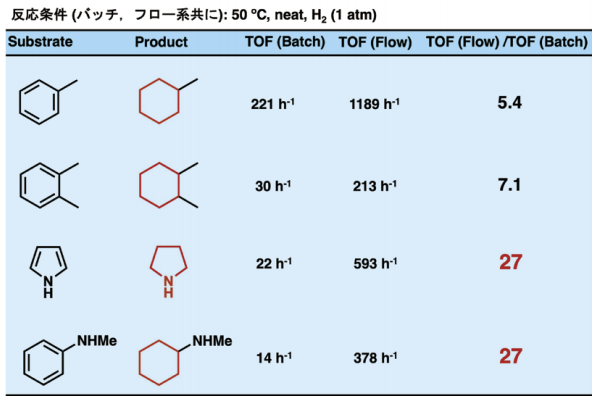
標準的な一置換ベンゼンであるトルエンにおいては、バッチ系に対し、フロー系では5.4倍のTOFが得られた。より嵩高い基質であるortho- キシレンにおいては、バッチ系での反応速度はトルエンに対しおよそ7分の1であったが、フロー系ではバッチ系に対し7.1倍の反応加速が観測された。さらに、ヘテロ原子を有するピロールやN- メチルアニリンは、バッチ系ではより反応性が低かったが、フロー系ではバッチ系に対し27倍の大幅な反応加速が観測された。
これらの結果から、嵩高い基質や、触媒と強く相互作用し、触媒毒となり得るヘテロ原子を有する基質ほど、フロー系での反応加速効果が大きくなることがわかった。
基質の吸着特性による選択的芳香環水素化
Table 3 において、基質の性質によって反応性が大きく異なることがわかった。そこで、同一分子中に二種類の異なる環境に存在する芳香環のどちらか一方を選択的に還元できないかと考えた(Scheme 2)。
アニリン構造とアルキルベンゼン構造を同一分子内に有する基質を用いたところ、アニリン部位のみが選択的に水素化された生成物が優先して得られた(式(1))。これはアニリン部位がより強く触媒表面に吸着したためと考えられる。一方、アニリン部位を Boc 基で保護したところ選択性が逆転した(式(2))。これは、Boc 基の立体障害により、アニリン部位の触媒への吸着が阻害され、アルキルベンゼン部位のみが還元されたためと考えられる。一方、反応をフロー系で行ったところ、バッチ系より反応性が高まったため、どちらの芳香環も水素化された(式(3))。以上のように、保護基の有無や反応系を変えることで、三種類の選択性を自在に制御することができた。
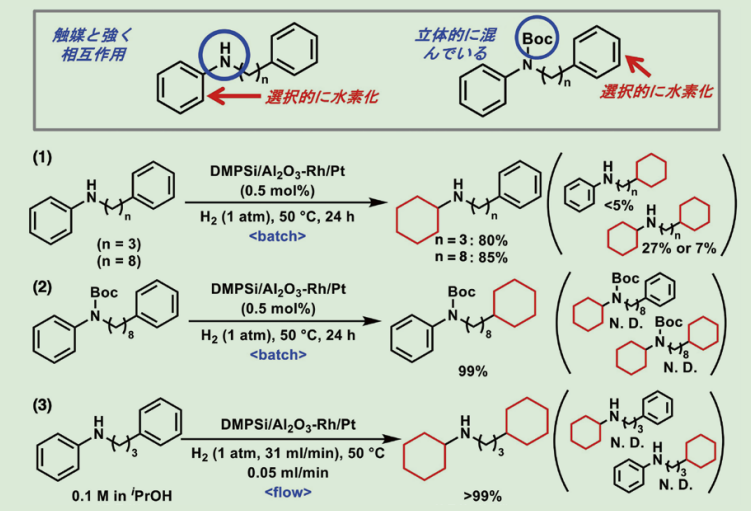
Scheme 2.同一分子内に存在する2つの芳香環の選択的水素化
さらに、このような選択的な芳香環水素化反応を実際の医薬品原体(API)合成に応用した(Scheme 3)。安価な原料からアルドール縮合によって合成可能な基質 3 は、4つの水素化されうる官能基を有する(ピリジン環、オレフィン、ケトン、1,2- ジメトキシベンゼン環)。Rh-Pt/(DMPSi-Al2O3)触媒を用い、水素化反応を行ったところ、ピリジン部位とオレフィンのみが選択的に還元された化合物 5 が優先的に得られた。
これまで報告されている文献によると、化合物 6 や 7 が副生成物として得られ、その選択性の制御が困難であったが 8)、Rh-Pt/(DMPSi-Al2O3)触媒を用いた場合はこれらの副生成物は生成しなかった。化合物 5 は触媒を除去することなく、引き続きワンポットでのベンジル化反応を行うことで、API である Donepezil(4)を 87%(2段階)で得ることができた。
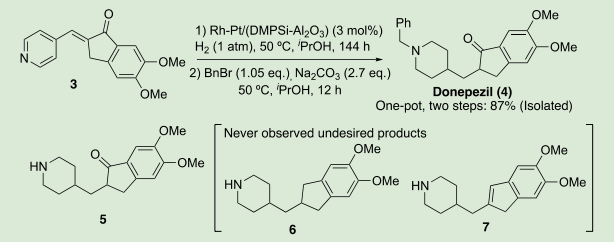
Scheme 3.Donepezil のワンポット合成
おわりに
以上のように、我々は芳香族化合物の水素化に有効な、白金/ロジウム二元金属ナノ粒子をポリシラン/アルミナ複合担体に固定化した触媒(Rh-Pt/(DMPSi-Al2O3))を開発した 9)。本触媒は、トルエンを始めとする芳香族炭化水素やピリジン等のヘテロ芳香環の水素化反応において、穏和な条件下(無溶媒、1気圧水素、50-80℃)で高い活性を示した。
カラムに本触媒を充填し、基質と水素を流通させることで反応を行う連続フロー反応を行ったところ、バッチ反応に比べ大幅な触媒回転速度の向上が確認され、50 日を超える連続反応においても触媒活性の低下は見られなかった。さらに、同一分子内に二種類の異なる環境に存在する芳香環を持つ基質において、本触媒を用いることで選択的に片方、もしくは両方を水素化できることを見出した。
キーワード
TOF(触媒回転頻度)
一つの触媒サイトにおいて単位時間あたりに生成物に変換できる分子数の最大値である。触媒の最高効率を表す。
TON(触媒回転数)
触媒が不活性化する前に、触媒1モルあたり(または触媒サイト1モルあたり)変換できる物質のモル数(または分子数)である。触媒の安定性(寿命)を表す。
触媒毒
触媒と作用してその性能を低下させる物質。
参考文献
- (a) Kobayashi, S. et al. : Aldrichimica Acta, 46, 3 (2013).
(b) Kobayashi, S. et al. : Chem. Rec., 10, 271 (2010). DOI: 10.1002/tcr.201000026 - (a)Oyamada, H. et al . : Chem. Commun., 4297 (2006). DOI: 10.1039/B610241G
(b)Oyamada, H. et al. : Org. Biomol. Chem., 6, 61 (2008). DOI: 10.1039/B715220E
(c)Ueno, M. et al. : Chem. Commun., 1647, (2008). DOI: 10.1039/B715259K - Kobayashi, S. et al. : ChemCatChem, 7, 4025 (2015). DOI: 10.1002/cctc.201500973
- (a)Alhumaidan, F. et al. : Energy Fuels, 25, 4217 (2011). DOI: 10.1021/ef200829x
(b)Qi, S.-C. et al . : RSC Advances, 3, 14219 (2013). DOI: 10.1039/C3RA40848E
(c)Schröder, F. et al . : Tetrahedron, 54, 5259 (1998). DOI: 10.1016/S0040-4020(98)00223-3
(d)O'Hagan, D. : Nat. Prod. Rep., 17, 435 (2000). DOI: 10.1039/A707613D
(e)Ouchi, T. et al. : Org. Process Res. Dev., 18, 1560 (2014). DOI: 10.1021/op500208j - (a)Baker, R. H. et al. : J. Am. Chem. Soc., 69, 1250 (1947). DOI: 10.1021/ja01198a005
(b)Kitching, W. et al. : J. Org. Chem., 47, 5153 (1982). DOI: 10.1021/jo00147a022
(c)Widegren, J. A. et al. : J. Mol. Catal. A Chem. , 191, 187 (2003). DOI: 10.1016/S1381-1169(02)00125-5
(d)Eliau, N. et al. : J. Sol-Gel Sci. Technol., 35, 159 (2005). DOI: 10.1007/s10971-005-1403-4
(e)Motoyama, Y. et al . : Chem. Lett., 35, 876 (2006). DOI: 10.1246/cl.2006.876
(f)Park, I. S. et al. : Adv. Synth. Catal., 349, 2039 (2007). DOI: 10.1002/adsc.200600651
(g)Park, K. et al. : Angew. Chem., Int. Ed. Engl., 46, 1152 (2007). DOI: 10.1002/anie.200603961
(h)Takasaki, M. et al . : Chem. Asian J. , 2, 1524 (2007). DOI: 10.1002/asia.200700175
(i)Rossi, L. M. et al . : J. Mol. Catal. A Chem., 298, 69 (2009). DOI: 10.1016/j.molcata.2008.10.007
(j)Savoia, D. et al. : Synthesis, 2009, 2440 (2009). DOI: 10.1055/s-0029-1216852
(k)Yoon, B. et al . : J. Phys. Chem. C, 113, 1520 (2009). DOI: 10.1021/jp809366w
(l)Hubert, C. et al . : Green Chem., 12, 1167 (2010). DOI: 10.1039/C004079G
(m)Zahmakiran, M. et al . : Chem. Commun.(Camb.)., 46, 4788 (2010). DOI: 10.1039/c0cc00494d
(n)Champness, N. R. : Dalton Trans ., 40, 10311 (2011). DOI: 10.1039/C1DT11184A
(o)Hubert, C. et al . : Green Chem ., 13, 1766 (2011). DOI: 10.1039/C0GC00931H
(p)Yan, N. et al. : Chem. Commun.(Camb.)., 47, 2529 (2011). DOI: 10.1039/C0CC04641H
(q)Zieliński, M. et al. : ChemCatChem, 3, 1653 (2011). DOI: 10.1002/cctc.201100061
(r)Snelders, D. J. M. et al. : ACS Catalysis, 2, 201 (2012). DOI: 10.1021/cs200575r
(s)Zahmakiran, M. et al . : Langmuir, 28, 60 (2012). DOI: 10.1021/la2044174
(t)Niembro, S. et al. : New J. Chem., 37, 278 (2013). DOI: 10.1039/C2NJ40859G
(u)Das, P. et al. : New J. Chem., 40, 2850 (2016). DOI: 10.1039/C5NJ03030G
(v)Hattori, T. et al. : Eur. J. Org. Chem., 2015, 2492 (2015). DOI: 10.1002/ejoc.201500050
(w)Maegawa, T. et al. : Chem. Eur. J., 15, 6953 (2009). DOI: 10.1002/chem.200900361 - Oyamada, H. et al. : Beilstein J. Org. Chem., 7, 735 (2011). DOI: 10.3762/bjoc.7.83
- Irfan, M. et al. : Eur. J. Org. Chem., 2009, 1327 (2009). DOI: 10.1002/ejoc.200801131
- Elati, C. R. et al. : Synth. Commun., 36, 169 (2006). DOI: 10.1080/00397910500334231
- Miyamura, H. et al. : J. Am. Chem. Soc., 140, 11325 (2018). DOI: 10.1021/jacs.8b06015




