【総説】マリントキシン研究の楽しみ
本記事は、和光純薬時報 Vol.88 No.4(2020年10月号)において、東北大学名誉教授、一般財団法人日本食品分析センター顧問 安元 健様に執筆いただいたものです。
今回、富士フイルム和光純薬の好意によって筆者のライフワークである「海洋生物毒研究」を紹介する機会を得ました。海洋生物毒には多彩な顔があります。化学構造や薬理作用の解明、食品衛生・公衆衛生面への対策、生態・生物学的意義の解明等があります。
筆者の最大の関心事は「毒の化学構造」ですが、毒化の真犯人「=毒の生産者」を見つけ出す過程も楽しい作業でした。微小生物が毒を生産し、食物連鎖によって拡散するように、研究対象の毒も次々と繋がっていきました。
本誌は専門的成果を述べる学術研究誌ではないので、筆者の個人史を含めた天然物化学の一面を伝える読み物として提供したいと考えました。
1.「シガテラ、Ciguatera」
高校3年の最後の夏休みに漁師と交わした「酔う魚」についての会話が、筆者の「マリントキシン研究」のすべての始まりでした。
夏休みを満喫しようと友人と諮って沖縄北端の小さな離島、伊平屋島を訪ね、連日のように海で泳いだり魚を釣ったりして遊びましたが、潮の流れなどの海の状況を知るためにたびたび漁師を訪ねました。その際に聞く、魚の種類や習性に纏わる豊富な話題は楽しみでした。
中でも「酔う魚」の話には大いに興味をそそられました。まず、中毒に際して使う通常の表現は「魚に当たった」です。それを「酔う」と表現するのは体がだるく、節々が痛み、二日酔いに似る状態なので「酔う」と表現すると説明されました。特に奇妙なことは水に触れると感電したような痛みが走ることでした。中毒は特定の魚種に限定されず多くの種類で酔い、鮮度は問題ないが極地性があって、毒化地域は時々移動するとのことです。
後日、この症状はカリブ海、インド洋、太平洋のサンゴ礁海域で多発する特異な中毒「シガテラ」中毒と判明しました。新大陸に渡航する多くの船がカリブ海で停泊すると、新鮮な魚を喜んで食べた船員に中毒が多発しました。原因は解明されないままにコロンブス以来のミステリアスな中毒として知られ、第二次世界大戦の際に太平洋に展開した日米兵士の多数が中毒して一気に関心が高まりました。
1-a.「毒化原因」
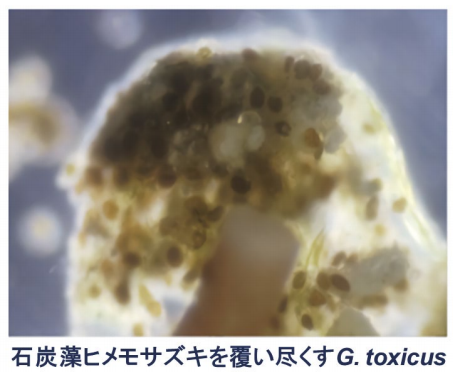
図1.石灰藻ヒメモサズキ上に密生する G. toxicus
毒化魚はフグのような種特異性がなく、個体差や地域差も大きいので餌由来の毒と考えられました。しかし、毒を生産する生物や、毒の化学的性質などは全く不明でした。1950年代後半から仏領ポリネシアでは観光基地あるいは軍事基地として島の開発が進みましたが、それに伴って中毒は爆発的に増加しました。
そこで、沖縄で「酔う魚」の調査を行った経験のある筆者がWHOの顧問に招かれて仏領ポリネシアに派遣されました。餌由来の毒を想定していたので、まず最初に魚の消化管内容物の顕微鏡観察と毒性試験を実施し、胃中に出現する円盤状単細胞生物が魚の毒性と高い相関を示すことを見出しました。
毒性が特に高かったガンビエル諸島では、滑走路や航路開設のために土木工事が行われ、土砂のために大部分のサンゴが死滅し、石灰藻で覆われていました。その石灰藻の表面を例の円盤状生物が覆うように生育していました(図1)。
この生物は渦鞭毛藻と呼ばれる単細胞生物で新属新種でしたので採集地、円盤状の形状、毒性に因んで Gambierdiscus toxicus と命名しました。海底から採集した G. toxicus と有毒魚から抽出・精製した成分がNMRの比較でこれらが同一基本骨格と判定できたので、毒の起源(Ciguatoxin、CTX)と同定できました。
採集した株は培養でCTXを生産しなかったため、有毒株を求めて再度仏領ポリネシアに赴き、有毒株を探しましたが、その間に8年が経過しました。G. toxicus は広く分布していますが、現在、CTX生産株は世界でも数株しか知られておらず、培養による毒の供給にとってて隘路となっています。
1-b.「化学構造」
多くの魚種が毒化しますが、食物連鎖の頂点に位置するのはウツボです。その内蔵に高濃度のCTXが蓄積するので抽出原料に最適でした。個体差と地域差が大きいので、有毒固体 4t を収集するのに10年を費やしました。内蔵 124kg からは 0.4mg のCTXが得られました。
NMRを駆使して解明した構造を図2に示します。CTXは基本骨格の環構成が異なる CTX1B 型とCTX3C 型があり、いずれも食物連鎖を移行する間に代謝的修飾を受けます。LC-MS 定量用の標準品として、5成分を qNMR で値付けしましたが、市販するだけの量は確保できず、必要に応じて関係諸機関に提供しています。また、LC-MS による定量に取り組み、魚肉中 0.01ppb という極めて厳しい基準値をクリアできています。
平間正博東北大学名誉教授のグループは CTX1B 及び CTX3C の全合成の偉業を達成しています。また、大阪府立大学の円谷健教授のグループは、分子両端の部分構造合成品を使用して、サンドウィッチ ELISA を完成しています。
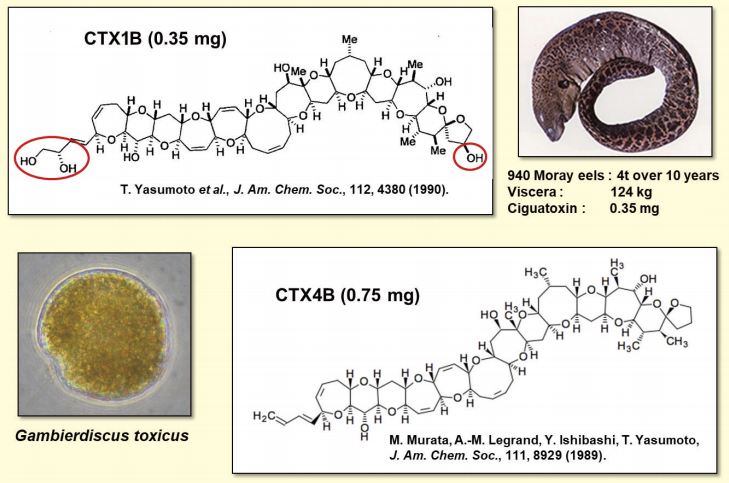
図2.ウツボから得た主成分 CTX1B とG. toxicus が生産する CTX4B
1-c.「作用」
CTX は電位依存性 Na+ チャネルに結合して脱分極から分極状態への復帰を阻害します。CTX1B の化学構造を図 2 に示します。マウス腹腔内投与による最小致死量(0.4μg/kg)はフグ毒テトロドトキシンを 25 倍上回っています。経口摂取による推定最小発症量はヒト成人で 7ng でした。この強い毒性ため魚肉中の許容濃度は 0.01ppb という非常に低い値が設定されていますので、測定は容易ではありません。
1-d.「マイトトキシン」
サンゴ礁で普通に見かける小型魚のサザナミハギは捕獲しやすいことと、皮下脂肪が焼いたときに香ばしいためにタヒチでは愛好されています。タヒチにおけるシガテラの原因の 60% 以上を占めていたこともあります。肉食魚のハタやウツボに比べて中毒症状が軽微なことも好んで食された理由です。
サザナミハギで代表される藻食魚と食物連鎖上位の魚との間に見られる中毒症状の違いが、原因毒組成の違いに由来するのではないかとかねてから指摘されていました。筆者はサザナミハギの消化管内容物には CTX 群以外に極性の高い別種の成分があることを明らかにして、サザナミハギのタヒチ名「maito、マイト」に因んで「Maitotoxin、MTX」と命名しました。
その後 G. toxicus の培養に成功し、藻体から単離して化学構造を解明できました(図3)。ペプチドや多糖類のような単位構造の繰り返しを持たない天然物としては最大かつ最も複雑な化合物です。その活性(マウス腹腔内投与毒性、溶血活性)も少数の細菌毒素を除くと類を見ない強烈な値です。経口毒性は弱いと考えられていますが、中毒への実際の寄与は不明です。
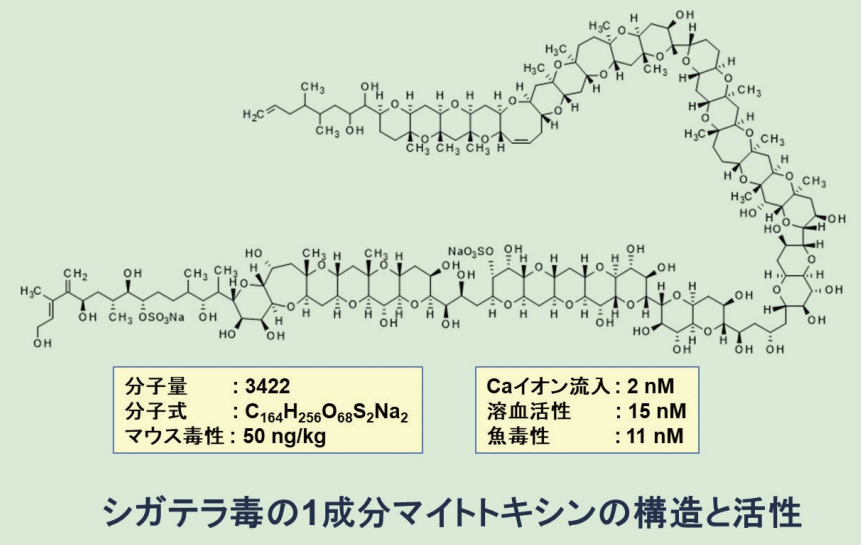
図3.マイトトキシンの化学構造
薬理活性に関する初期の研究は大泉康東北大学名誉教授によって活発に行われました。ラット副腎皮質(PC12細胞)、その他の細胞を用いて、MTXが細胞外Ca2+の流入を招き、Ca2+非存在下では活性を示さないことを見出しました。MTXにイオノフォア活性はなく、ベラパミルなどのCa2+遮断剤では完全には遮断されませんでした。
Na+ を介する活性もないので、未知のCa2+チャネルを活性化している可能性が指摘されました。NIH の故 John Daly 博士らはさらに多様な細胞系を用いて実験し、Ca2+チャネルを有しない細胞も含めてあらゆる細胞系でCa2+の流入をもたらすことを明らかにして、Ca2+が誘起する細胞現象の解明に有用であると指摘しました。しかし、MTXのその後の供給が途絶え、Daly氏も逝去されたのでその後の解明は進んでいません。
また、筆者らが培養したMTX生産株は筆者の退官後に死滅しました。硫酸エステルが脱離したMTXが最近報告されましたが、MTX生産株は誰も得ることができずにいます。特異なチャネル発見に有力な化合物だけに供給が継続されることを願っています。
2.シガテラから発生したマリントキシン研究
2-a.フグ毒(Tetrodotoxin)の細菌起源
フグ毒(Tetrodotoxin、TTX)は我が国のみならず世界で最も良く知られたマリントキシンです。長年、フグが生産していると考えられていましたが、筆者はシガテラの研究の際に外部起源であることに気づきました。多くのサンゴ礁魚についてCTX や MTXの分布を調べた際に、フグ科ではない熱帯魚のサザナミヤッコやナンヨウブダイ内蔵に水溶性の急性毒が出現し、フグ毒によく似た症状でマウスを殺すことに気づきました。
後日、TTX 蛍光分析装置を自作して分析し、TTX に一致することを確認しました。東北大学の地元、宮城県産のフグでも TTX 含量は顕著な地域差を示しました。更に、フグには TTX と異なるマヒ性貝毒のサキシトキシン(Saxitoxin、STX)が共存することが多く、両毒の比率は地域によって大きく異なりました(図4)。このことから TTX はシガテラの CTX と同様に食物連鎖を介して蓄積したと推定して、起源を探る研究を開始しました。
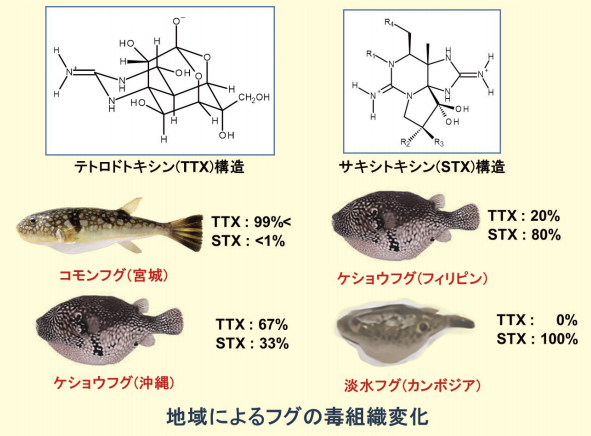
図4.フグに出現する TTX と STX の地域変化
シガテラの発生する南西諸島やフィリピンではオオギガニ類が TTX を蓄積します。胃中に出現する石灰藻のヒメモサズキを分析して TTX の存在を確認しました。しかし、含量には地域差と季節差が大きいので、石灰藻への付着生物、細菌の可能性を疑い、細菌を分離・培養して2種の TTX 生産細菌を確認しました。細菌が起源であれば、多くの生物に移行・蓄積することが説明できます。近年ではEU諸国で養殖2枚貝の消化管に TTX が検出され、TTX 生産菌も分離されています。
低濃度とはいえ TTX の存在は食品衛生上の問題とされます。検出・定量には LC-MS が使用されますので、定量用標準品の作出が要望されています。TTX は吸湿性が強く正確な秤量は困難です。qNMRを適用する際には TTX がヘミラクタール型と10,7- ラクトン型との平衡混合物であり、2 組のシグナルを与えること、その比率は pH や温度で変化することに留意する必要があります。TTX と同時に出現する同族体群の同定・定量用標準品の作成も必要ですが、達成は容易でなく大きな課題です。
2-b.パリトキシン類縁体の発見と起源の考察
パリトキシン(Palytoxin、PLTx、C129H223N3O54)は、ハワイ大学のD. Moore 教授と名古屋大学の故平田義正・上村大輔教授グループの日米研究者の競演によって構造が解明され、当時知られた最も複雑かつ猛毒の化合物として脚光を浴びました。さらに、構造決定後の時を経ずして発表された岸義人教授による全合成は驚きと賞賛で迎えられました。
PLTx はハワイで猛毒な海藻(実際は海藻ではなかった)についての伝承に基づいてスナギンチャクから発見されました。海岸の 30m 程度にごく狭いリーフの割れ目に生育するスナギンチャクだけが猛毒を有するとされていて、局地的な毒性変化の大きさは PLTx の外部起源を示すと考えられました。真の生産者が何であるかが問題とされてきました。その後、筆者を含む多くの研究者によって PLTx と同族体が多様な生物から検出されています。
PLTx とシガテラ研究の接点は G. toxicus の発見にありました。G.toxicus は浮遊性のプランクトン生活をする大多数の渦鞭毛藻とは異なって、海藻表面に付着生育する珍しい生態を示します。G. toxicus の分布調査を行った際に多種の海藻付着性渦鞭毛藻を多数観察しました。
その一種、Ostreopsis siamensis は G. toxicus に大きさと形状が酷似していました。培養して毒の本体を Ostreocin と名付けて化学構造を調べたところ、思いがけなくパリトキシンの類縁体と判明しました。さては PLTx の起源は渦鞭毛藻であろうかと期待しましたが化学構造の一部、メチル基と水酸基が異なっていました。
その後、地中海で近縁種の Ostreopsis ovata が繁殖して海水浴客に健康被害が発生しました。二枚貝への蓄積も明らかになり、公衆衛生・食品衛生上の重大問題とされています(毒本体は Ovatoxin と命名された)。
化学構造から見る限り Ostreocin 類と Ovatoxin 類はメチル基や水酸基が異なっているので PLTx の直接の前駆体ではありません。スナギンチャクには細菌、藍藻、渦鞭毛藻など多様な微小生物が共生しています。恐らく、共生藍藻が PLTx を生産すると思われますが、海産藍藻の培養は非常に困難なので起源の問題を完全に解決するのは当面困難です。
なお、生化学・薬理学試験では PLTx が多用されてきましたが、有毒スナギンチャクの大量採取や PLTx の精製は極めて困難なので、将来の補給が心配です。
2-c.下痢性貝毒とオカダ酸
1976 年に東北沿岸で二枚貝を原因とする下痢症が多発し、我々は下痢性貝毒(Diarrhetic shellfish poisoning、DSP)と名付けました。ほぼ同時期にEUでも同様な下痢症が多発し、スペインやフランスで数千人規模の観光客がバカンス先の海岸で被害に遭いました。
現在では DSP はマヒ性貝毒に次ぐ重要な貝毒とされています。貝毒を精製して NMR スペクトルを初めて見たときに驚きました。タヒチで採集した底性渦鞭毛藻、Prorocentrum lima の有毒成分である海綿動物から得られた薬理活性成分として有名なオカダ酸(Okadaic acid、OA)に酷似していたのです(図5)。OA は Ca2+ 非存在下で平滑筋の収縮を招くことで注目されていました。我々が実際に貝から単離した化合物は 35- メチルオカダ酸でした。同時に Prorocentrolide と名付けた環状イミンも同定しました。
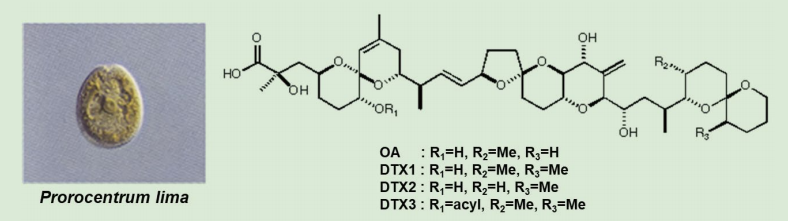
図5.底生渦鞭毛藻のP. lima はオカダ酸類を生産する
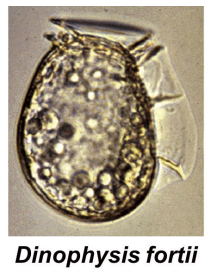
図6.下痢性貝毒の主要原因プランクトン D. fortii
面白いことに、研究室恒例の夏休みで三陸沿岸の民宿に滞在した際に茹でたムラサキイガイをビールのつまにして食べたところ下痢をした事件がありました。腸炎ビブリオ菌の汚染を疑って茹でる時間を十分にとっても下痢をしました。そこで化学物質原因を疑い、この中毒を「下痢性貝毒」(DSP)、原因毒を Dinophysistoxin と名付けて追及しました。その結果、図5に示す 35-メチルオカダ酸(DTX1)が同定されました(図5)。
毒の起源は渦鞭毛藻の Dinophysis fortii(図6)と決定できたことが毒を Dinophysistoxin-1(DTX1)と命名した理由です。D. fortii は実際に毒を生産せず、さらに微小な藻類を摂食して OA、DTX1 を蓄積します。培養が可能なP. lima は OA と DTX1 の両成分を生産しますので、LC-MS 定量用の標準品はP. lima の培養で生産されます。遥か南のシガテラ研究が足元の三陸沿岸の食中毒と繋がったのは意外でした。
おわりに
マリントキシンは強力かつ特異的な活性を有するので生化学・薬理学試薬あるいは食品・公衆衛生監視試薬として重要です。抽出原料となる有毒魚介の入手は極端に困難ですが、近年の各種分析手段の進歩によって、本稿に述べたマイトトキシンのような超微量な試料でも活用の機会が得られるのは喜ばしいことです。
参考文献
- Yasumoto, T. : Chemical Record, 1, 228 (2001). doi: 10.1002/tcr.1010
- Yasumoto, T. : Proc. Japan Acad. Ser. B., 81, 43 (2005). doi: 10.2183/pjab.81.43
- Yasumoto, T., Nagai, H., Yasumura, T., Michishita, T., Endo, A. and Yotsu, M. : Ann. N.Y. Acad. Sci., 479, 44 (1986). doi: 10.1111/j.1749-6632.1986.tb15560.x
- Takahashi, M., Ohizumi, Y. and Yasumoto, T. : J. Biol. Chem., 257, 7287 (1982). doi: 10.1016/S0021-9258(18)34371-0
- Gusovsky, F. and Daly, J. : Biochem. Pharmacol., 39, 1633 (1990). DOI: 10.1016/0006-2952(90)90105-t
- Yokoyama, A., Murata, M., Oshima, Y., Iwashita, T. and Yasumoto, T. : J. Biochem., 104, 184 (1988). DOI: 10.1093/oxfordjournals.jbchem.a122438
- 上村大輔、平田義正:現代化学,145,14 (1983).
- Moore, R. E. : "Progress in the chemistry of Organic Natural Products .", SpringerVerlag, Wien/New York, Vol. 48, p. 81 (1985).
- Usami, M., Ishibashi, S., Inoue, A., Kan, Y. and Yasumoto, T. : J. Am. Chem. Soc., 117, 5389 (1995). DOI: 10.1021/ja00124a034
- Yasumoto, T., Murata, M., Oshima, Y., Matsumoto, G. and Clardy, J. : "Seafood toxins, ACS Symposium series.", American Chemical Society, Washington, Vol. 262, p. 207 (1984).




