【総説】医薬品・再生医療等製品向け原材料 国産ウシ多血小板血漿由来血清「NeoSERA®」の開発
本記事は、和光純薬時報 Vol.86 No.3(2018年7月号)において、兵庫医科大学 先端医学研究所 医薬開発研究部門 濵田 彰子 様、山原 研一 様、株式会社ジャパン・バイオメディカル 高田 竜治 様、須藤 稔太 様に執筆いただいたものです。
はじめに
我々はヒト羊膜由来間葉系幹細胞(以下、羊膜 MSC)の製剤化と急性 GVHD(移植片対宿主病)およびクローン病に対する医師主導治験を実施中である(UMIN 試験 ID UMIN000029945、UMIN000029841)。治験向けの羊膜 MSC 製剤の製造には、MSC の培養に汎用される胎児ウシ血清(Fetal Bovine Serum: 以下、FBS) と比べ、安全性・安定性・品質を高めた、我々が独自に開発した国産ウシ多血小板血漿「NeoSERA®」を使用している。
本稿では、NeoSERA®の開発経緯とその特徴、使用上の注意点を中心に概説する。
NeoSERA® の開発背景:医薬品・再生医療等製品向け国産ウシ血清の復活
ウシ血清の中でも FBS は、ワクチン製造など細胞培養技術を用いて製造される医薬品等向けを含め、細胞培養用添加剤のスタンダードとして汎用されている。一方、1980 年代後半英国の報告から始まった牛海綿状脳症(Bovine Spongiform Encephalopathy:以下、BSE)の発生は、2001 年の我が国における BSE 発症を契機に、2003 年医薬品等の安全性を確保するため、当該生物由来原料に対して細菌やウイルス等の安全性確保のための基準(「生物由来原料基準」(平成 15 年 5 月 20 日厚生労働省告示第 210 号))が定められることとなった。
同基準では、医薬品等向けの反すう動物に由来する原材料に関し、欧州の地理的 BSE リスク評価に基づき、原産国が規定された。この結果、BSE が発症した我が国は原産国として含まれず、我が国における細胞培養用途のウシ血清の製造が途絶えることとなった。
その後の世界における BSE 発生であるが、1992 年の 37,316 頭をピークに、発生経路となる飼料の規制強化等により発生頭数は大幅に減少し、2016 年には年間 1 頭の発生まで減少しており(国際獣疫事務局:以下、OIE、"Number of reported cases of bovine spongiform encephalopathy(BSE)in farmed cattle worldwide"2016/3/25)、BSE のリスクは世界的に大幅に低下している。
2013 年 5 月 OIE により日本や米国等が新たに BSE の「無視できるリスク国」に指定され、2014 年生物由来原料基準の改定(平成 26 年 9 月 26 日厚生労働省告示第 375 号)において、反すう動物由来原料等の原産国を OIE の指定する BSE が「無視できるリスク国」、となったことから、国産のウシ血清が医薬品等の原材料に使用できる状況となっている。
現在我が国ではジェイス、ジャック、テムセル HS 注、ハートシートの 4 つの再生医療等製品が販売され、いずれもウシ血清を使用して培養されている(承認資料概要 参照:http://www.pmda.go.jp/review-services/drug-reviews/review-information/ctp/0002.html)。
この理由は、FBS が細胞培養用添加剤のスタンダードであることに加え、細胞培養のコストが無血清培地よりも低額であることも理由である。しかしながら、FBS は不特定多数の胎児ウシの血液抽出物であることから、①BSE の原因プリオン混入のリスクがある、②ロット差がある、③細胞増殖性に劣ることがある、といった、①安全性、②安定性、③品質における問題点が以前から指摘されている。また、胎児ウシからという、倫理的に大きな問題のある手法により採取されている。
これらの背景を踏まえ、我々は国産成牛の血液を加工することにより、①安全、②安定、③高品質な、医薬品・再生医療等製品向け血清の開発に乗り出した。ヒト血液由来の多血小板血漿(platelet-rich plasma、以下 PRP)は増殖因子を豊富に含むことから、ヒト細胞、特に MSC の培養用添加剤としての使用が多数報告されている 1)。これをヒントに、我々は成牛から多血小板血漿を抽出し、血清化処理を施した NeoSERA® の開発に成功した(特許第 6212723 号)。
NeoSERA® の安全性に関しては、獣医による定期的な健康確認を受け、管理された成牛から採取された血液を原料として製造することで完全なトレーサビリティを実現し、また、米国 USDA 規制 9CFR § 113.450 および欧州 EMEA 規制 EMEA/CVMP/743/00 に従い、ウイルス不活化を含む滅菌を目的に 30kGy 以上のγ線照射を実施しており、生物由来原料基準の規定を満たす安全な細胞培養用血清である(平成 29 年 4 月 17 日 医薬品医療機器総合機構 再生医療等製品材料適格性確認書取得 薬機審長発第 0417002 号)。
また、安定性に関しては、単一プロトコルにて、少数の成牛からの繰り返し採血から得られた PRP をプールした上で分注製造することにより、ロット間差を最小限にしている。
NeoSERA® の性能
NeoSERA® の主原料である PRP は、platelet-derived growth factor (PDGF)、transforming growth factor β (TGFβ)、vascular endothelial growth factor (VEGF)、epidermal growth factor (EGF) 等を含む増殖因子が豊富に含まれており 2)、細胞培養用添加剤として相応しい組成と考えられる。
そこで、再生医療分野で広く検討されているヒト由来 MSC、ワクチン製造に汎用されている細胞株について、NeoSERA® の性能に関し FBS と比較検討した。
≪ヒト由来 MSC における NeoSERA® による増殖性≫
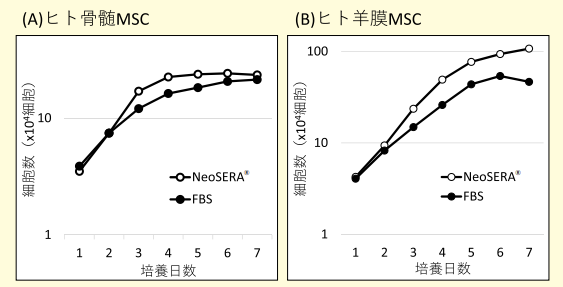
ヒト骨髄 MSC およびヒト羊膜 MSC において、NeoSERA® および FBS をそれぞれ 10% 添加した αMEM にて培養し、増殖曲線より倍加時間を算出した。培養 7 日目の培養写真を図 1、増殖曲線をグラフ 1、増殖曲線より算出した倍加時間を表 1 に示す。
ヒト骨髄 MSC およびヒト羊膜 MSC の培養写真(図 1(A)(B))において、FBS および NeoSERA® で培養した細胞の形態に明確な差は認めなかった。増殖曲線(グラフ 1)および倍加時間(表 1)の結果から、ヒト骨髄・羊膜 MSC の培養において、NeoSERA® は FBS よりも高い増殖性を有することが示されたことから、細胞製剤化におけるメリットである、短時間で多くの細胞を得ることが期待される。
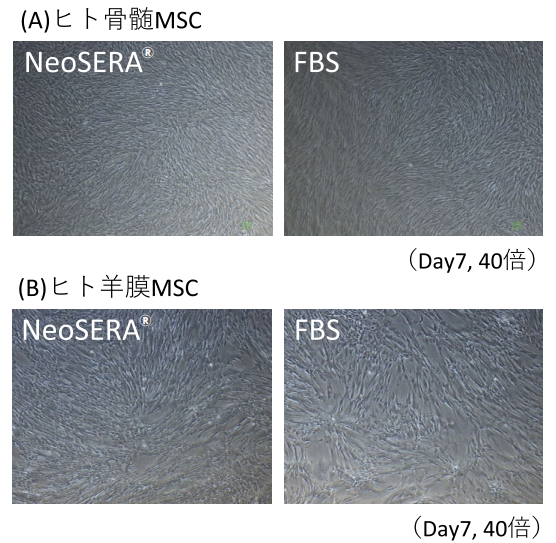
図1.
(A)ヒト骨髄 MSC 培養写真(NeoSERA®、FBS:それぞれ 40 倍)(B)ヒト羊膜 MSC 培養写真(NeoSERA®、FBS:それぞれ 40 倍)
グラフ1.
(A)ヒト骨髄 MSC 増殖曲線(片対数)(B)ヒト羊膜 MSC 増殖曲線(片対数)
表 1. ヒト骨髄 MSC、ヒト羊膜 MSC 倍加時間
| 細胞 | 血清 | 倍加時間(時間) |
|---|---|---|
| ヒト骨髄 MSC | NeoSERA® | 12.8 |
| FBS | 19.8 | |
| ヒト羊膜 MSC | NeoSERA® | 11.8 |
| FBS | 14.0 |
≪ワクチン製造用細胞株における NeoSERA® による増殖性≫
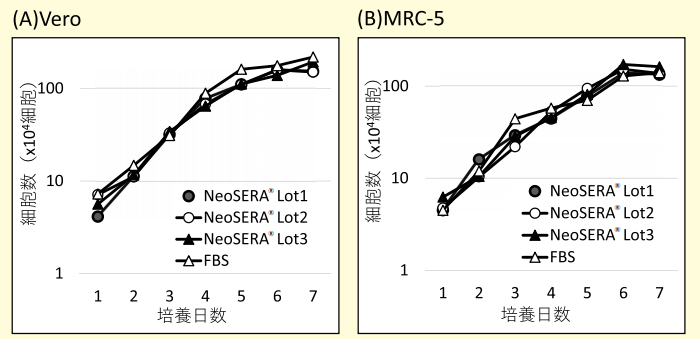
細胞バンクより入手したアフリカミドリザル腎臓由来細胞株 Vero 細胞およびヒト胎児肺由来細胞株 MRC-5 細胞において、NeoSERA® (3 ロット)および FBS を細胞株のデータシートに基づき推奨される基礎培地に添加し培養を行い、増殖曲線より倍加時間を算出した。培養 4 日目あるいは 5 日目の培養写真を図 2、増殖曲線をグラフ 2、増殖曲線より算出した倍加時間を表 2 に示す。
Vero および MRC-5 の培養写真(図 2(A)(B))において、FBS および NeoSERA® で培養した細胞の形態に明確な差は認めなかった。増殖曲線(グラフ 2)および倍加時間(表 2)の結果から、3 ロットの NeoSERA® と FBS との間に増殖性の差を認めなかった。
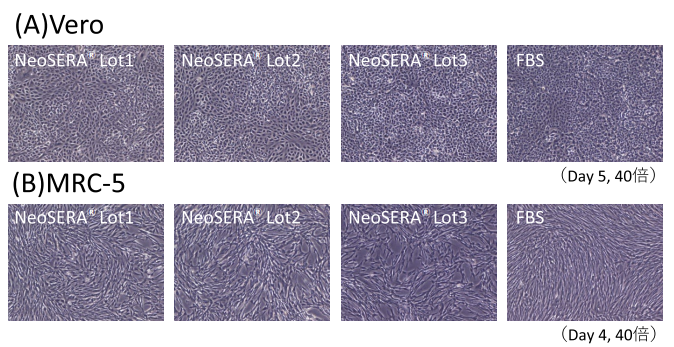
図2.
(A)Vero 培養写真(NeoSERA® 3 ロット、FBS:それぞれ 40 倍)(B)MRC-5 培養写真(NeoSERA® 3 ロット、FBS:それぞれ 40 倍)
グラフ2.
(A)Vero 増殖曲線(片対数)(B)MRC-5 増殖曲線(片対数)
表 2. Vero、MRC-5 倍加時間
| 細胞 | 血清 | 倍加時間(時間) |
|---|---|---|
| Vero | NeoSERA® Lot1 | 10.9 |
| NeoSERA® Lot2 | 10.9 | |
| NeoSERA® Lot3 | 10.8 | |
| FBS | 10.0 | |
| MRC-5 | NeoSERA® Lot1 | 13.9 |
| NeoSERA® Lot2 | 13.4 | |
| NeoSERA® Lot3 | 13.1 | |
| FBS | 12.6 |
NeoSERA® 使用上の注意点
基本的に NeoSERA® の使用に関し、注意すべき点は FBS と大きな差はない。詳細はジャパン・バイオメディカル社 HP(https://www.japan-biomedical.jp/how-to-use-neosera)を参照して欲しいが、最近しばしば受ける問い合わせが、NeoSERA® への培地変更の方法である。可能であれば初代培養より NeoSERA® の使用が望ましいが、他の培養法にて培養していた細胞を NeoSERA® に変更する場合は 3 継代程度馴化させることをお願いしている。
具体的には、①継代時に NeoSERA® に変更、あるいは②NeoSERA® の混合比率を 3 継代の間に段階的に増やす、といった方法で、細胞の性質により①または②の馴化方法を選択することを推奨する。馴化の際、細胞の増殖が速くなった場合であっても継代時の播種密度は大きく変更することなく、細胞をよく観察し、適切な継代のタイミングを決めることをおすすめしたい。
NeoSERA® の今後
細胞培養技術を用いて製造される医薬品・再生医療等製品において、NeoSERA® を原材料とすることで、製品の安全化、培養期間の短縮による低コスト化を実現できるものと考えており、我が国だけでなく世界を視野に、積極的な啓蒙活動を行っていきたい。
現在、NeoSERA® の GMP 製造化、更には豪州産の製造に取り組んでおり、近い将来、ジャパン・バイオメディカル社の新しいラインアップとして登場予定である。NeoSERA® を FBS の代替品として幅広い研究者・技術者に使用して頂き、我々にフィードバックを頂くことで、よりよい製品になるものと考えており、是非ご協力頂ければ幸いである。
参考文献
- Rubio-Azpeitia, E. and Andia, I. : Muscles Ligaments Tendons J., 4 (1), 52 (2014).
- Anitua, E. et al. : Thromb. Haemost., 91, 4 (2004). DOI: 10.1160/TH03-07-0440




