【総説】造腫瘍性を有するヒト ES/iPS 細胞の非侵襲的モニタリング技術 - ヒト ES/iPS 細胞モニタリングキットの開発 -
本記事は、和光純薬時報 Vol.85 No.2(2017年月4号)において、国立研究開発法人 産業技術総合研究所 創薬基盤研究部門 舘野 浩章 様に執筆いただいたものです。
はじめに
ヒト ES 細胞や iPS 細胞は再生医療のための細胞源として期待されている一方、造腫瘍性という大きな課題を抱えている。我々はこれまでヒト ES/iPS 細胞に選択的に結合する rBC2LCN レクチンを見出し、ヒト ES/iPS 細胞を染色して、除去する技術を開発してきた。今回、我々は培養液を用いてヒト ES/iPS 細胞の数を非破壊的にモニタリングする技術を世界で初めて開発し、実用化することに成功した。ヒト ES/iPS 細胞を用いた再生医療の安全性向上への貢献が期待される。本総説ではヒト ES/iPS 細胞モニタリングキットの開発経緯についてご紹介したい。
ヒト ES/iPS 細胞を用いた再生医療の大きな課題
ヒト ES 細胞やヒト iPS 細胞は、無限に増殖できる能力(自己複製能)や、心筋細胞や神経細胞など、あらゆる細胞に分化する能力(多能性)を持つことから、再生医療のための細胞源として世界的に大きな期待が寄せられている。特にヒト iPS 細胞は遺伝子を導入するだけで様々な体細胞から作製することができることから、再生医療のみならず、病態モデルや創薬開発などへの応用が期待されている。2015年の 9 月には加齢黄斑変性の治療を目的として、自己のヒト iPS 細胞由来の網膜色素上皮細胞を移植する臨床研究が世界で初めて実施された。
このようにヒト ES/iPS 細胞の臨床応用が進む一方で、安全性に関する大きな課題が立ち塞がる。ヒト ES/iPS 細胞から作製した移植用の細胞には、分化誘導後も尚、未分化な状態の細胞が残存し、腫瘍化する可能性があることが最大の懸念事項となっている。
ヒト(自己)iPS(様)細胞加工医薬品等の品質及び安全性の確保に関する指針(薬食発0907 第3号 2012 年 9 月 7 日)においても、「ヒト iPS(様)細胞加工医薬品等においては目的細胞以外の未分化細胞の混入を否定するための方策が最も重要な要件である。可能な限り中間製品の段階で目的細胞以外の未分化細胞の混入を否定することが望ましい」と記載されており、ヒト iPS(様)細胞加工医薬品を医療に用いる際には、残存する未分化細胞の造腫瘍性が大きな関心事になっていることが分かる。それ故、ヒト ES/iPS 細胞から作製した移植用細胞にどのくらい未分化な細胞が残存しているかを評価する技術が必要となる。
ヒト ES/iPS 細胞特異的レクチン rBC2LCN の発見
我々はこれまで細胞表面を高密度に覆う糖鎖を迅速、高感度に解析する技術としてレクチンマイクロアレイを開発してきた。ヒト ES/iPS 細胞表面も他の細胞同様に糖鎖で覆われているが、これら多能性幹細胞がどのような糖鎖構造を発現しているのかについての詳細は明らかにされていなかった。こうした中、我々はレクチンアレイを用いて計 100 種以上のヒト ES/iPS 細胞を解析した 1)。更に、質量分析計と液体クロマトグラフィーを用いて定量的な糖鎖構造解析を実施した 2)。
その結果、ヒト ES/iPS 細胞に発現する糖鎖構造を明らかにするとともに、レクチン(糖結合タンパク質の総称)の一種である rBC2LCN がヒト ES/iPS 細胞に特異的に結合することを見出した 1)。
その後、和光純薬工業との共同研究を実施し、rBC2LCN を用いてヒト ES/iPS 細胞を生きたまま染色できる試薬を開発した(非標識 rBC2LCN レクチン:2013 年 6 月、rBC2LCNFITC:2014 年 6 月、rBC2LCN-635:2014 年 12 月、rBC2LCN-547:2015 年6 月)3)。更に rBC2LCN レクチンの C 末端部分に緑膿菌由来外毒素(PE23)を融合させた組換えタンパク質(rBC2LCN-PE23:2015 年 7 月)を開発し、培養液に添加するだけで未分化細胞を選択的に殺傷除去することができる試薬を開発した 4)。
ヒト ES/iPS 細胞モニタリングキットの開発
rBC2LCN レクチンのヒト ES/iPS 細胞への結合機構を解析したところ、rBC2LCN はポドカリキシンという1 型膜タンパク質上の O 型糖鎖の一種である H タイプ 3(Fucα1-2Galβ1-3GalNAc)と呼ばれる糖鎖エピトープに結合することが分かった 5)。
面白いことに、この rBC2LCN が反応性を示すポドカリキシン(以後、rBC2LCN 陽性ポドカリキシン)が、さまざまな種類のヒト ES/iPS 細胞から培養液中に分泌されていることを見出した 6)。一方、ポドカリキシンは腎臓など他の組織にも存在するが、ヒト ES/iPS 細胞に特徴的な rBC2LCN 陽性ポドカリキシンは調べた限り通常の体細胞からは分泌されていない。すなわち、培養液中の rBC2LCN 陽性ポドカリキシンを調べることで、細胞自体を使わずに培養液を用いてヒト ES/iPS 細胞を検出できることになる。
そこでまず、rBC2LCN を ELISA プレートに固相化することにより培養液中の rBC2LCN 陽性ポドカリキシンを捕捉して、それを検出するためのプローブを探索した 6)。各種抗体やレクチンをスクリーニングした結果、O 型糖鎖に反応性を示す rABA レクチンを検出プローブとして用いることで、rBC2LCN 陽性ポドカリキシンを高感度に検出できることが分かった。
rBC2LCN レクチンと rABA レクチンの2種類のレクチンを用いたサンドイッチアッセイ系を GlycoStem 法と命名した。しかしポドカリキシンのタンパク質骨格に対して作製された各種抗体では、うまく検出することができなかった。それはポドカリキシンが多量の O 型糖鎖で覆われているため、抗体がタンパク質骨格にうまくアクセスできないためであると考えられた。その後更に本 GlycoStem 法を検証した結果、培養液中に含まれるウシ胎児血清に対して高いバックグラウンドを示すことがわかった 7)。
そこで更に、ウシ胎児血清にバックグラウンドを示さない検出抗体の探索を行った。その結果、ヒト ES/iPS 細胞に発現するポドカリキシンに提示された低硫酸化ケラタン硫酸に反応する R-10G 抗体を使用すると、ウシ胎児血清の影響を受けずに、培養液中の rBC2LCN 陽性ポドカリキシンを特異的に検出できることが分かった。
rBC2LCN レクチンと R-10G 抗体を用いたサンドイッチアッセイ系を高性能 GlycoStem 法(GlycoStem-HP 法)と名付けた。図1に GlycoStem-HP 法の概要を示す。
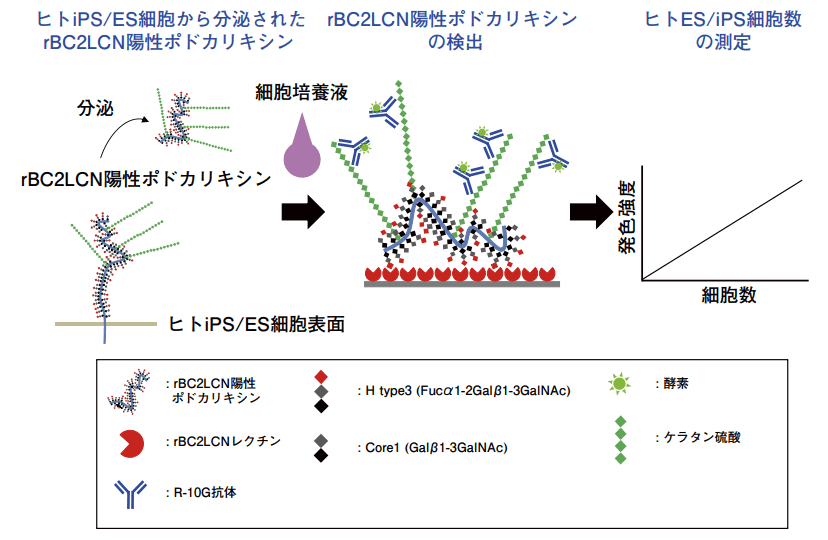
図1.GlycoStem-HP法(ヒトES/iPS細胞モニタリングキット)の概要
GlycoStem-HP では mTeSR1、TeSR-E8、StemSure® hPSC medium、mouse embryonic fibroblast-conditioned media (MEF-CM)など各種培養液で培養したヒト ES/iPS 細胞の検出に適用可能であり、その検出下限値は 0.0006-0.03% であった(図2)。
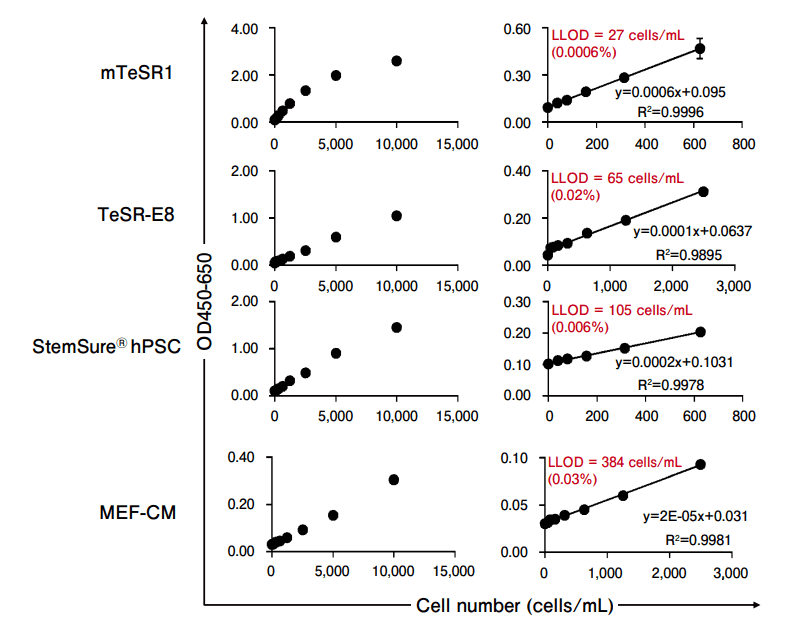
図2.GlycoStem-HP 法(ヒト ES/iPS 細胞モニタリングキット)を用いた標準曲線の作成
各種培養液で培養したヒト iPS 細胞(201B7 株)培養上清を用いた解析。ヒト iPS 細胞由来心筋細胞、及び神経幹細胞への応用
GlycoStem-HP 法が実際のヒト iPS 細胞由来の移植用細胞に適用できるかどうかについて検証した。そこで重症心不全の治療を目的として、ヒト iPS細胞由来心筋細胞を用いた再生医療を目指して研究を進めている大阪大学心臓血管外科との共同研究により、ヒト iPS 細胞から心筋細胞を分化誘導する過程における未分化細胞数の測定を行った(図3)。
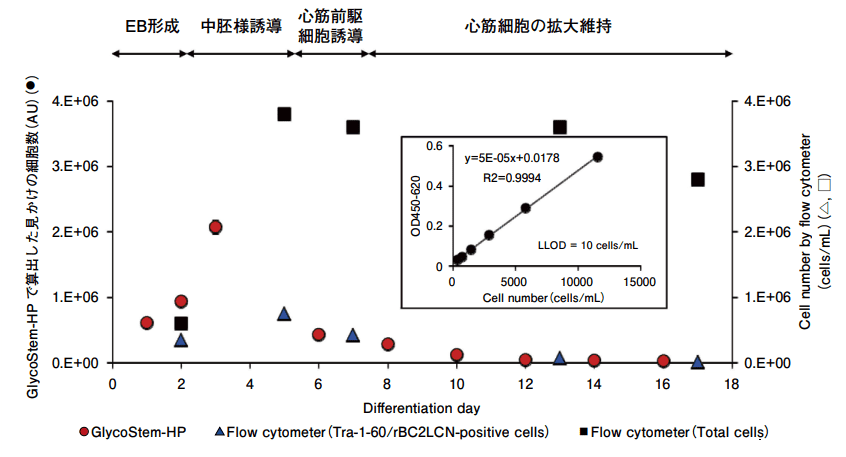
図3.GlycoStem-HP 法(ヒトES/iPS細胞モニタリングキット)を用いた心筋分化過程の未分化細胞数のモニタリング
フローサイトメーターで解析したところ、全細胞数は分化誘導後5日目に増加し、その後は細胞数に大きな変動はなかった。一方、フローサイトメーターで Tra-1-60/rBC2LCN 陽性細胞数を測定したところ、分化誘導過程で徐々に減少した。GlycoStem-HP 法で得られた見かけの細胞数(arbitrary unit, AU)も、全細胞数の増加とともに分化誘導3日後に増加したものの、その後は徐々に減少し、フローサイトメーターで算出された細胞数と類似していた。
更に脊椎損傷治療を目的としてヒト iPS 細胞由来神経幹細胞の移植を目指し研究を進めている慶應義塾大学医学部及び大阪医療センターとの共同で、ヒト神経幹細胞中に混在するヒト iPS 細胞の測定に挑戦した。その結果、GlycoStem-HP 法を用いると 0.05% のヒト iPS 細胞の混入を検出できることが分かった。
2016 年 3 月、GlycoStemHP法は「ヒト ES/iPS 細胞モニタリングキット」として和光純薬工業から実用化に至った。
おわりに
造腫瘍性試験法としては、免疫不全動物を用いた in vivo 造腫瘍性試験法に加え、未分化細胞に特異的な抗体を用いたフローサイトメトリー法、Lin28 遺伝子発現を指標とした PCR 法、Essential-8/LN521 培養増幅法などがある。これらの試験法はいずれも移植に用いる細胞の一部を検査に使用する必要があった。
今回開発した GlycoStem-HP 法の最大の利点は、貴重な移植用細胞を用いることなく、僅か 50 µL の培養液を用いて非破壊的に未分化細胞数を測定することが出来る点である。培養液で測定できるため、自動化検査装置の開発への展開も期待できる。培養液を用いて未分化細胞数を測定する技術は世界的にも他には存在しない。再生医療・細胞治療用の細胞加工品中に残存する未分化細胞の非破壊試験法としての活用が期待される。
一方注意点としては、ヒト ES/iPS 細胞の数を rBC2LCN 陽性ポドカリキシンの量で測定しているため間接的であること、また細胞や培養液の種類によって分泌量が変化することなどがあげられる。GlycoStem-HP 法は未分化細胞数を測定する新しい技術であることから様々な検証が必要であることは言うまでもない。
rBC2LCN レクチンを用いてヒト ES/iPS 細胞を染色、検出、除去する技術を開発し、実用化した(図4)。ヒト ES/iPS 細胞を用いた再生医療の実現化に貢献できるよう、これら技術の改良と検証を進めるとともに、ヒト ES/iPS 細胞に発現する糖鎖の機能についても明らかにしていきたい。
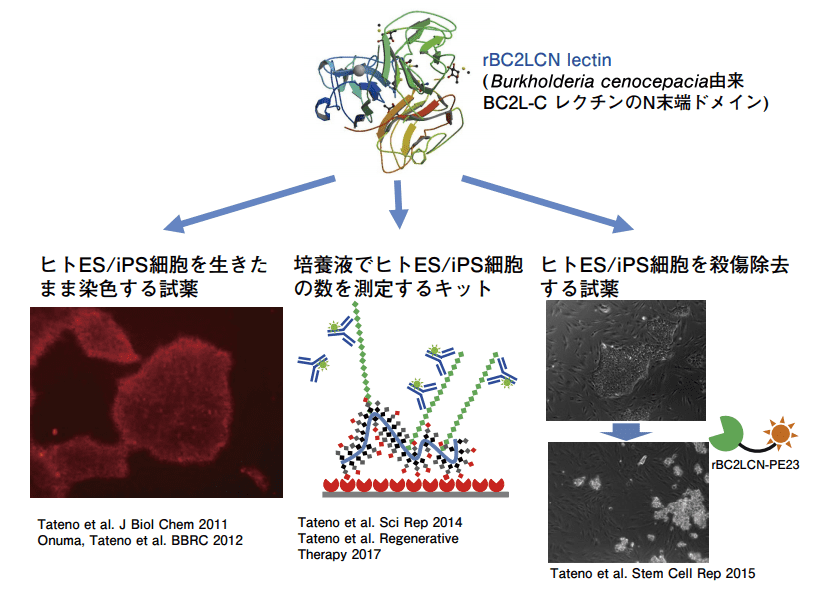
図4.rBC2LCN レクチンを用いたヒト ES/iPS 細胞の染色、検出、除去技術の開発
キーワード
レクチン
糖鎖に結合するタンパク質の総称で、ヒトからウイルスまで全ての生物に存在する。1888 年にロシアのスティルマークにより、ヒマ種子の抽出液がいろいろな動物の血球を凝集することを発見されたのが最初。特定の糖鎖に結合することから、古くから糖鎖解析のための試薬として応用されるほか、細胞間の相互作用を媒介することによりさまざまな生命現象に深く関与する機能を持つ。
rBC2LCN
グラム陰性菌 Burkholderia cenocepacia 由来のレクチン BC2L-C の N 末端ドメインの組み換えタンパク質のこと。レクチンアレイを用いた解析の結果、各種ヒト ES/iPS 細胞と反応性を示すレクチンとして同定された。培養液に添加するだけで生きたままヒト ES/iPS 細胞を染色できることから、ヒト ES/iPS 細胞染色用試薬として、未標識体や各種蛍光標識体が和光純薬工業より実用化されている。
参考文献
- Tateno, H., Toyota, M., Saito, S., Onuma, Y., Ito, Y., Hiemori, K., Fukumura, M., Matsushima, A., Nakanishi, M., Ohnuma, K., Akutsu, H., Umezawa, A., Horimoto, K., Hirabayashi, J. and Asashima, M. : J. Biol. Chem., 286, 20345-20353 (2011). DOI: 10.1074/jbc.M111.231274
- Hasehira, K., Tateno, H., Onuma, Y., Ito, Y., Asashima, M. and Hirabayashi, J. : Mol. Cell. Proteomics, 11, 1913-1923 (2012). doi: 10.1074/mcp.M112.020586
- Onuma, Y., Tateno, H., Hirabayashi, J., Ito, Y. and Asashima, M. : Biochem. Biophys. Res. Commun., 431, 524-529 (2013). DOI: 10.1016/j.bbrc.2013.01.025
- Tateno, H., Onuma, Y., Ito, Y., Minoshima, F., Saito, S., Shimizu, M., Aiki, Y., Asashima, M. and Hirabayashi, J. : Stem cell reports, 4, 811-820 (2015). DOI: 10.1016/j.stemcr.2015.02.016
- Tateno, H., Matsushima, A., Hiemori, K., Onuma, Y., Ito, Y., Hasehira, K., Nishimura, K., Ohtaka, M., Takayasu, S., Nakanishi, M., Ikehara, Y., Ohnuma, K., Chan, T., Toyoda, M., Akutsu, H., Umezawa, A., Asashima, M. and Hirabayashi, J. : Stem Cells Transl. Med., 2, 265-273 (2013). DOI: 10.5966/sctm.2012-0154
- Tateno, H., Onuma, Y., Ito, Y., Hiemori, K., Aiki, Y., Shimizu, M., Higuchi, K., Fukuda, M., Warashina, M., Honda, S., Asashima, M. and Hirabayashi, J. : Sci. Rep., 4, 4069 (2014). DOI: 10.1038/srep04069
- Tateno, H., Hiemori, K., Hirayasu, K., Sougawa, N., Fukuda, M., Warashina, M., Amano, M., Funakoshi, T., Sadamura, Y., Miyagawa, S., Saito, A., Sawa, Y., Shofuda, T., Sumida, M., Kanemura, Y., Nakamura, M., Okano, H., Onuma, Y., Ito, Y., Asashima, M. and Hirabayashi, J. : Regenerative therapy, (2016), in press.





