【連載】なるほど !! ELISA -基礎とコツ- 「第1回 ELISA とは?」
本記事は、和光純薬時報 Vol.85 No.2(2017年4月号)において、若林克己著「ELISA A to Z」をもとに株式会社シバヤギで編集し掲載いただいたものです。

ELISAは免疫学的測定法のひとつ
ELISA は抗体を使った免疫学的測定法(イムノアッセイ、Immunoassay)のひとつです。Enzyme-linked immuno-sorbent assay の頭文字をとっています。「酵素結合免疫吸着測定法」、「酵素免疫測定法」と訳されています。読み方はエライザ/エライサ/イライザ/イライサと様々ですが、エライザが多いようです。
抗体は生体にとって異物である抗原が体内に入ることによって免疫反応を起こした結果作られるタンパク質です。イムノグロブリン(Ig)に属します。イムノグロブリンにはG(IgG)、M(IgM)、A(IgA)、D(IgD)、E(IgE)のクラスがあります。イムノアッセイで使われる抗体は主として IgGです。
ELISA は、目的とする物質とだけ結合する「優れた特異的結合能」と「ごく微量の物質でも結合できる強い親和性」を持つ抗体を結合試薬として利用した測定法です。
ELISAでは抗体をどう利用するのか?
ここでは利用頻度が最も高いサンドイッチ ELISA について説明します。通常 96 ウェルマイクロプレートを使います。
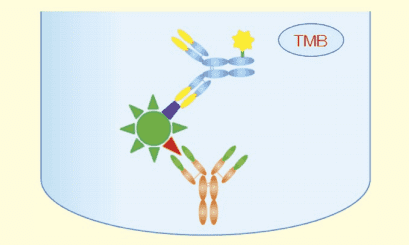
図1.
先ず、ウェルの表面に抗体を吸着させておきます(コーティング、coating とか固相化と言う)。この抗体は固相化抗体(キャプチャー抗体)と言われ、測定対象物質である抗原を捉えるために使われます。図1では都合上、抗体が1 個しか付いていないように描かれていますが、実際は数多くの抗体が吸着されています。抗体が固相化されたウェルに抗原を含む溶液(標準品、または測定試料)を加え、抗体に抗原が結合するまでの時間放置します(一次反応)。反応が終わったら余分な液を捨て、ウェルを洗います。こうすると固相化抗体に結合した抗原だけがウェルに残ります。
次に、固相化抗体が抗原を認識する場所(エピトープ)とは異なるエピトープを認識する抗体(第二抗体とか二次抗体、検出抗体と言う)を加えて、しばらく放置します。この第二抗体にはあらかじめ化学的に酵素を結合(標識)してあります。
加えられた酵素標識第二抗体は固相化抗体に結合した抗原を認識し、それに結合します。その後、余分な酵素標識第二抗体を洗い流します。
次に、酵素反応によって発色する物質(色原性基質)の溶液を加え、酵素反応を行わせると色原性基質は酵素の作用を受けて色素に変わります。
そこで反応停止液を加え酵素反応を止めてから色の濃淡を 96 ウェルマイクロプレート用の比色計で測定します。こうして固相化抗体に結合した抗原の量が色素として測定できることになります。比色定量の結果は吸光度(absorbance)として表現されるので、標準品の測定結果から横軸に抗原濃度、縦軸に吸光度をとり検量線を描きます。この検量線を用い測定試料の吸光度から試料中の抗原量を計算します。
図1に示したサンドイッチ ELISA の実施方法はもっとも基本的な方法です。酵素の分子量はかなり大きいので抗体の結合に立体障害が生じる可能性があります。また 1 分子の抗体に多くの酵素を結合させることは困難です。
そこで別なタンパクに酵素を結合させて立体障害を少なくする方法が考えられました。
下の図2のように、第二抗体はビオチンで標識します。ビオチンは分子量が非常に小さい物質です。ビオチンとはもともと生体に存在する生理活性物質ですが、これと非常に強い親和力で結合するタンパク質が卵白の中に含まれているアビジンです。このアビジンに酵素を結合させ、抗原と結合したビオチン標識第二抗体と反応させれば、立体障害を克服できます。またアビジンに結合させる酵素を増やすことにより増幅効果も期待できます。ELISA ではこのような改善方法も用いられています。
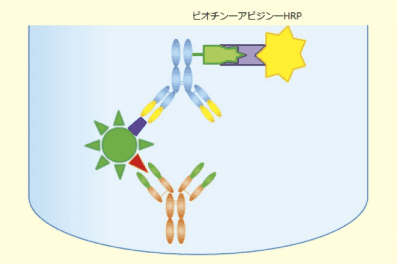
図2.
本法は、抗体-抗原-抗体の形になるので、サンドイッチ法と呼ばれています。つまり抗体がパンで抗原をハムと考えるわけです。
酵素と色原性基質
ELISA で良く用いられている酵素はペルオキシダーゼと言う過酸化水素等を基質として酸化反応を触媒する酵素です。ペルオキシダーゼにはいくつかあります。今回はHRP と呼ばれる西洋わさび(Horseradish)由来のペルオキシダーゼの主な性質を表1に要約しました。
表1.
| ペルオキシダーゼ(Hydrogen peroxidase,Horseradish peroxidase,HRP) | |
|---|---|
| 反応 | 色原性基質+ H2O2 ⇔ 酸化型色素+ 2H2O |
| 起源 | 西洋わさび(Horseradish) |
| 分子量、至適 pH | 40,000,pH 6.5 |
| 基質特異性 | 色原性基質(水素供与体)については特異性なし。 過酸化物としては H2O2,CH3OOH,C2H5OOH のみ |
| 阻害剤と活性化剤 | 阻害剤:CN-、S2-、F-、N3- (抗凝固剤として用いられるフッ素イオンと保存料として用いられるNaN3 に注意!) |
| 安定性 | 乾燥、冷蔵状態で数年間、水溶液で冷蔵 1 年間安定 |
ここでひとつご注意願いたいのは、検体に存在する可能性のある阻害剤です。ペルオキシダーゼの阻害剤は、表1にあるように CN-、S2-、F-、N3- などです。特に血液試料を採取するときに採血管がフッ素や NaN3 でコーティングされているものを使用することがあります。ELISA では検体を抗体と反応させた後に洗浄するので、阻害剤が決定的な酵素活性抑制を起こすほどではありませんが、洗浄後わずかに残存しているものが酵素をいくらかでも抑制すれば、発色の低下となって現れる可能性があります。これらの採血管は使用しないことが望ましいです。
HRP の色原性基質として使用されているのは、TMBと言われる、3,3',5,5'- テトラメチルベンジジン(3,3',5,5'-Tetramethyl benzidine)です。HRP によって過酸化水素が分解され、生じた活性酸素が TMB を酸化します。この結果できた青紫の色素は反応を停止するために加えられる硫酸酸性下では黄色になり、450nm に吸収を持つようになります。
吸光度の測定
吸光度を測るには、TMB 由来色素の吸収波長の 450nmでの吸収を測定します。ウェルの均一性や、ウェルのキズなどの影響をキャンセルするために、副波長として620nm(600 〜 650nm)の吸光度も求め、450nm の吸光度との差を真の吸光度として扱います。
吸光度とは、比色定量の基盤となる光の透過と溶液中の物質濃度との関係を示すランベルト−ベールの法則(Lambert-Beer's low)によって決められる数値のことです。
吸光度 = log10(Io/I) =εlc
Io:入射光、 I:透過光、
ε:モル吸光係数、l:吸収層(cm)、
c:濃度(M)
入射光に対する透過光の割合、即ち透過率の逆数の対数が吸光度(absorbance)になります。
例えば、光が 10% しか透過しないときには、吸光度は100/10 = 10、log10 = 1 となります。50% の透過率では、100/50 = 2、log2 = 0.301 となります。吸光度 3.0 は透過率 0.1% ということになります。プレートリーダーの性能にも寄りますが信頼できる限界付近を事前に決めておくことをお薦めします。
表2.
| 透過率(%) | 90 | 80 | 50 | 10 | 1 | 0.1 |
|---|---|---|---|---|---|---|
| 吸光度 | 0.046 | 0.097 | 0.301 | 1.000 | 2.000 | 3.000 |
次回は、「第2回 ELISA の操作法とそのポイント(前編)」の予定です。










