がん免疫研究ツール 腫瘍組織由来細胞DTC:Dissociated Tumor Cellsでできること
富士フイルム和光純薬では、外科手術によって得られた腫瘍組織を細切、シングルセルサスペンジョンした腫瘍組織由来細胞(Dissociated Tumor Cells, 以下DTC)を取り扱い・販売しています。今回は製品のご紹介とともに、腫瘍に対する免疫応答の解析、新たな免疫治療法の開発や免疫治療の効果を予測するバイオマーカーの探索を研究テーマとされている東京大学 医学部付属病院 免疫細胞治療学講座 特任教授 垣見和宏先生(以下垣見先生)に、DTCというユニークな製品について、どのような研究用途があるかご意見を伺いました。
目次
1.はじめに:DTCとは
2.DTCの期待できるアプリケーション
3.東京大学 医学部付属病院 免疫細胞治療学講座 垣見研究室の研究について
4.製品の使い方、腫瘍組織由来の細胞についてのQ&A、アドバイス
5.おわりに
1.はじめに:DTCとは
DTCは、"Dissociated Tumor Cells"という名称の製品ですが、外科手術により切除された腫瘍組織をミンスし、シングルセルサスペンションしたものを凍結した細胞ミクスチャー製品となります。
下図がベンダーの一つであるDiscovery Life Sciences社の製造プロセスです。
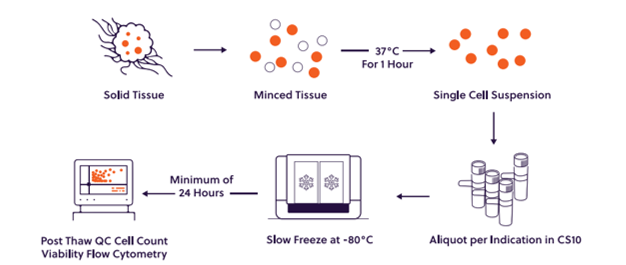
臨床検体の生体試料は、欧米のサプライヤーから供給される製品を取り扱い、販売しています。DTCの原料となる腫瘍組織は採取後すぐに、輸送用液に入れられ4℃を維持できるコンテナで24時間から72時間以内に処置施設へ輸送され、組織のミンス、酵素処理が行われます。腫瘍組織の迅速な処理が、細胞生存率の維持に貢献していると言えます。腫瘍組織の重量、重量あたりの細胞数は癌の種類により異なりますので、最終的にそれぞれに適したプロトコル、細胞濃度で製品化されています。凍結保存培地中のDTCは-80℃で一晩、時間をかけて凍結され、その後液体窒素下に保管されます。液体窒素下で8時間以上保管されたのちに、細胞数や融解後の生存率といった品質評価がなされています。
 |
DTCにはどんな細胞が含まれていますか? |
 |
DTCには腫瘍組織に含まれると考えられる様々な細胞が含まれていると考えられます。富士フイルム和光純薬でDTCの取り扱いのあるメーカーでは、DTCに含まれる細胞をフローサイトメーターで解析し、ロット情報として提供しています。例えば腫瘍細胞はEpCAM、免疫細胞はCD45でラベリングして、ロットごとのDTCに含まれる各細胞の割合を示しています。免疫細胞はさらにヘルパーT細胞(CD3+CD4)、キラーT細胞(CD3+CD8+)、B細胞(CD19+)、NK細胞(CD3-CD56+)、骨髄系共通前駆細胞由来細胞(CD11b+、CD15+、CD14+)といった細胞群のポピュレーションのデータが附属しています。 |
 |
どんな癌腫から作製したDTCがありますか? |
 |
DTCを販売するDiscovery Life Sciences社のラインアップを見ると、17種類の固形がんから由来するDTCの製品があります。例としては次の通りです;膀胱がん、脳腫瘍、乳がん、子宮頸がん、大腸がん、子宮内膜がん、食道がん、胃がん、頭頸部がん、腎がん、肝臓がん、肺がん、メラノーマ、卵巣がん、すい臓がん、前立腺がん、甲状腺がん 癌の種類によって腫瘍の重量、それらに含まれる細胞数が異なりますので、それぞれに最適化された細胞濃度となるように細胞が製造されています。下の図に癌種ごとの腫瘍の重量、腫瘍グラム当たりの細胞数、DTCを製造した際のバイアルあたりの最適な細胞数が示されています。 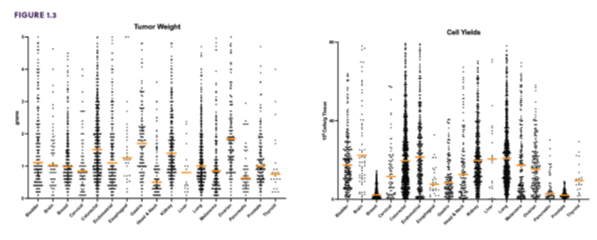 同社では4,500を超える別個の腫瘍から採取されたDTCのロットを保有しています。 |
 |
私は大学病院から術後すぐの検体を入手して処理しています。それでも中には生細胞率が低い検体が存在します。 DTCは凍結検体ですが、解凍後の細胞生存率はどうですか? |
 |
Discovery Life Sciences社では9つの癌種の、100ロットを超えるロットに対し凍結状態のDTCを融解、EpCAMで定義されたがん細胞について、磁気ビーズを用いて単離し検証することで、平均的に高い収量・バイアビリティを確認しています。ただし腫瘍組織であることから、健康ドナーさんから採取・凍結され製品化されているPBMC(末梢血由来単核球細胞)などに比べると、細胞解凍後の細胞生存率についてはロット差が大きいです。メーカーの凍結技術は高いものの試料元来の特質はある程度考慮が必要なのではないかと思います。DTCの各ロットの仕様(腫瘍元の患者さんの臨床情報、細胞ポピュレーション%、在庫本数など)はエクセルファイルに在庫リストとして記載されており、バイアビリティについても各ロットを比較できるようになっています。バイアビリティ、解析対象としたい細胞の割合などを比較しながらロットをご選択いただくことが可能です。 またDTCをご購入いただいたお客様の声で、DTCと、国内の医療機関から入手された非凍結の腫瘍組織から得られた細胞で、解析データに有意な差がないかどうか比較し、結果的に大きな差がなかったとのフィードバックをいただいたことがあります。試験系によっては影響があるものも出てくるかもしれませんが、凍結された細胞であるDTCでも、様々な研究にお使いいただける品質であるのではないでしょうか。 |
2.DTCの期待できるアプリケーション
富士フイルム和光純薬ではDTCのほか、凍結組織・FFPE組織、血清血漿、PBMCなど、様々な形態の生体試料を取り扱い、販売しています。多くは欧米メーカーの製品となり、研究用途であれば基本的に自由にご使用いただける製品がほとんどで、DTCも同様です。実際にどのような活用方法があるでしょうか。メーカーのアプリケーション紹介、弊社の関連サービスとともにご紹介させていただきます。
 |
シングルセル解析に活用できますか? |
 |
DTCは組織から細胞分散された製品ですので、シングルセルRNAseq、シングルセル免疫レパトア解析、マルチオーム解析などの様々なアプリケーションに活用可能です。 またDTCとセットのPBMC(同じ患者さんの末梢血から採取)を持つロットもありますので、TILとPBMCを比較して共通クローンを探索し、腫瘍と末梢血中のリンパ球の連関などの検討から、新たな診断技術やバイオマーカー開発の研究に利用することが可能となります。TCR/BCRレパトア解析などの腫瘍免疫の研究パイプラインの活用においても、治療介入や病態進展に伴う免疫応答の変化を腫瘍局所と末梢環境においてそれぞれ比較検討する事も可能となります。 |
 |
培養して創薬研究に用いることができそうですね。 |
 |
様々な細胞を含むことで腫瘍組織の微小環境を反映しているDTCですが、腫瘍細胞、免疫細胞、内皮細胞、線維芽細胞など、単一もしくは個別の組み合わせで培養することで薬剤に対する細胞の反応を検証することが可能です。Discovery Life Sciences社では大腸がん、腎臓がん、肺がん、メラノーマ、卵巣がんに対してスフェロイド培養に適した培養条件を評価しています。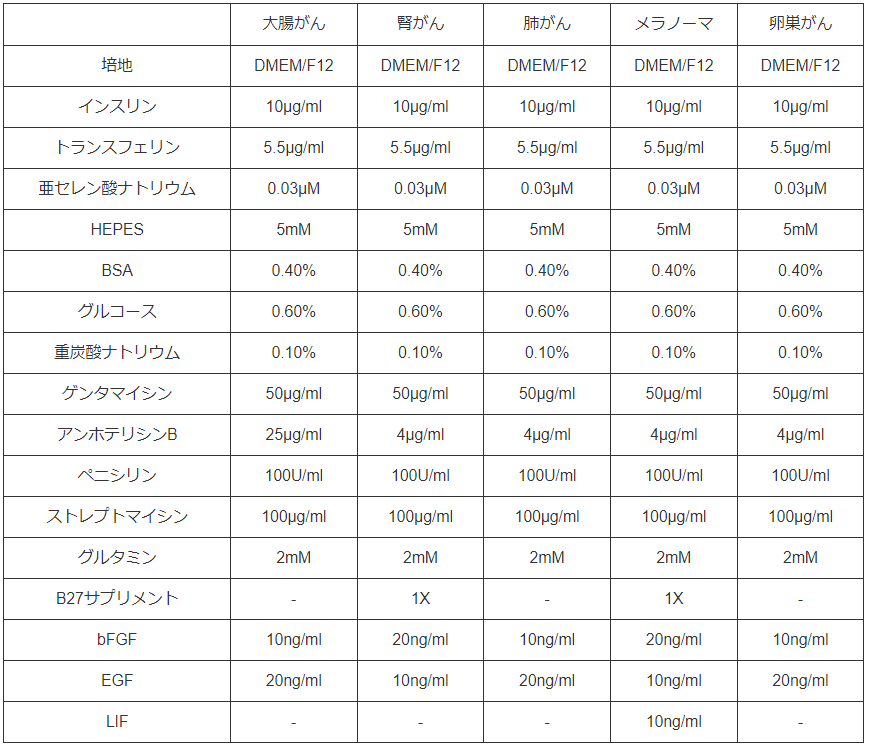 上記の表ががん種ごとに最適化された培養条件となります。またリンパ球との共培養についてもDTCは役割を果たしており、下記がその図となります。 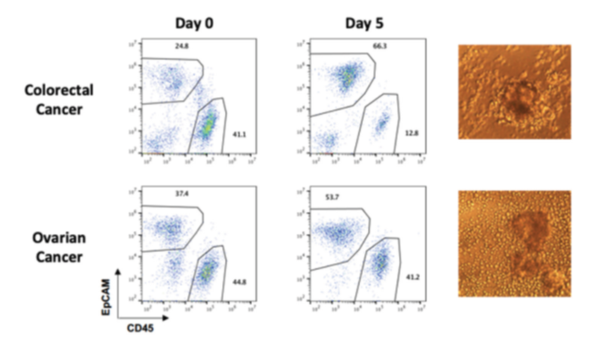 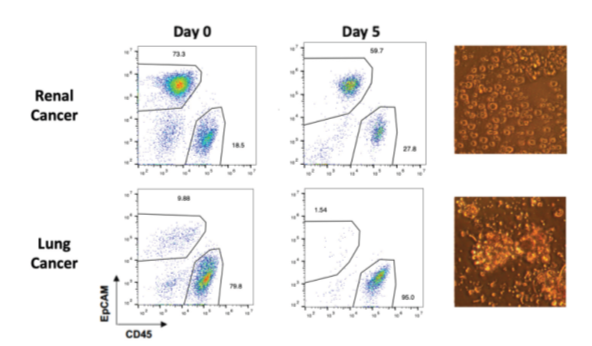 大腸がん、卵巣がん、腎臓がん、肺がんのDTCにおいて、培養前のCD45+細胞群が培養5日後にも維持されていることが分かります。高用量のIL-2を添加することで、プライマリーな腫瘍細胞、TILを用いた薬物反応の評価を可能にしています。 またDTCをご購入いただいたお客様からは、薬剤Xを添加したロット群と添加していない群を24時間インキュベートし、標的の細胞をRNA解析に使用、上清をサイトカイン測定に用いられたと伺いました。 |
 |
がん免疫研究の分野では、マウスを用いた研究に加えて、臨床検体を用いた研究が重要視されています。幸い、私の研究室は大学病院内にあるので、外科の先生方と共同研究を実施して、手術検体が入手できます。しかしながら、臨床検体にアクセスが困難な研究環境の研究者にとっても、DTCを活用することができるのは素晴らしいですね。ますますがん免疫研究が活性化すると期待されます。 臨床検体を用いるためには、患者さんの個人情報保護や研究倫理に関しては適切に対応する必要があります。DTCの利用に関しては、そのような倫理的な問題はクリアされていますか? |
 |
DTCを含め、弊社で取り扱い・販売している腫瘍組織検体や血液検体は研究用製品として欧米のメーカーから供給されます。検体に由来するドナーさまを匿名化・ID化することで、患者さん個人の情報が保護されながら、試料を購入されるお客様へドナーバックグラウンド(年齢、性別、人種など)や臨床情報の提供も両立しています。またDTCすべて、IRB(Institute Review Board)承認のプロトコルのもと検体採取が行なわれ、また採取・検体の販売、その先の研究利用について患者さんからの同意を取得しています。 |
3.東京大学 医学部付属病院 免疫細胞治療学講座 垣見研究室の研究について
垣見先生のラボでは大学病院のがん患者さんから手術で切除された腫瘍組織検体や血液検体を処理し、解析されています。当社からご紹介するDTCは米国のメーカーから供給される市販品であることから、企業のお客様や大学病院からの検体入手が容易でないアカデミアの研究者の皆様からは大きな関心を寄せていただいています。一方で市販品化された検体では得られる患者さんの背景の情報、臨床情報には限りがあり、先生のラボで入手されている患者さんの検体では治療前後の変化や、患者さん自身の経過観察といった、診療科の先生方と連携することで得られる質の高い情報とともに解析を進められています。直接DTCをご購入されているわけではありませんが、腫瘍免疫応答の解析や新たな免疫治療法の開発・創薬に非常に重要なリソースであるという共通点を持つ検体を用いて研究をされている垣見先生の研究についてもお教えいただければと思います。
 |
私の研究室では、手術で切除された腫瘍を酵素処理して、DTCを作製し、腫瘍浸潤リンパ球(TIL)の培養を行っています。 腫瘍特異的リンパ球を含んだTILを増殖させ、患者に投与するTIL治療は非常に強力な治療ですが、メラノーマ以外のがんでは、TILの培養増殖は容易ではありません。腫瘍内の免疫抑制性の環境により、疲弊状態に陥ったTILは、短期間の培養は可能ですが、次第に増殖能を欠如し、死滅してしまいます。そこで、TILを培養中に、その腫瘍特異性を評価し、ネオアンチゲンに反応する腫瘍特異的T細胞を同定して、そのTCR遺伝子をクローニングして、新たに増殖能を持った患者のT細胞に導入して腫瘍特異的T細胞を作製しようとしています。 |
4.製品の使い方、腫瘍組織由来の細胞についてのQ&A、アドバイス
 |
これまで、DTCの製品がどういうものか、期待できるアプリケーションなどについてご紹介させていただきました。先生は、DTCを用いてどのような研究が可能になると思いますか? |
 |
免疫チェックポイント阻害剤単剤から始まったがん免疫治療も、今では、化学療法や分子標的薬との併用も保険承認されています。治療効果を得ることがむつかしかった患者さんに対して、より効果的な併用治療の開発が求められています。そのためには、免疫チェックポイント阻害剤の抵抗性のメカニズムの解析が重要です。腫瘍内には、がん細胞だけでなく、免疫細胞や間質細胞など、様々な細胞の相互作用で免疫抑制性の微小環境が形成されています。がん細胞だけ、あるいは免疫細胞だけに対する作用ではなく、がんと免疫の相互作用、さらに、間質細胞などを含めたがん微小環境全体に対する評価が求められています。DTCを用いることで、in vitroで腫瘍内微小環境を再現し、がん細胞-免疫細胞や免疫細胞間のネットワークを解明することが、これからのより効果的ながん免疫治療を開発するために有効だと思われます。 |
 |
以前DTCを購入してくださったお客様から一部のロットに関してコンタミネーションがあったとのご指摘をいただきました。大腸癌組織由来のため腸内細菌由来のコンタミネーションが考えられることなどをご指摘いただいたのですが、手術で切除された組織から得られた細胞を培養するなどで使う際の、抗生物質の添加といったような注意点など、アドバイスをいただけますか? |
 |
手術操作は清潔に執り行われますし、検体採取時にも細心の注意を払っておられると思います。しかしながら、消化器がんの場合は、そもそも腸管の管腔内には微生物が存在していますから、微生物も凍結チューブ内に入ってきてしまいます。数日間培養を続けるだけでバクテリアが繁殖してくることもあります。臨床でも耐性菌の存在が問題になりますが、通常のペニシリン・ストレプトマイシン添加だけでは押さえられないことがあります。 抗菌薬の選択では、バクテリアだけでなく、真菌にも気を付ける必要があります。抗菌薬を加えても完全ではないので、がん種によっては、培養期間をできるだけ短期間にして解析するなどの工夫も必要だと思われます。 |
5.おわりに
研究用のヒト生体試料は、臨床検体が元となっていることが多いためFFPE・凍結組織、血液(血清・血漿)などのフォーマットが大半を占めますが、今回ご紹介したDTCは腫瘍細胞とリンパ球の両方をViable Cellsで得られる点から、これまでよりも幅広い用途で腫瘍免疫分野の研究、創薬に貢献する可能性を持っていると、改めて実感することができました。ただしこれまではDTCに興味はあるがどのように使ったらいいか分からないといった声をいただくことが多かったため、ラボのテーマとしてDTCの元となるような腫瘍組織を日々活用して研究されている垣見先生に製品に対する印象やご意見を伺うことができ、関心を寄せていただいているお客様にDTCを活用するアイデアを想起するきっかけとすることができたのでないかと思いました。
先生、どうもありがとうございました。
| 東京大学医学部付属病院 免疫細胞治療学講座 特任教授 垣見和宏先生 | ||
|---|---|---|
 |
ご略歴 | |
| 1988 | 京都大学医学部 卒業 | |
| 1988-1989 | 京都大学医学部附属病院 内科研修医 | |
| 1989-1991 | 赤穂市民病院 内科医員 | |
| 1991-1995 | 京都大学大学院医学研究科 内科系専攻 | |
| 1995 | 同上 修了 | |
| 1995-1998 | 三重大学医学部生体防御医学講座 助手 | |
| 1996-2002 | スクリプス研究所分子実験医学部門 客員研究員-客員助教授 | |
| 2001-2004 | 東京医科大学 内科学第4講座助手 | |
| 2004-2014 | 東京大学大学院医学系研究科 免疫細胞治療学講座 特任准教授 | |
| 2014- | 同免疫細胞治療学講座 特任教授 | |
| 2023- | 近畿大学医学部免疫学教室 教授 | |
リンク
東京大学医学部付属病院 免疫細胞治療学講座の研究ウェブサイト
富士フイルム和光純薬で提供可能な関連サービス
富士フイルム和光純薬が取り扱うシングルセル解析サービス
AZENTAの次世代シーケンス受託サービス
スフェロイド受託作製サービス




