【テクニカルレポート】STQ法を応用したネオニコチノイド系農薬の分析法
本記事は、ChemGrowing Vol.15 (2021年2月号)において、株式会社アイスティサイエンス技術営業部 小西 賢治様に執筆いただいたものです。
1.はじめに
ネオニコチノイド系農薬は各国で使用されているが、ミツバチにおいて蜂群崩壊症候群の一因とされているため、近年ではEUなど諸外国で一部使用規制が進んでいる。しかし日本では使用規制がなされていないため分析の需要も高い。ここでは「迅速・簡便・高精製」な残留農薬分析法であるSTQ※-LC法を応用し、ネオニコチノイド系農薬に最適化した結果を紹介する。
- STQ法... Solid Phase Extraction Technique with QuEChERS method
2.STQ-LC法の概要
STQ-LCの概要を図1に示す。
STQ法は試料の均一化から解析までトータルバランスを考慮した「迅速・簡便・高精製」な分析手法である。
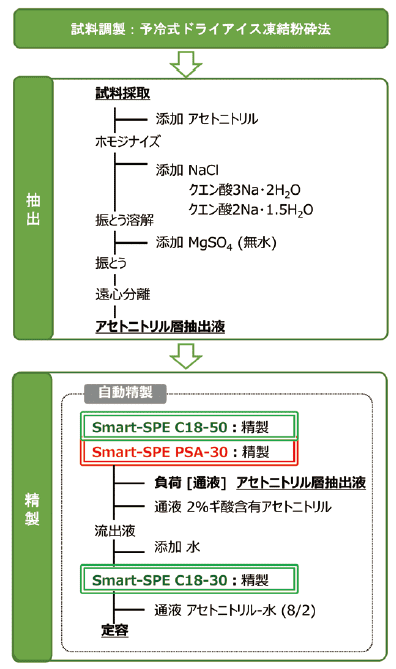
図1. STQ-LC法の概要
予冷式ドライアイス凍結粉砕法により均一化した試料を用いてQuEChERS法を参考としたアセトニトリル抽出と塩析、液-液分配を行い、充填量が数十 mgと少ない固相カートリッジSmart-SPEを使用して精製する。
STQ-LC法は比較的極性が高くLC-MS/MSで測定する成分を対象とした精製方法である。基本のフローは連結したC18とPSAに試料(抽出液)を負荷し、C18で無~低極性夾雑物を、PSAで高級脂肪酸やイオン性の夾雑物を除去する。カルボキシル基(-COOH)をもつような酸性農薬はPSAに吸着されるため、ギ酸で酸性にしたアセトニトリルを通液することでそれらの化合物を溶出する。
続いてC18とPSAからの流出液に水を添加し溶媒比を下げて再度、別のC18に通液することにより最初のC18で除去しきれなかった低極性夾雑物を除去する。このように無~低極性夾雑物を除去することで分析用カラム(ODS)への負荷を軽減できる(図2)。十分な精製を行うことで分析カラムの劣化を防ぎ、ピーク形状の維持やカラム洗浄時間の短縮などが可能となる。今回はこの分析法を基にネオニコチノイド系農薬に最適化を行った。
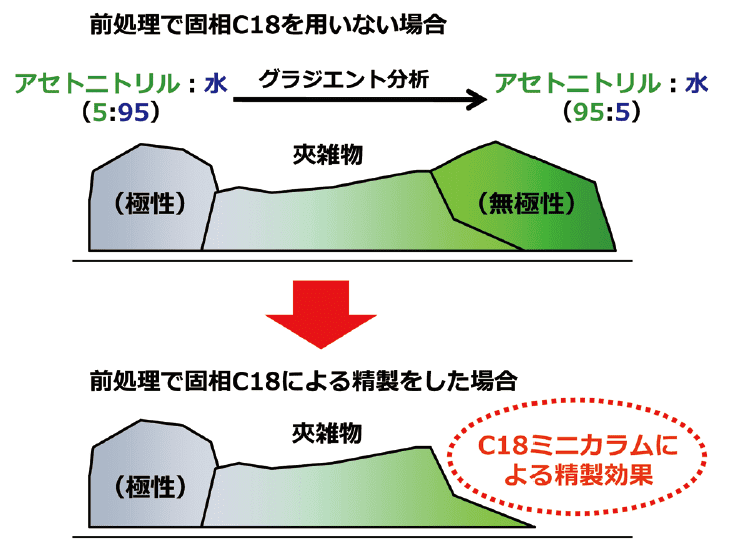
図2. LC分離カラムにおける無極性夾雑物除去
3.分析方法
3-1.分析試料
ハチミツ、玄米、大豆、ホウレンソウ、茶
3-2.標準溶液
ネオニコチノイド系農薬混合標準液(富士フイルム和光純薬株式会社、Code No. 149-09461、145-09463)
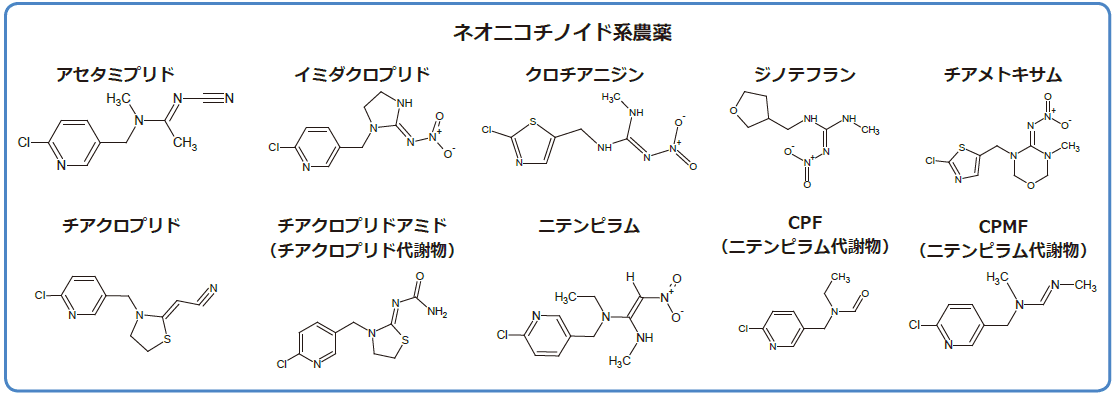
図3. ネオニコチノイド系農薬
3-3.試料調製
試料の均一化は分析精度を保つ上で重要である。STQ法で採用している予冷式ドライアイス凍結粉砕法は、試料をドライアイスで予冷し凍結した状態でドライアイスとともに粉砕することでパウダー状に均一化することができる。ホウレンソウのような青果物はもとより、玄米や大豆など穀類・豆類においても常温でミルを用いて粉砕するよりも試料がより細かく粉砕され、均一化された(図4)。凍結状態で粉砕することにより酵素活性も抑えられるため、酵素活性によりアリル化合物を生成する試料の粉砕にも有用である。今回の添加回収試験では大容量凍結粉砕機(図5)を用いてホウレンソウ、玄米、大豆を予冷式ドライアイス凍結粉砕法にて粉砕した。茶はミルで粉砕し均一化した。
-

図4. 常温粉砕と予冷式ドライアイス凍結粉砕の比較 (玄米)
-

図5. 大容量凍結粉砕機 (Code No. 387-17711)
3-4.抽出
抽出フローを図6に示す。
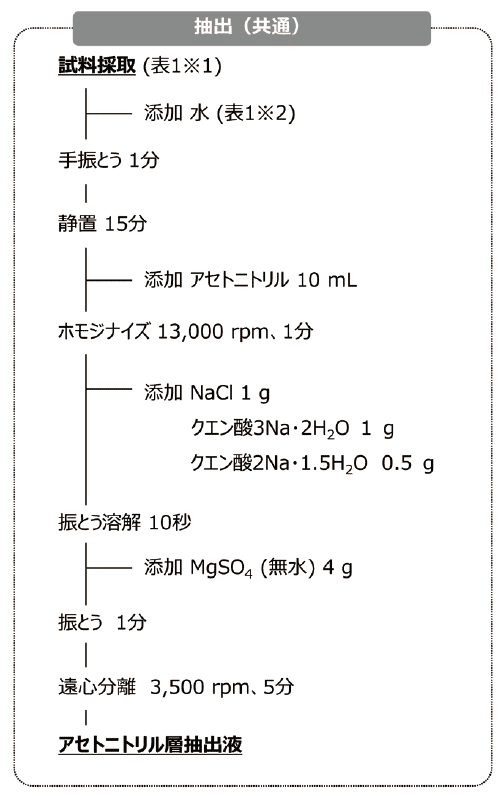

図6. 抽出フロー
試料は性状に応じて表1の通りに秤量し、ハチミツ、玄米、大豆、ホウレンソウは試料中0.01 ppm、茶は試料中0.25 ppm になるように混合標準溶液を添加した。
表1. 試料採取量および水添加量
| 分析試料 | ※1 | ※2 |
|---|---|---|
| 試料採取量 (g) | 水添加量 (mL) | |
| ハチミツ | 5 | 10 |
| 玄米 | 5 | 10 |
| 大豆 | 5 | 10 |
| ホウレンソウ | 10 | - |
| 茶 | 2 | 10 |
その後水分含量が80%未満であるハチミツ、玄米、大豆、茶については分析試料中の水分量が10 gとなるよう精製水を添加し振とうにより混和させたものを、15分静置して膨潤させた。抽出溶媒としてアセトニトリル10 mLを加えて、1分間ホモジナイズを行った。塩化ナトリウム1 g、クエン酸三ナトリウム二水和物1 g、クエン酸水素二ナトリウム1.5水和物0.5 gを添加し、振とうして試薬を溶解させた後、無水硫酸マグネシウム4 gを添加し、1分間手で激しく振とうした。塩化ナトリウム及び無水硫酸マグネシウムは塩析効果による液-液分配のため、クエン酸三ナトリウム二水和物およびクエン酸二ナトリウム1.5水和物は緩衝剤としてそれぞれ用いた。四種の塩を同時に添加せずに、一度溶解させてから無水硫酸マグネシウムを加えることで、無水硫酸マグネシウムが吸水し塊になることを低減する。その後、遠心分離を行い上層のアセトニトリル層を抽出液として用いた。茶のみマトリックスを低減させるため抽出液を水で10倍希釈して試験溶液を調製した。
3-5.精製
精製はSmart-SPE PBX※-20(2個、Code No. 306-95041)、PSA-30(1個、Code No. 301-94991)の合計3個の固相カラムを用いて全自動固相抽出装置ST-L400(図7)で行った。
- PBX...ポリマー系親水性/疎水性バランス充填剤

図7. 全自動固相抽出装置ST-L400(左)及び固相カラムSmart-SPE(右)
精製フローを図8に示す。

図8. 精製フロー
連結したPBXとPSAに試料を通液することにより、ポリマー系親水性/疎水性バランス充填剤であるPBXで色素や脂質などの無~低極性夾雑物を除去し、PSAで脂肪酸などの酸性物質や陰イオン性夾雑物の除去を行う。連結カラムからの流出液に水を加えることでアセトニトリルの比率を下げて上のPBXで除去しきれなかった低極性夾雑成分を取り除く。分析対象であるネオニコチノイド系農薬は固相に保持されないため、流出液を試験管で受ける。アセトニトリル-水(2/1)を下のPBXに通液することで目的成分を完全に溶出する。流出液を同じ試験管に受け、精製水で定容して測定液とする。
STQ-LC法で採用しているC18を使用すると目的成分の一つであるCPMFが吸着し溶出に酸性溶媒が必要となるが、PBXを用いるとCPMFが吸着しないため中性溶媒を使用できる。STQ法では幅広い農薬成分を対象とするため、PSAに吸着してしまう酸性農薬を溶出するために酸性溶媒を使用するが一部イオン性の夾雑物も溶出されてしまう。今回分析対象としたネオニコチノイド系農薬は全てPSAに保持されないため負荷後の通液は中性のアセトニトリル-水を使用することでPSAに吸着させた陰イオン夾雑物を溶出することなく目的成分の回収が可能である。
全自動固相抽出装置ST-L400による固相抽出(精製)工程の概要を図9に示す。
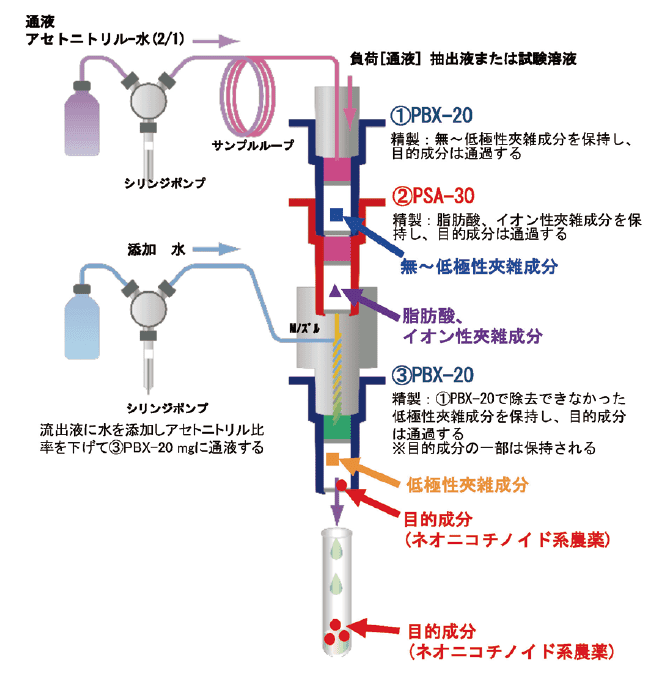
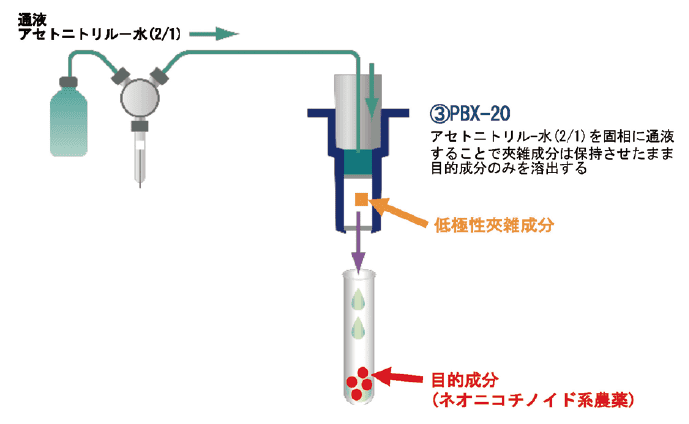
図9. 全自動固相抽出装置ST-L400における精製工程
PBX-20(上)とPSA-30を連結したところに3-4.で得られた抽出液(茶の場合は試験溶液)を0.5 mL負荷し、アセトニトリル‐水(2/1)0.5 mLを通液した。PBX-20(上)とPSA-30からの流出液に精製水を0.5 mL加えてPBX-20(下)に通液した。さらにアセトニトリル- 水(2/1)0.5 mLを通液してPBX-20から目的成分を溶出した。流出液は全て試験管に受け、精製水で2 mLに定容した。
3-6.測定条件
得られた試料はLC-MS/MSで測定した。測定条件を表2に示す。移動相にギ酸を添加し、酸性にすることでCPMFのピーク形状が改善された(図10)。また測定開始時(試料注入時)の移動相組成をB Conc. 5%としてグラジエント分析することですべての成分で良好なピーク形状が得られた(図11)。
表2. 測定条件

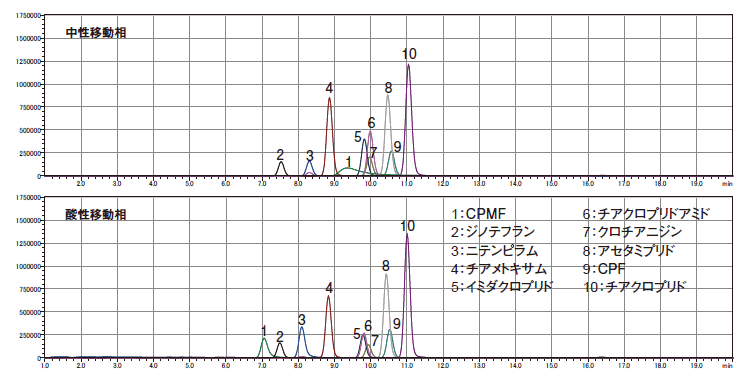
図10. 移動相のpHによるピーク形状の比較(上:中性移動相、下:酸性移動相)
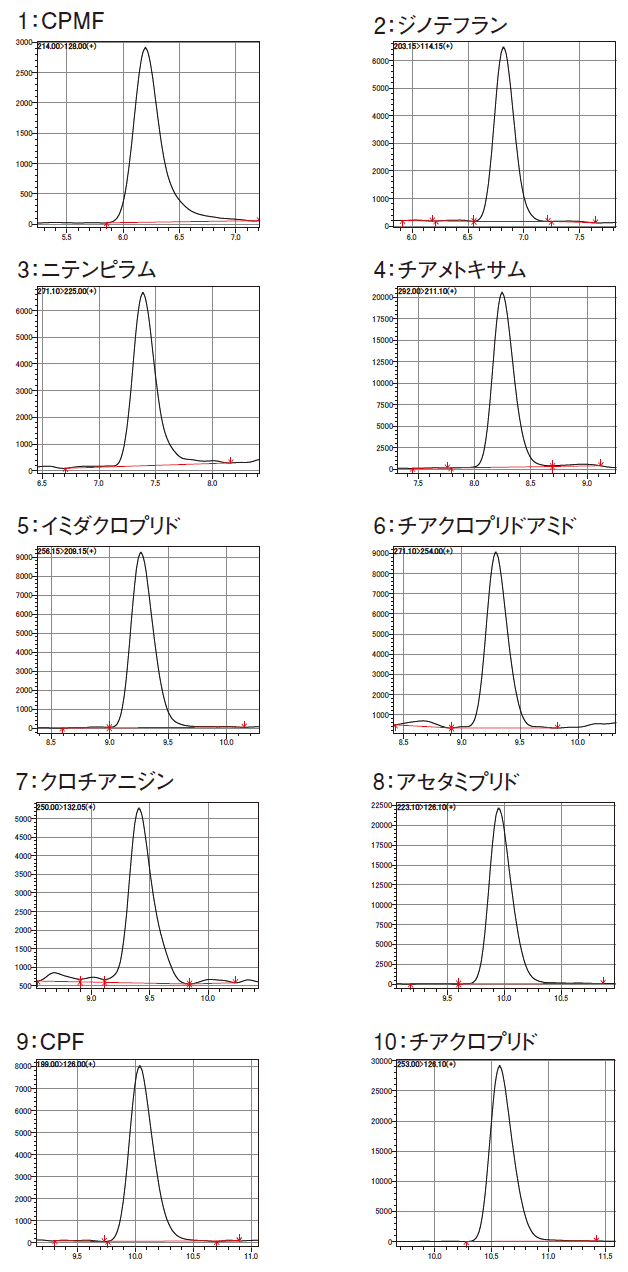
図11. 各成分のクロマトグラム(標準溶液1.25 ppb)
4.結果
目的成分の添加回収試験の結果を表3に示す。添加回収率は添加回収試験試料の各成分のピーク面積値を同濃度の標準溶液の面積値と比較して算出した。なお、添加回収試験試料のバイアル中濃度はホウレンソウが2.5 ppb、その他が1.25 ppbである。
添加回収率(%)の計算式
添加回収試料の面積値 ÷ 標準溶液の面積値 × 100
表3. 添加回収試験結果
(n=5)
| 成分名 | RT (min) |
極性 | ハチミツ | 玄米 | 大豆 | ホウレンソウ | 茶 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料中 0.01 ppm | 試料中 0.01 ppm | 試料中 0.01 ppm | 試料中 0.01 ppm | 試料中 0.25 ppm | ||||||||
| バイアル中 1.25 ppb | バイアル中 1.25 ppb | バイアル中 1.25 ppb | バイアル中 2.5 ppb | バイアル中 1.25 ppb | ||||||||
| 回収率(%) | RSD(%) | 回収率(%) | RSD(%) | 回収率(%) | RSD(%) | 回収率(%) | RSD(%) | 回収率(%) | RSD(%) | |||
| CPMF | 6.2 | (+) | 104 | 1.3 | 115 | 5.4 | 105 | 5.5 | 108 | 2.3 | 111 | 1.8 |
| ジノテフラン | 6.8 | (+) | 102 | 1.8 | 91 | 4.0 | 96 | 3.6 | 94 | 3.8 | 75 | 3.8 |
| ニテンピラム | 7.4 | (+) | 95 | 4.6 | 86 | 3.1 | 90 | 5.1 | 94 | 2.8 | 113 | 9.0 |
| チアメトキサム | 8.3 | (+) | 105 | 0.8 | 90 | 1.5 | 107 | 1.4 | 97 | 2.1 | 81 | 2.6 |
| イミダクロプリド | 9.3 | (+) | 104 | 3.1 | 92 | 3.1 | 102 | 3.5 | 140※ | 31.9 | 85 | 3.5 |
| チアクロプリドアミド | 9.3 | (+) | 100 | 1.8 | 95 | 3.0 | 111 | 2.9 | 110 | 1.8 | 108 | 2.3 |
| クロチアニジン | 9.4 | (+) | 54 | 6.3 | 82 | 3.7 | 77 | 8.3 | 99 | 3.6 | 67 | 4.1 |
| (-) | 105 | 8.3 | 77 | 15.3 | 100 | 14.6 | 106 | 12.3 | 52 | 12.0 | ||
| フルピラジフロン | 10.6 | (+) | 92 | 3.2 | 90 | 2.1 | 94 | 4.7 | 116 | 4.3 | 92 | 3.3 |
| アセタミプリド | 10.0 | (+) | 102 | 1.5 | 90 | 2.8 | 93 | 4.8 | 99 | 2.4 | 92 | 0.9 |
| CPF | 10.1 | (+) | 107 | 3.0 | 73 | 4.3 | 92 | 4.9 | 108 | 4.6 | 83 | 2.4 |
| チアクロプリド | 10.6 | (+) | 103 | 1.5 | 87 | 0.7 | 94 | 4.9 | 100 | 2.7 | 85 | 1.3 |
※未知試料から添加濃度の10倍程度検出(表記は減算後の数値)
ホウレンソウのイミダクロプリド、茶のクロチアニジンを除き、回収率70%-120%、併行精度10%以内の良好な結果が得られた。
ホウレンソウでは分析試料から添加濃度を超えてイミダクロプリドが検出されたため添加回収率を正確に評価できなかった。クロチアニジンは試料に関わらずイオン化阻害の影響を受けやすかったため、ポジティブ、ネガティブ両測定モードで測定を実施し、茶以外の試料ではいずれかの測定モードで良好な回収率が得られたが、茶においては両モードとも低回収率となった。茶のクロチアニジン以外の成分は抽出液を10倍希釈して固相抽出により精製することでカテキン類を除去しイオン化阻害を低減することができた(図12)。
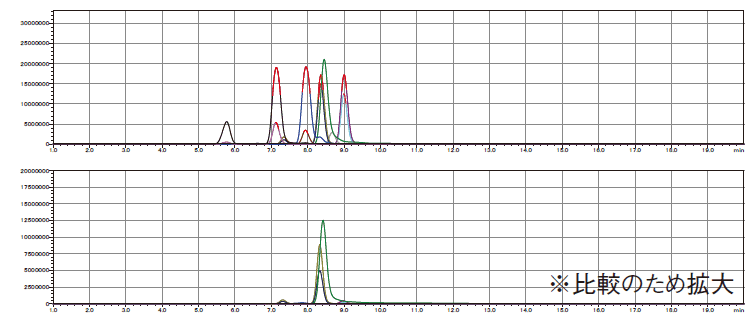
図12. 茶抽出液のTICクロマトグラム(上:試料0.033 g相当、下:試料0.01 g相当)
本前処理では基本フローのC18をPBXに変更することでCPMFも良好な回収率を得ることができた。通液にはアセトニトリル-水(2/1)を用いることで無~低極性夾雑物の溶出を抑え目的成分のみが溶出するようにした。
5. おわりに
ネオニコチノイド系農薬10成分についてLCの分離に酸性移動相を用いること、分析開始時の移動相組成をB Conc. 5%とすることでCPMFおよびジノテフランのピーク形状が改善された。
またSTQ-LC法からネオニコチノイド系農薬分析への最適化に当たって、基本フローで採用しているC18をPBXに変更すること、通液にアセトニトリル-水(2/1)を用いること、茶では抽出液を水で希釈することなどにより回収率と精製効果の向上を図ることができた。その結果良好な回収率および再現性を得られた。今回、ネオニコチノイド系農薬の前処理法を提案し、各種の試料に対して迅速・簡便・高精製に分析できることが示された。
6. 文献
- 小西賢治ら:第37回農薬残留分析研究会講演要旨集,p119-126 (2014).
- 佐々野僚一ら:第106回日本食品衛生学会学術講演会要旨集,p115 (2013).
- 平井知里,山岸浩:福井県衛生環境研究センター年報第14巻,32-39 (2015).
- 小西賢治ら:第43回農薬残留分析研究会講演要旨集,p163-172 (2020).




