【総説】下痢性貝毒オカダ酸群と分析用標準物質
本記事は、和光純薬時報 Vol.89 No.1(2021年1月号)において、国立研究開発法人水産研究・教育機構 水産技術研究所 環境・応用部門 水産物応用開発部 鈴木 敏之様に執筆いただいたものです。
はじめに
貝毒など海洋生態系の自然毒の多くは有毒プランクトンにより生産され、食物連鎖を介して魚介類に蓄積される。ホタテガイやカキなどの二枚貝は、プランクトンを餌としているため、餌としたプランクトンの中に有毒プランクトンが含まれていると毒を蓄積して毒化する。毒化した二枚貝をヒトが喫食することにより貝中毒を発症するが、有毒プランクトンが生産する原因毒により、中毒症状は様々である。
貝毒などの海洋生物毒は無味無臭で極めて微量で強い毒性を示すため、毒化した二枚貝を味覚により識別することはできない。有毒プランクトンが発生すれば、その海域の全ての二枚貝が毒化すると考えてよいが、二枚貝種により、毒に対する代謝や蓄積動態が異なるため、主要毒や毒化の程度については一様ではない。二枚貝のほか、ロブスター、カニ、セイヨウトコブシ、ホヤなども毒化し、食中毒の原因となる事例も報告されている。ロブスターやカニなどの甲殻類は、毒化した二枚貝を捕食して毒化することが知られている。
下痢性貝毒オカダ酸(okadaic acid : OA)群は、麻痺性貝毒と並び、食品衛生上、最も重要な貝毒である。本稿では、OA 群の化学的性状や機器分析法について概説する。また、機器分析等で利用する二次標準物質についても触れたい。
下痢性貝毒オカダ酸(OA)群の化学的性状
OA は2 種類のカイメンの哺乳類に対する毒性が発端となり単離され、その化学構造は1981 年に報告された1)(図1)。OA の名称は、単離されたクロイソカイメン Halichondria okadai の学名に由来している。OA は炭素数 38 の脂肪酸であり、多数のポリエーテル結合を分子内に有する脂溶性化合物である。
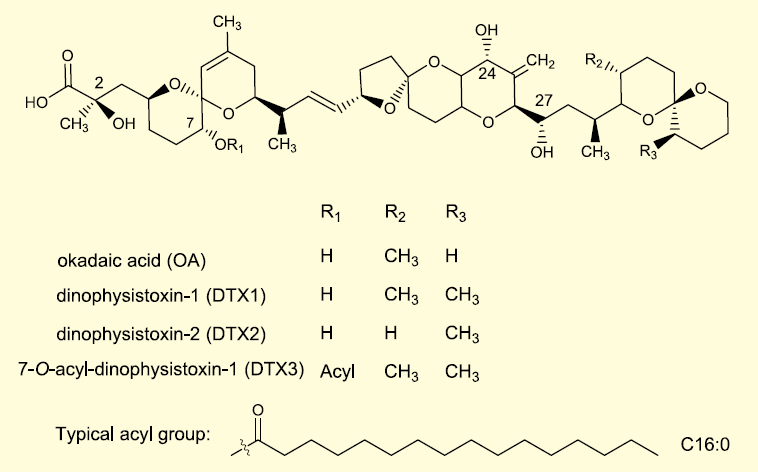
図1. 主要なオカダ酸群の化学構造
OA はメタノール、アセトン、クロロホルム、ジクロロメタンのような有機溶媒に高い溶解性を示す。17 個のキラル中心を分子内に有し、それらは2R、4S、7R、8R、12S、13R、16R、19S、22R、23S、24R、26S、27S、29S、30S、31R、34S である。また、3 つのスピロケタール構造を有していることも構造的な特徴の一つである。紫外吸収はなく、分子内のヒドロキシ基とカルボキシ基により、3450、1740、1080、880 cm−1 において赤外吸収がみられる。1 位カルボキシ基と24 位のヒドロキシ基の水素結合により、環状構造をとることが知られている。
OA 群が貝毒として知られるようになった発端は、1970 年代後半にわが国の東北地方沿岸でムラサキイガイの喫食により発生した貝中毒である。新しいタイプの二枚貝中毒として報告され2)、その中毒症状に因み下痢性貝中毒と命名された。OA の化学構造の決定から1 年遅れて、1982 年に中毒原因物質がムラサキイガイから単離され、その化学構造は、OA の35 位がメチル化された35-methyl OA であることが解明された3)。
この化合物はジノフィシストキシン1(dinophysistoxin-1 : DTX1)と命名され、下痢性貝中毒の原因毒として知られるようになった。その後、ヨーロッパで発生した下痢性貝中毒の原因毒としてOA が同定され、OA も下痢性貝毒として知られるようになった。1992 年にはアイルランドで毒化したムラサキイガイから新たに類縁体が単離され、その化学構造はOA の異性体である35(S)-methyl 31-demethyl OA であることが明らかになり、ジノフィシストキシン2(dinophysistoxin-2 : DTX2)と命名された4)。
上述したOA、DTX1、DTX2の7 位ヒドロキシ基にパルミチン酸(16 : 0)、ミリスチン酸(14 : 0)、パルミトレイン酸(16 : 1)などの脂肪酸がエステル結合した毒は二枚貝の代謝物である5-7)。これらはジノフィシストキシン3(dinophysistoxin-3 : DTX3)と総称される。その他に1 位カルボキシル基にジオール類がエステル結合したジオールエステルも有毒プランクトンから発見されている8, 9)。
毒化した二枚貝をヒトが摂取すると下痢(92 %)、吐き気(80 %)、嘔吐(79%)、腹痛(53%)などの症状を発症する2)。ヒトの最低発症量はOA とDTX1 に換算すると、それぞれ48、38μg となる10)。OA 群は、セリン/スレオニンプロテインホスファターゼ(serine/threonine protein phosphatase 1 and 2A : PP1、PP2A) に結合し、プロテインホスファターゼの活性を阻害する11)。
PP2A 及びPP1 の阻害作用により、リン酸化タンパク質が過剰に蓄積され、細胞の調節機能に支障をきたし、このことがOA の下痢原性に関与していると考えられている。興味深いことに1 位カルボキシ基のメチルエステルには、プロテインホスファターゼの阻害作用がみられず、活性の発現にはカルボキシ基のほかに2 位、7 位、24 位、27 位のヒドロキシ基が重要であることが知られている12)。
アルツハイマー病の患者には、過剰リン酸化タウタンパク質が蓄積されることが主要な病理学的な特徴として知られている。また、過剰リン酸化タウタンパク質が神経細胞内に蓄積し、このことがシナプス数の減少などを誘発し、記憶障害を引き起こすと考えられており、プロテインホスファターゼの活性を阻害することにより、過剰リン酸化タウタンパク質の蓄積を誘発するOA群は、アルツハイマー病の研究ツールとしても注目されている13)。
T84 細胞及びCaco2 細胞の単層培養細胞シートを用いた実験では、OA 群により腸管における細胞間隙を介する傍細胞経路の透過性が増加することが示されており、OA 群の下痢原性に関与しているのは、傍細胞経路の透過性の増加であることが示唆されている14)。さらに、OA 群には発ガン促進作用があることも知られている15)。一方、OA 群のマウスに対する経口投与による病理学的観察では、小腸における液体の貯留、粘膜固有層の損傷が観察される16)。
OA 群の分析法
CODEX の「活及び生鮮二枚貝の規格(CODEX STAN 292-2008)」で示されているOA 群の基準値は0.16mg OA 当量/kg 可食部であり、わが国でもこの値を基準値として採用している。2015 年に厚生労働省が例示した下痢性貝毒OA 群の検査法はLC/MS/MS 法である。OA 群は脂溶性であるため、試料はメタノールにより抽出される。LC 分離条件は、分析用カラムとして、C8 やC18 逆相分配セミミクロカラムを用い、水とアセトニトリルにギ酸とギ酸アンモニウムを添加した2液移動相のグラジエント溶出である17)。
わが国も含め多くの国で採用しているOA 群の検査法では、OA、DTX1、DTX2 の脂肪酸エステルであるDTX3 をアルカリ加水分解により遊離のOA、DTX1、DTX2 に変換し、エステル毒も含めた一括定量を行っている。イオンチャンネルは陰イオンモードで[M-H]- をQ1 で選択し、コリジョンセルQ2 で不活性ガスと衝突させることにより、分子イオンを開裂させ、生じたフラグメントイオンm /z 255 をQ3 で選択するトリプル四重極MS/MS 検出である。陰イオンモードにより得られるMS/MS スペクトルはその構造からは予想できないほどシンプルであり(図2)、ベースピークはm /z 255 のイオンピークである。このイオンをQ3 で選択することにより、高感度かつ再現性の高い定量が可能である。
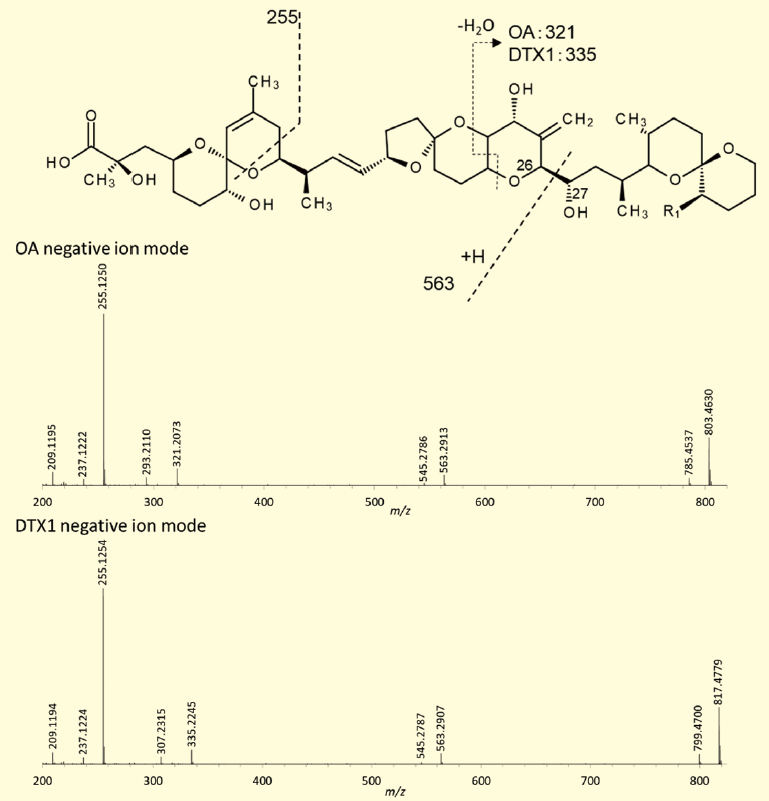
図2.陰イオンモードによるOA、DTX1 のQTOF MS/MS スペクトル
わが国の二枚貝の主要毒は、DTX1 とその脂肪酸エステルであるDTX3 であるため7)、加水分解物から検出される主要毒はDTX1となる。DTX1 に加えてOA も微量であるが検出されることがある一方で(図3)、DTX2 はわが国の二枚貝から検出された事例はない。しかし、DTX2 はOA と同じイオンチャンネル上で検出されるため、OA よりも後れて溶出するピークが検出される場合にはDTX2 の存在を疑う必要がある。
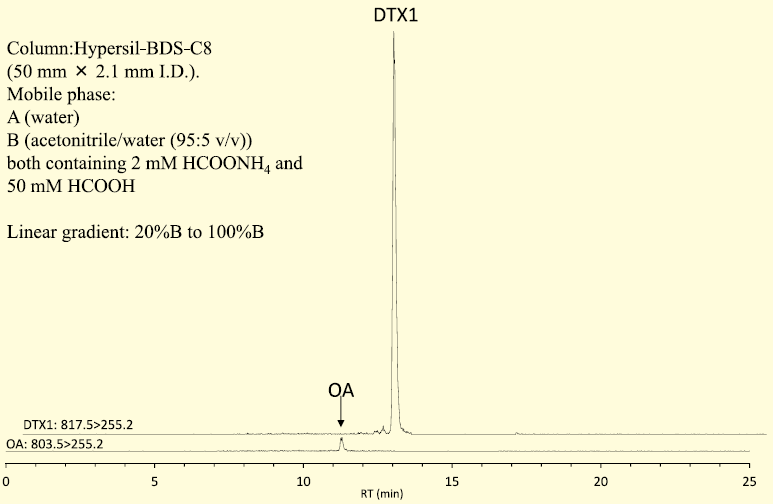
図3.ホタテガイのアルカリ加水分解物のLC/MS/MS クロマトグラム
一方、陽イオンモードにより得られるMS/MS フラグメントイオンは、陰イオンモードにより得られるスペクトルと比較すると豊富な情報を与え、新奇類縁体の構造解析においては極めて有用である(図4)。
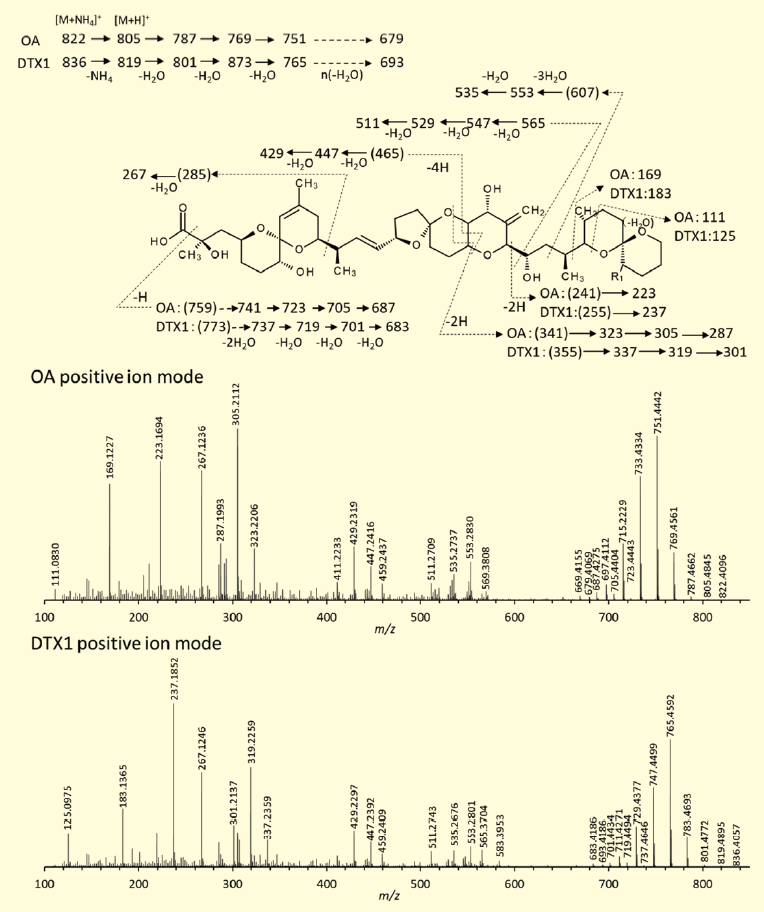
図4.陽イオンモードによるOA、DTX1 のQTOF MS/MS スペクトル
OA 群の標準物質
OA 群の認証標準物質(Certified Reference Material; CRM)はカナダのNational Research Council; NRC が製造しており、世界的に普及している国際認証標準物質である。需要が多く、供給量も限られるため、在庫は十分にあるとは言い難い。貝毒検査の標準品を海外の製品にのみ依存することは、在庫切れに伴う貝毒検査の停滞などのリスクを勘案すると望ましいことではない。わが国では、有毒藻類の大量培養による貝毒標準品の製造技術の開発が行われてきた18)。また、貝毒標準物質の値付けのための定量NMR法の開発も行われている19)。
こうした基礎技術の蓄積により、国立研究開発法人産業技術総合研究所と国立研究開発法人水産研究・教育機構中央水産研究所(現水産技術研究所環境・応用部門)により、OA 群のCRM が開発された。わが国初の貝毒のCRM として注目されており、2016 年4 月から市販品が提供されている。また、最近では、農研機構生研支援センター「革新的技術開発・緊急展開事業(うち経営体強化プロジェクト)「先端技術を活用した世界最高水準の下痢性貝毒監視体制の確立」」の援助を受けて二次標準物質も開発され、富士フイルム和光純薬(株)から市販されている。
この標準物質は国産CRM とほぼ同じ純度の原料(OA、DTX1)を使用している。国内の5 機関で国産CRM を用いて定量した結果を表1 に示す。5 機関の定量結果は極めて近く、本二次標準物質(コードNo. 156-03551)の信頼性を裏付けている。国のプロジェクト研究で開発した国産CRM を国家標準物質として保管し、長期間にわたり頒布するためには、日々の貝毒検査で二次標準物質が積極的に利用されることが望ましい。二次標準物質の更なる利用と普及が望まれるところである。
表1.国内5 機関(A-E)によるオカダ酸群混合標準液濃度(μg/mL)の評価結果
| A | B | C | D | E | |
|---|---|---|---|---|---|
| OA | 1.080 | 1.106 | 1.063 | 1.051 | 1.067 |
| DTX1 | 1.030 | 1.035 | 1.025 | 0.999 | 1.006 |
謝辞
下痢性貝毒二次標準物質は農研機構生研支援センター「革新的技術開発・緊急展開事業(うち経営体強化プロジェクト)「先端技術を活用した世界最高水準の下痢性貝毒監視体制の確立」」の援助を受けて開発されたことを記して謝意を表します。
参考文献
- Tachibana, K., Scheuer, P. J., Tsukitani, Y., Kikuchi, H., Engen, D. V., Clardy, J., Gopichand, Y. and Schmitz, F. J.:J. Am. Chem. Soc., 103, 2469 (1981). DOI: 10.1021/ja00399a082
- Yasumoto, T., Oshima, Y. and Yamaguchi, M. : Bull. Japan. Soc. Sci. Fish., 44, 1249 (1978). DOI: 10.2331/suisan.44.1249
- Murata, M., Shimatani, M., Sugitani, H., Oshima, Y. and Yasumoto, T. : Bull Japan Soc. Sci. Fish., 48, 549 (1982).
- Hu, T., Doyle, J., Jackson, D., Marr, J., Nixon, E., Pleasance, S., Qulliam, M. A.,Walter, J. A. and Wright, J. L. C. : J. Chem. Soc. Chem. Commun., 1, 39 (1992).
- Yasumoto, T., Murata, M., Oshima, Y., Sano, M., Matsumoto, G. K. and Clardy, J. : Tetrahedron, 41, 1019 (1985). DOI: 10.1016/S0040-4020(01)96469-5
- Suzuki, T., Ota, H. and Yamasaki, M. : Toxicon, 37, 187 (1999). DOI: 10.1016/s0041-0101(98)00182-2
- Suzuki, T., Kamiyama, T., Okumura, Y., Ishihara, K., Matsushima, R. and Kaneniwa, M. : Fish. Sci., 75, 1039 (2009). DOI: 10.1007/s12562-009-0111-3
- Yasumoto, T., Seino, N., Murakami, Y. and Murata, M. : Biol. Bull., 172, 128 (1987). DOI: 10.2307/1541612
- Suzuki, T., Beuzenberg, V., Mackenzie, L. and Quilliam, M. A. : Rapid Commun. Mass Spectrom., 18, 1131 (2004). DOI: 10.1002/rcm.1455
- FAO : "Assessment and management of biotoxin risks in bivalve.", Rome, Italy (2011). ISBN 978-92-5-107003-1.
- Bialojan, C. and Takai, A. : Biochem. J., 256, 283 (1988). DOI: 10.1042/bj2560283
- Nishiwaki, S., Fujiki, H., Suganuma, M., Furuya-Sugari, H., Matsushima, R., Iida, Y., Ojika, M., Yamada, K., Uemura, D., Yasumoto, T., Schmitz, F. J. and Sugimura, T. : Carcinogenesis, 11, 1837 (1990). DOI: 10.1093/carcin/11.10.1837
- Kamat, P. K., Rai, S. and Nath, C. : Neurotoxicology, 37, 163 (2013). DOI: 10.1016/j.neuro.2013.05.002
- Tripuraneni, J., Koutsouris, A., Pestic, L., De Lanerolle, P. and Hecht. G. : Gastroenterology, 112, 100 (1997). DOI: 10.1016/s0016-5085(97)70224-5
- Fujiki, H., Suganuma, M., Suguri, H., Yoshizawa, S., Takagi, K., Uda, N., Wakamatsu, K., Yamada, K., Murata, M., Yasumoto, T. and Sugimura, T. : Jpn. J. Cancer Res., 79, 1089 (1988). DOI: 10.1111/j.1349-7006.1988.tb01531.x
- Terao, K., Ito, E., Yanagi, T. and Yasumoto, T. : Toxicon, 24, 1141 (1986). DOI: 10.1016/0041-0101(86)90140-6
- Suzuki, T. and Quilliam, M. A. : Anal. Sci., 27, 571 (2011). DOI: 10.2116/analsci.27.571
- Suzuki, T., Watanabe, R., Yoshino, A., Oikawa, H., Uchida, H., Matushima, R., Nagai, S., Kamiyama, T., Yamazaki, T., Kawaguchi, M., Yarita., T. and Takatsu, A. : "Preparation of Diarrhetic Shellfish Toxins (DSTs) and Paralytic Shellfish Toxins (PSTs) by Large Algal Culture and Chemical Conversion.", Marine and freshwater harmful algae, Proceedings of the 16th International Conference on Harmful Algae, ed. by Mackenzie, L. p. 34 (2014). ISBN 978-87-990827-5-9.
- Watanabe, R., Sugai, C., Yamazaki, T., Matsushima, R., Uchida, H., Matsumiya, M., Takatsu, A. and Suzuki, T. : Toxins (Basel)., 8, 294 (2016). DOI : 10.3390/toxins8100294




