ヒトiPSC由来腸管上皮細胞 F-hiSIEC アプリケーションのご紹介
1. 薬物動態に関する基本性能
F-hiSIECは、薬物透過性評価、トランスポーターの取込/排出量評価、代謝量評価、トランスポーターと代謝酵素の両方に影響を受ける薬物の動態評価に利用できます。
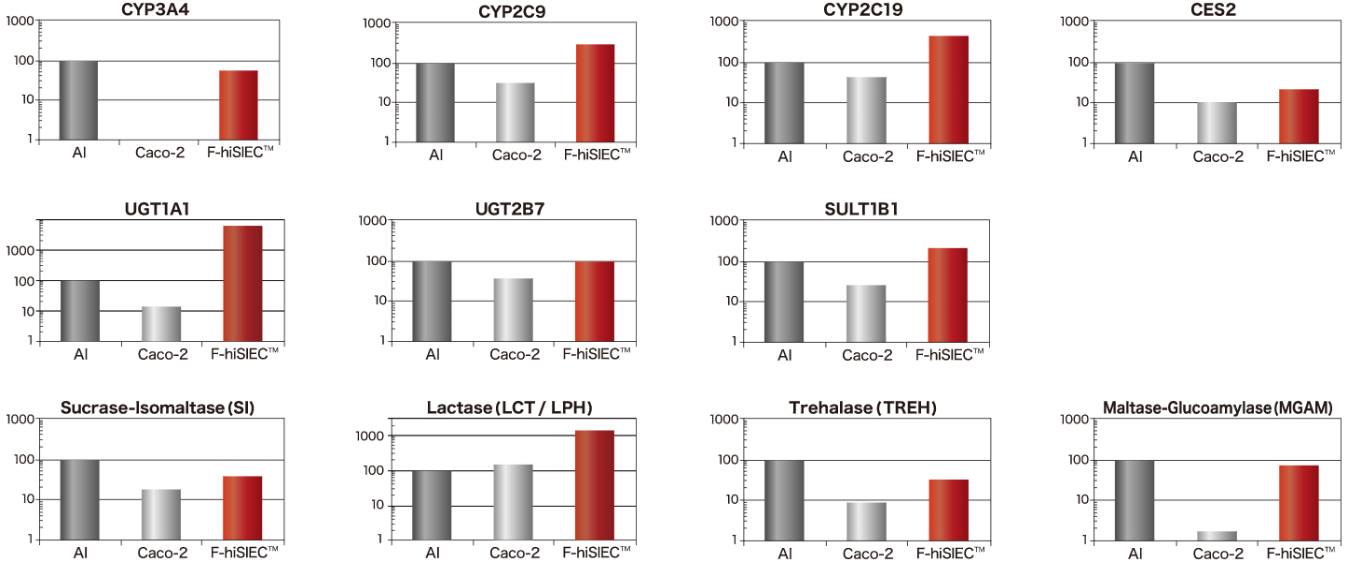
代謝酵素の遺伝子発現
グラフは、生体小腸(AI)を100とした場合の、Caco-2細胞、F-hiSIECの遺伝子発現量を示しています。第1相の薬物代謝酵素(CYP3A4、CYP2C9、CYP2C19、CES2)、第2相の薬物代謝酵素(UGT1A1、UGT2B7、SULT1B1)、二糖加水分解酵素(Sucrase-Isomaltase、Lactase、Trehalase、Maltase-Glucoamylase)について、生体小腸同等の遺伝子発現を⽰しています。
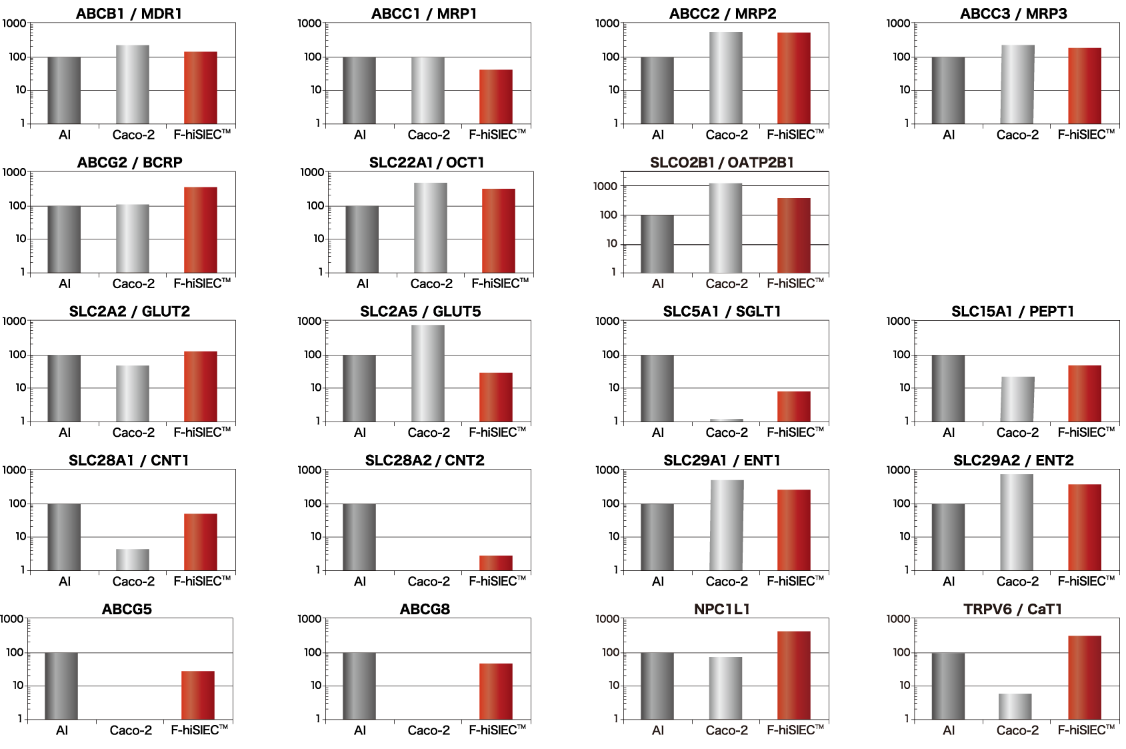
トランスポーターの遺伝子発現
薬物トランスポーター(MDR1、MRP1、MRP2、MRP3、BCRP、OCT1、OATP2B1)、グルコーストランスポーター(GLUT2、GLUT5、SGLT1)、ペプチドトランスポーター(PEPT1)、核酸トランスポーター(CNT1、CNT2、ENT1、ENT2)、コレステロールトランスポーター(ABCG5、ABCG8、NPC1L1)、カルシウムトランスポーター(CaT1)について、⽣体⼩腸同等の遺伝⼦発現を⽰しています。
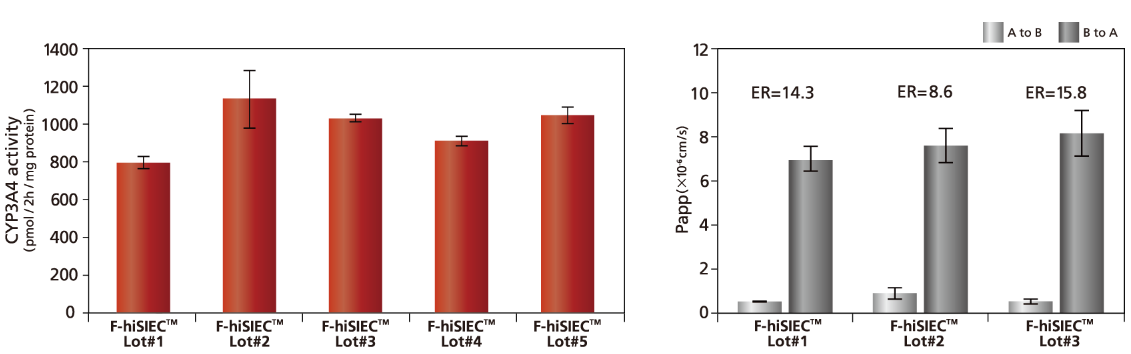
安定した性能(ロット間差)
F-hiSIECは、小腸腸管上皮細胞の主要な代謝酵素(CYP3A4)及び主要なトランスポーター(P-gp)について、活性を有することが確認できています。また、その活性は各ロット間で安定した数値を示しています。
2. 消化管毒性に関する評価
2-1細胞障害性薬物の毒性評価
F-hiSIECは、細胞障害性薬物の消化管毒性評価に利用することができます。
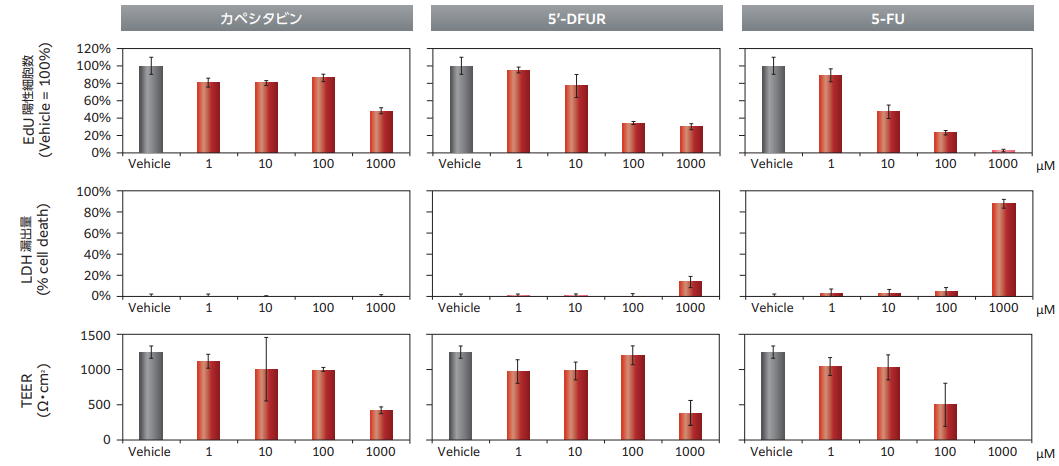
Figure.4では、ヒトで消化管障害を誘発するとされる抗がん剤5-FUとそのプロドラッグ(5'-DFUR、Capecitabine)について、F-hiSIECを用いて評価しました。
細胞障害性が高い5-FUについては、消化管毒性を軽減したプロドラッグが開発されています。プロドラッグであるCapecitabineは、代謝されることで5'-DFCR、5'-DFUR、そして5-FUへと変換されて活性化されます。
5-FUとそのプロドラッグ(5'-DFUR、Capecitabine)をF-hiSIECに作用させたところ、バリア機能(TEER)やEdU陽性細胞数等を指標に、消化管毒性の程度を評価することができました。

2-2 消化管の分化異常を引き起こす薬物の評価
F-hiSIECは、成熟過程で吸収上皮細胞・杯細胞・内分泌細胞・M細胞等の腸管上皮に存在す る6種の細胞へと分化します。そこで、F-hiSIECの分化途中に薬物を作用させることで、腸 管上皮の分化過程に異常をきたすとされる薬物の影響を評価しました。
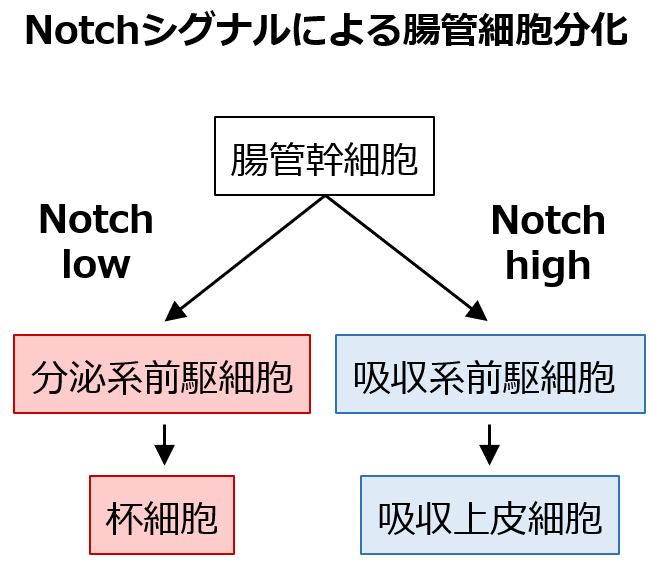
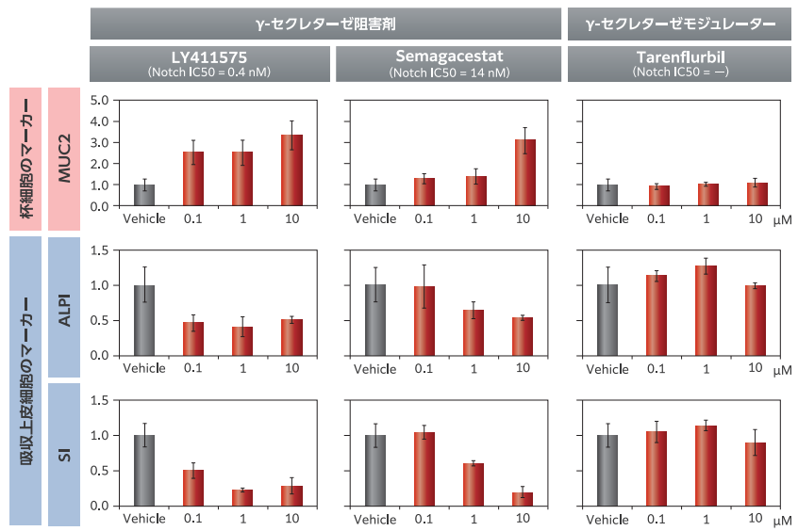
腸管幹を阻害しないGamma secretaseモジュレーターの場 合は、上記細胞はNotchシグナルによって、杯細胞もしくは吸収上皮細胞への分化が制御されて います。Notchシグナルを阻害するGamma secretase阻害剤をF-hiSIECの分化過程に作用さ せると、濃度依存的に杯細胞マーカー(MUC2)が上昇し、吸収上皮細胞マーカー(ALPI, SI)が 下降しました。一方で、Notchシグナルの変動が見られませんでした。 以上から、分化途中に薬物を作用させることで、消化管の分化異常を引き起こす薬物を評 価できる可能性が示唆されました。
Figure 5. 各種細胞マーカーの遺伝子発現とGamma secretase阻害剤/モジュレーターによる遺伝子 発現の変化
F-hiSIEC™をNotch阻害活性を持つγ-セクレターゼ 阻害剤(LY411575、Semagacestat)及び Notch 阻害活性を持たないγ-セクレターゼモジュレーター(Tarenflurbil)で0.1~10μMの濃度で処理しました。 処理 8 日後に、MUC2(杯細胞のマーカー)、ALPI、SI (吸収上皮細胞のマーカー)の発現レベルをreal-time PCR で測定しました。
本データに関して、ご質問のある方はこちら(iPS由来腸管上皮細胞 F-hiSIEC お問い合わせフォーム)のフォームにてお問い合わせください。
参考: 第48回日本毒性学会学術年会(2021年7月) ポスター発表