超高純度ヒト間葉系幹細胞(REC)

超高純度ヒト間葉系幹細胞(REC)は、フローサイトメトリーと選択的マーカーを用いた細胞分離方法によって得られた間葉系幹細胞(MSC)です。通常の接着法で得た間葉系幹細胞とは異なり、REC は一切の夾雑細胞を含まず、⾧期間の培養増幅が可能です。
また一定期間の培養後も分化・遊走能が維持されています。さらに凍結細胞として保存が可能で、いつでも研究に用いることができます。
特長
-
超高純度ヒト間葉系幹細胞(REC)は、間葉系幹細胞に求められる性質をすべて満たしています。
- 増殖性:未分化性を失わずに自己増幅する機能
- 分化能:多種多用な細胞に変化することのできる機能
- 遊走性:体内を循環し適切な場所へ移動し生着する機能
- 用途:骨疾患・免疫疾患・慢性的な炎症性疾患など、治療の難しい疾患を治癒に導く作用
- 移植方法:従来型の局所移入だけでなく全身性移入が可能
-
REC 細胞
技術紹介
ヒト骨髄に存在する高品質MSC の同定と分離方法開発
研究責任者の松崎教授らは、文部科学省・再生医療の実現化プロジェクトを通じてLNGFR (CD271) Thy1 (CD90)の2 種の抗体を用いることで、極めて効率よくヒトMSC を選別することができることを明らかにし、骨髄・末梢血・胎盤絨毛膜・歯髄からセルソータを用いてヒトMSC を直接分離する技術を開発しました。(Mabuchi et al. Stem Cell Reports 2013)
さらに、96 ウェルプレートでLNGFR Thy1 共陽性細胞(LT細胞)を96 穴プレートに単一細胞分離後(B)に各ウェルを個別に観察し、増殖が速く2週間度にはコンフルエントになったクローンをREC(Rapidly Expanding MSC clone)、3週間後にコンフルエントになったクローンをMEC(Moderately Expanding MSC Clone)、さらに遅れてコンフルエントになったクローンをSEC(Slowly Expanding MSC Clone)と分類した(C)。
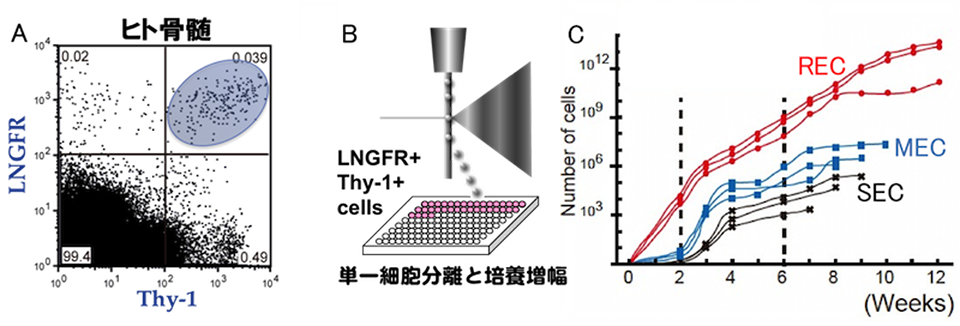
A:ヒト骨髄中のMSC はLNGFR Thy1 共陽性分画(LT細胞)に存在する
B:LT 細胞の単一細胞分離
C:LT 細胞を単一培養して得たMSC クローンは増殖速度の差によって3つのグループに分類できる
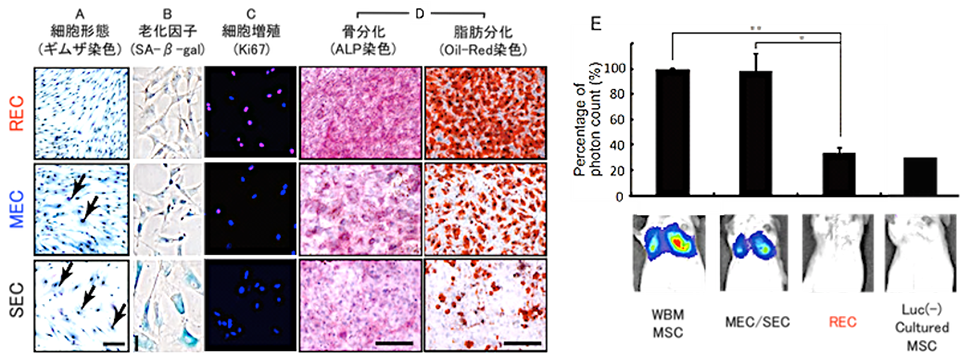
A:REC の細胞形態はサイズが小さく均一である
B:SA-β-gal で染色されない新鮮な細胞である
C:REC の大部分が増殖期にある細胞マーカーであるKi67 陽性である
D:骨分化・脂肪分化共に良好である
E:実験動物への経静脈投与後、肺毛細血管に補足された細胞が認められない
FAQ
REC細胞について
- 細胞の由来を教えてください。
- ドナー骨髄液からセルソーターを用いたシングルセルクローニングで精製分離した高純度間葉系幹細胞です。
- 本製品は、何継代目で凍結保存されていますか?
- 本製品は、第5継代で凍結保存されています。
- 試験成績書、ドナー情報を提供して頂く事は可能ですか?
- 提供可能です。弊社までお問合せください。
- 70%コンフルエントまでの培養日数を教えて下さい。
- 5×103 cells/cm2 で播種して3~5日です。
培養について
- 培地交換頻度を教えてください。
- 播種3日後に1回、50%コンフルエントを超えたら毎日行ってください。
- REC細胞の無血清培養に使用する培地を教えてください。
FUJIFILM Biosciences社の「PRIME-XV MSC XSFM MDF1」を使用し、REC細胞無血清培養プロトコルをご覧ください。
- REC細胞培養プロトコルに使用される試薬情報を教えてください。
DMEM (低グルコース)(L-グルタミン、フェノールレッド含有):Wako #041-29775
FBS:Hyclone #SH30910-03
HEPES緩衝液:Wako #345-06681
ペニシリン-ストレプトマイシン溶液(×100):Wako #168-23191
bFGF:Peprotech #100-18C
STEM-CELLBANKER:Takara #CB045
- 推奨培養条件として血清あり、無血清のプロトコルが公開されているが、この使い分けを教えてください。
- ヒト以外の種由来のものを使用したくないかどうか、実験系に合わせてご選択ください。どちらの条件で培養しても細胞性能に違いはございません。 血清を用いる場合、血清のロットによっては想定通りの結果が得られない場合もございますが、無血清ではそのような影響を受けにくいという利点もございます。
保管について
- 保管温度が-150℃であるが、液体窒素保管でも問題はありませんか?
- 耐性のあるチューブを使用しているため、液体窒素保管でも問題ありません。
- 溶解⇒凍結(再ストック)の可否について教えてください。
- ⇒解凍後、一度培養し再凍結可能です。基本的に解凍後1継代での使い切りを推奨しておりますので、継代を重ねた細胞の再凍結は避けてください。
参考文献
- Liu L, Yang J, Otani Y, Shiga T, Yamaguchi A, Oda Y, Hattori M, Goto T, Ishibashi S, Kawashima-Sonoyama Y, Ishihara T, Matsuzaki Y, Akamatsu W, Fujitani M, Taketani T. MELAS-Derived Neurons Functionally Improve by Mitochondrial Transfer from Highly Purified Mesenchymal Stem Cells (REC). Int J Mol Sci. 2023 Dec 6;24(24):17186. doi: 10.3390/ijms242417186.
- Yang J, Liu L, Oda Y, Wada K, Ago M, Matsuda S, Hattori M, Goto T, Ishibashi S, Kawashima-Sonoyama Y, Matsuzaki Y, Taketani T. Extracellular Vesicles and Cx43-Gap Junction Channels Are the Main Routes for Mitochondrial Transfer from Ultra-Purified Mesenchymal Stem Cells, RECs. Int J Mol Sci. 2023 Jun 18;24(12):10294. doi: 10.3390/ijms241210294.
- Yang J, Liu L, Oda Y, Wada K, Ago M, Matsuda S, Hattori M, Goto T, Kawashima Y, Matsuzaki Y, Taketani T. Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer. Stem Cell Res Ther. 2023 Mar 16;14(1):40. doi: 10.1186/s13287-023-03274-y.
- Suzuki H, Ura K, Ukeba D, Suyama T, Iwasaki N, Watanabe M, Matsuzaki Y, Yamada K, Sudo H. Injection of Ultra-Purified Stem Cells with Sodium Alginate Reduces Discogenic Pain in a Rat Model. Cells. 2023 Feb 3;12(3):505. doi: 10.3390/cells12030505.
- Suyama T, Takemoto Y, Miyauchi H, Kato Y, Matsuzaki Y, Kato R. Morphology-based noninvasive early prediction of serial-passage potency enhances the selection of clone-derived high-potency cell bank from mesenchymal stem cells. Inflamm Regen. 2022 Oct 2;42(1):30. doi: 10.1186/s41232-022-00214-w.
- Ukeba D, Yamada K, Suyama T, Lebl DR, Tsujimoto T, Nonoyama T, Sugino H, Iwasaki N, Watanabe M, Matsuzaki Y, Sudo H. Combination of ultra-purified stem cells with an in situ-forming bioresorbable gel enhances intervertebral disc regeneration. EBioMedicine. 2022 Jan 24;76:103845. doi: 10.1016/j.ebiom.2022.103845.
- Kakizaki M, Yamamoto Y, Nakayama S, Kameda K, Nagashima E, Ito M, Suyama T, Matsuzaki Y, Chiba T, Sumiyoshi H, Inagaki Y, Kotani A. Human hepatocyte-derived extracellular vesicles attenuate the carbon tetrachloride-induced acute liver injury in mice. Cell Death Dis. 2021 Oct 27;12(11):1010. doi: 10.1038/s41419-021-04204-7.
- Toda E, Bai Y, Sha J, Dong QN, Ngo HX, Suyama T, Miyamoto K, Matsuzaki Y, Kanno T. Feasibility of Application of the Newly Developed Nano-Biomaterial, β-TCP/PDLLA, in Maxillofacial Reconstructive Surgery: A Pilot Rat Study. Nanomaterials (Basel). 2021 Jan 25;11(2):303. doi: 10.3390/nano11020303.
- Harada S, Mabuchi Y, Kohyama J, Shimojo D, Suzuki S, Kawamura Y, Araki D, Suyama T, Kajikawa M, Akazawa C, Okano H, Matsuzaki Y. FZD5 regulates cellular senescence in human mesenchymal stem/stromal cells. Stem Cells. 2021 Mar;39(3):318-330. doi: 10.1002/stem.3317.
- Sano H, Watanabe M, Yamashita T, Tanishita K, Sudo R. Control of vessel diameters mediated by flow-induced outward vascular remodeling in vitro. Biofabrication. 2020 Jul 9;12(4):045008. doi: 10.1088/1758-5090/ab9316.
- Mabuchi Y, Morikawa S, Harada S, Niibe K, Suzuki S, Renault-Mihara F, Houlihan DD, Akazawa C, Okano H, Matsuzaki Y. LNGFR(+)THY-1(+)VCAM-1(hi+) cells reveal functionally distinct subpopulations in mesenchymal stem cells. Stem Cell Reports. 2013 Jul 11;1(2):152-65. doi: 10.1016/j.stemcr.2013.06.001.
製品一覧
- 項目をすべて開く
- 項目をすべて閉じる
- 掲載内容は本記事掲載時点の情報です。仕様変更などにより製品内容と実際のイメージが異なる場合があります。
- 掲載されている製品について
- 【試薬】
- 試験・研究の目的のみに使用されるものであり、「医薬品」、「食品」、「家庭用品」などとしては使用できません。
- 試験研究用以外にご使用された場合、いかなる保証も致しかねます。試験研究用以外の用途や原料にご使用希望の場合、弊社営業部門にお問合せください。
- 【医薬品原料】
- 製造専用医薬品及び医薬品添加物などを医薬品等の製造原料として製造業者向けに販売しています。製造専用医薬品(製品名に製造専用の表示があるもの)のご購入には、確認書が必要です。
- 表示している希望納入価格は「本体価格のみ」で消費税等は含まれておりません。
- 表示している希望納入価格は本記事掲載時点の価格です。



