【連載】ヒトiPS 細胞由来分化細胞の創薬応用「第4回 ヒトiPS細胞由来神経細胞における神経回路機能評価法の構築の試み」
本記事は、和光純薬時報 Vol.90 No.2(2022年4月号)において、東京大学大学院 薬学系研究科 薬品作用学教室 馬場 敦様に執筆いただいたものです。

はじめに
医薬品開発の過程において、中枢神経系への安全性の問題により脱落した化合物は約1/4程度を占めると報告されており、依然として大きな課題である1)。その内訳をみると、中枢神経系への副作用発現により脱落する候補化合物の割合は、非臨床試験の段階では約7%程度であるのに対し、臨床試験では34%と全臓器のうち最大となっている2)。この結果は、非臨床試験段階での副作用予測が必ずしも十分に機能していないことを示唆し、in vitroにおいてよりヒト生体神経系に近い評価系を開発する必要性を示している。
また、中枢神経疾患は医薬品開発の主要な標的のひとつであるが3)、神経機能を指標とする有効な探索スクリーニング系は乏しい。これらの課題に対しヒ トiPS細胞由来神経細胞(hiPSC-N)は、①実験動物の代替として利用できるこ と②動物とヒトとの種差を克服できる可能性があること③疾患患者由来iPS細胞からの分化誘導によりアプローチの難しい中枢神経疾患の病態モデルが作製できることから、創薬過程で有効利用することが期待されている4)。
評価系構築におけるヒト iPS由来神経細胞利用の現状と課題
生体内の神経細胞は細胞種毎に異なった形状、神経伝達物質とその受容体、イオンチャネルを発現しており、これらの性質は分化誘導したhiPSC-Nでも保持されている。しかしながら汎用されているげっ歯類由来培養神経細胞に比べ、hiPSC-Nは機能的に成熟するのにより多くの時間を要することがわかっている。このことはヒト生体内では最終位置に移動し分化を終了した神経細胞が一年以上かけて成熟するということと対応し、細胞内部の固有の機構によるものと考えられる5)。
成熟促進の目的で、①生体内を摸倣した培地や培地添加物(BrainPhys™、Neurobasal Plus™など)、②プレート上での配置と自己集積を可能にする培 養プレート(Cell-able®、MicroBrain® 6)など)、③アストロサイトなどグリア細胞との共培養法7)、④3D培養脳オルガノイド作製5,8,9)など種々の開発が行われている。現状で市販のhiPSC-Nを使用した場合、一ヶ月程度の培養期間が必要であり、更なる改良とスループット性を高めた簡便な評価系の必要性が高い。
これまでのところhiPSC-Nを用いて微小電極アレイ(microelectrode array : MEA)によるin vitro 評価系の開発が進んでおり、2D培養で化合物の痙攣誘発性の予測を可能にしている10)。しかしながら生体内では、これらの神経細胞は個々にランダムなネットワークを形成しているように見えたとしても、巨視的に見ればある程度均質かつ限定された種類の細胞がクラスター(たとえば大脳皮質の各層や、海馬の領域など)を形成しており、他のクラスターへと神経線維を伸展し接続している11)。
in vitro でこのようなクラスタードネットワークを再現する試みは古くから存在したが、実験系の安定性や再現性に課題があり、これまで普及してこなかった12,13)。これらが簡便に実現すれば神経ネットワークの機能評価に繋がることが期待される。現在私たちが3D網目構造足場材を用いて行なっている研究について以下に紹介する。
ゼラチン不織布を用いたクラスタードネットワーク作製の試み
ゼラチンは動物結合組織の主成分であるコラーゲンより抽出されたアミノ酸ポリマーであり、親水性で細胞接着性に優れているため、培養用コーティング基材として古くから用いられてきた。これらゼラチンを繊維状に成形し作製した網目構造は、細胞が生存増殖できる空隙をもち、足場材あるいは3D構造体の封入体として利用することが可能である14)。
Genocel®として日本毛織(株)より販売されているゼラチンハイドロゲル繊維不織布(GHFN)は繊維同士が結合したネットワーク構造を有し、光透過性に優れ、長期培養にも安定である。今回我々は繊維素材・繊維径・空隙・不織布の厚みなどを改変し最適化したGHFNを用いた。GHFNを培養プレートに設置し、hiPSCN(iCell® DopaNeurons)を播種したところ、細胞は網目構造の間隙においてGHFN-培養プレート界面に凝集体を形成した。
培養2日目には各凝集体より複数の神経突起が伸展しており、培養16日目までに各凝集体が接続した。この構造体はある程度まとまった大きさの球状の凝集体より複数の神経突起が束状にまとまって連結していた。共焦点イメージング装置CellVoyager™ CQ1(横河電機)を用い確認したところ、3D構造体の性質をもちつつほぼ同一平面上での撮影が可能であった。
凝集体の大きさと神経突起の太さは、使用するGHFNの網目径によりある程度制御できる。Ca蛍光指示薬を用いて神経発火を経時測定したところ、クラスター内部では各細胞の神経発火とともに複数細胞の同時発火、さらに複数クラスターでの同期発火が観察できた。これらCa変動の幅・頻度もGHFNの網目径に依存した。
各クラスター領域のCa変動を図1Dに示す。大きなCa変動に着目した場合、各クラスターの同期しやすさは明確にわかれており、複数回測定しても再現可能であった。すなわち構造体内部には連結強度の異なる複数のネットワークが互いに重なり合う状態で存在することが示唆される。
また、画像中のクラスター間距離は最長で数mm以上離れているが、一定頻度で全てのクラスターが同期し発火する。各クラスターの同期発火のタイミングには再現性よくわずかなズレがあり、同一平面上の撮影で単一クラスターからの伝達が評価可能と考えられた。作製した構造体はGHFNによりプレート上に保持されており、一ヶ月以上維持できた。
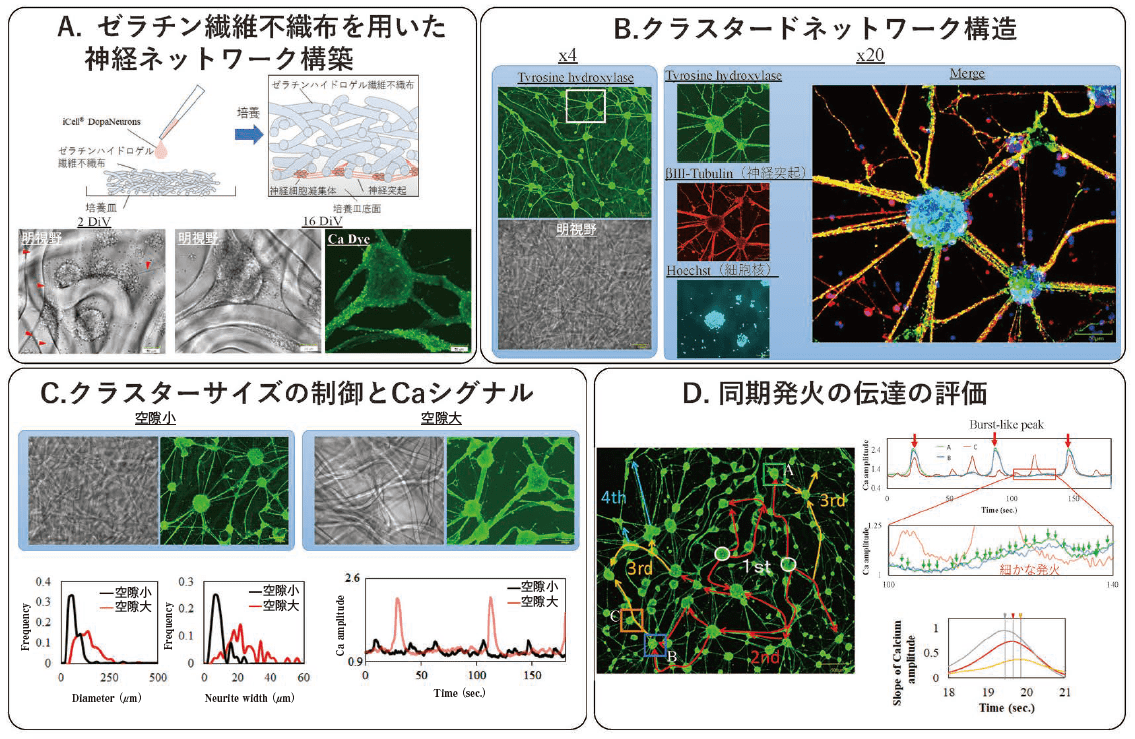
図1.ゼラチンハイドロゲル繊維不織布(GHFN)を用いたiPS 細胞由来神経細胞クラスタードネットワークの構築
実験にはiCell® DopaNeurons(FUJIFILM Cellular Dynamics)を使用した。培養プレート上に設置したGHFN 上に6,000 cells/mm2 で播種し、BrainPhys Neuronal Medium(STEMCELL Technologies)で維持培養した標本を使用した。EarlyTox(Molecular Device)を負荷した標本でCa イメージングを行なった(3 frame/ 秒)。画像取得および解析には、共焦点イメージング装置(CellVoyager™ CQ1, 横河電機)およびCellPathfinder™(横河電機)を用いた。(A)(上段)作製した標本の模式図。播種した細胞はGHFN を通過し培養プレートとの界面で凝集体を形成し保定されている。各凝集体は神経突起由来の太い線維状構造体で連結しており、培養底面から離れた空間にGHFN 繊維に支持される。(下段左)培養2日目標本の明視野像。赤矢頭は凝集体より伸展する神経突起を示す。(下段中右)16 日目標本の明視野像と、Ca イメージング画像。(B)培養15 日目の固定標本の蛍光抗体染色像。PFA 固定・洗浄ののち、anti-Tyrosine Hydroxylase(ドーパミン神経;緑)・anti-βIII-Tublin(神経突起;赤)・Hoechst33342(核;青)で三重染色した。神経細胞の細胞体がほぼ凝集体内部に集積し、突起状構造体内部に複数の神経突起が存在する。(C)GHFN の網目径を変え作製した標本例。(上段) 播種前GHFN の明視野像と作製した培養16 日目の標本のCa 蛍光像。(下段)作製した標本のクラスター径(左)、突起状構造体の直径(中)の分布、Ca 変動の代表例(右)。空隙径によりクラスター径、突起径、Ca 変動いずれも変化する。(D)同期発火伝達の評価法。(右上)任意3点のクラスターのCa 変動の重ね合わせたもの。クラスター間でタイミングが同期する大きな変動の他に、法則のみられない小さな変動が観察できる。多点クラスター間でCa 変動が同期した場合、Ca 蛍光変化の傾きをプロットし(右下)変曲点を検出しピークのタイミングのずれを可視化した。元波形でほぼ同期していたとしても、厳密にピーク位置のズレがあることがわかる。(左)作製した構造体のCa 蛍光像。同期発火の伝達図中3点のクラスターはそれぞれの左のトレースに対応する。各クラスター間をどのように伝達していたかを矢印で示した。この標本では中心2箇所で生じた発火が、それぞれクラスターを乗り越えて伝達していたことが可視化できた。上記手法により作製した構造体に、各種薬物を添加した例を図2に示す。in vitro でてんかん様活性を引き起こすことが知られているK+チャネル阻害薬4-アミノピリジン(4-AP)を適用した場合、濃度依存的に総発火数が増加するとともに同期発火の間隔が短縮した。
ラスタープロットで多点クラスターの発火と同期を可視化したところ、発火数の増加とともに同期発火のシグナルが埋没することが観察された。図1Dで示すように同期発火のタイミングのずれから伝達の順番が解析できたことから、神経伝達あるいは伝導を抑制する各種薬物の効果を検討した。
Na+チャネル阻害薬テトロドトキシン、カルバマゼピンの適用によりクラスター間の大発火が同期しなくなり、最終的には大発火が消失した。また、グルタミン酸遊離および受容体阻害薬であるリルゾールの適用により、発火振幅は著しく減弱した。
これらの結果から、①すくなくとも大発火(同期発火)が神経伝達・伝導を介することが示唆され、②各クラスターにはドパミン神経のみでなく多種の神経が含まれる集合体であることが明らかとなった。
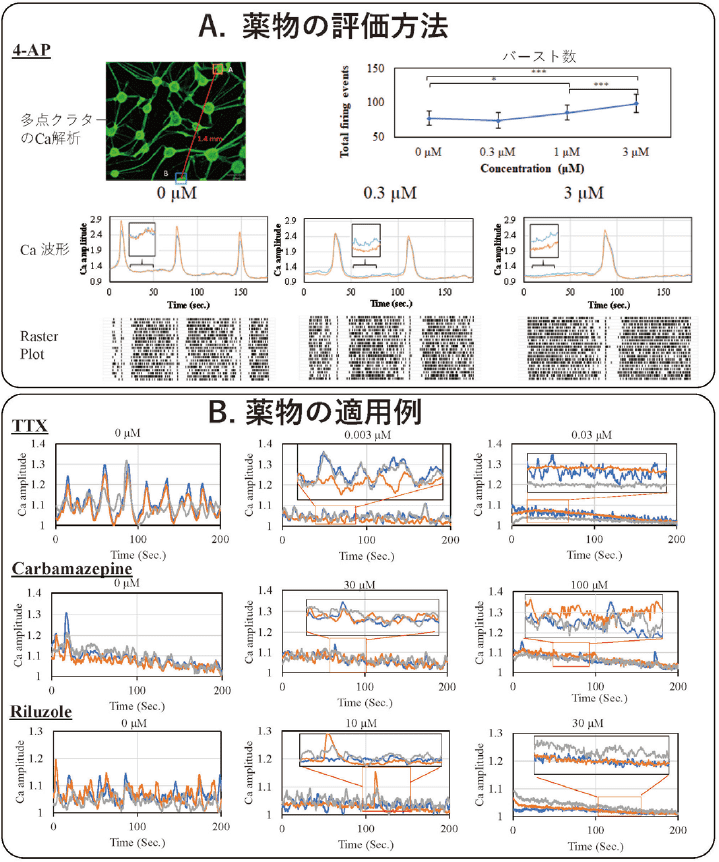
図2.iPS 細胞由来神経細胞クラスタードネットワークにおける薬剤応答の評価
培養 15 日目の標本に EarlyTox®(Molecular Device)を負荷し、薬物を累積投与 10 分後、各濃度毎に3分間のCa イメージングを行なった(3 frame/ 秒)。画像取得および解析には、共焦点イメージング装置(CellVoyager™ CQ1, 横河電機)およびCellPathfinder™(横河電機)を用いた。(A)神経細胞の興奮性を上昇させるK+ チャネル阻害薬4- アミノピリジン(4-AP)を適用したときの実験例。タイムラプス画像よりCa 蛍光像(上段左)の各クラスター部の平均蛍光強度を算出し、代表的2クラスターのトレースを示した(中段)。このクラスター間では大きな変動パターンが一致しているが、小変動はクラスター毎に異なる。変動にはクラスター内小集団の発火も含まれる。全クラスターについて全ての変動のピークを算出しラスタープロットを作成した(下段)。4-AP の濃度依存的に発火数が増加(上段右)し、かつ同期の間隔が延長した。(B)電位依存性Na+ チャネル阻害薬テトロドトキシン(TTX、上段)、カルバマゼピン(中段)、グルタミン酸遊離および受容体阻害薬であるリルゾール(下段)を適用したときの、各3クラスターのトレース。最後に
本系における薬剤の効果はクラスターを構成する細胞種に依存することが予想され、興奮性/抑制性神経やグリア細胞などとの混合播種により改良を試みる予定である。今後はMEA計測や各種薬剤の適用により既存の評価系との補完性あるいは外挿性を検証する。
また、近年、複雑な精神症状を呈する疾患が神経ネットワーク形成の破綻に起因することが少しずつ明らかになってきており、本系での疾患hiPSC-Nの利活用とその構造評価によりin vitro評価系構築への応用も期待したい。
謝辞
本稿の執筆にご協力いただきました、日本毛織(株)早乙女俊樹様、東京大学大学院薬学系研究科化学物質安全性評価システム構築社会連携講座の澤田光平客員教授、加藤英里子様、テクノプロR&D(株)岸森弘子様に御礼申し上げます。
参考文献
- Walker, A. L. et al. : Exp. Biol. Med.(Maywood), 243, 1037 (2018).
- Cook, D. et al. : Nat. Rev. Drug Discov., 13, 419 (2014).
- Authier, S. et al. : J. Pharmacol. Toxicol. Methods, 81, 37 (2016).
- Silva, M. C. and Haggarty, S. J. : Ann. N.Y. Acad. Sci., 1471, 18 (2020).
- Woodruff , G. et al. : PLoS One, 15, e0240991 (2020).
- Suzuki, I. K. and Vanderhaeghen, P. : Development, 142, 3138 (2015).
- Kayama, T. et al. : Biochem. Biophys. Res. Commun., 495, 1028 (2018).
- Sakaguchi, H. et al. : Stem Cell Reports, 13, 458 (2019).
- Costamagna, G. et al. : Int. J. Mol. Sci., 22, 2659 (2021).
- Ishibashi, Y. et al. : Toxicol. Sci., 184, 265 (2021).
- Bassett, D. S. et al. : Nat. Rev. Neurosci., 19, 566 (2018).
- Gabay, T. et al. : Physica A, 350, 611 (2005).
- Teller, S. et al. : PLoS Comput. Biol., 10, e1003796 (2014).
- Matsuno, K. et al. : Regen. Ther., 14, 160 (2020).
シリーズ終了にあたって
2021 年04月(Vol. 89 No. 2)から始まりました「ヒトiPS細胞由来分化細胞の創薬応用」は、本稿をもちまして最終回を迎えました。本誌に寄稿いただきました先生方に、この場を借りて御礼申し上げます。本シリーズではヒトiPS細胞由来分化細胞について、その創薬応用に視点を据えた情報をお届けしました。皆様のiPS細胞研究、そして創薬への展開の一助になりましたら幸いです。全4回に渡った本連載をご愛読いただき御礼申し上げます。








