【連載】ヒトiPS 細胞由来分化細胞の創薬応用「第3回 ヒト iPS細胞由来肝細胞を用いたin vitro肝評価系構築の可能性」
本記事は、和光純薬時報 Vol.90 No.1(2022年1月号)において、崇城大学 生物生命学部 石田 誠一様に執筆いただいたものです。

はじめに
ヒトiPS細胞由来の肝細胞は、iPS細胞の研究初期の段階から多くの分化誘導法が報告されているにもかかわらず、創薬への応用が進まない細胞の一つとされてきた。筆者はAMED再生医療実用化研究事業「ヒトiPS細胞由来肝細胞を用いた医薬品の肝毒性を予測・評価するin vitro試験法の開発研究」(2017年-2019年)において、iCell-hep等のiPSC細胞由来肝細胞の肝毒性評価項目への適用性について検討を行った。班での研究を開始するにあたり創薬の現場におけるヒトiPS細胞由来肝細胞を用いたin vitro肝毒性評価系のユーザーニーズを調査したところ、・反復投与細胞障害性試験 ・薬物代謝酵素P450-CYP誘導性試験 ・胆汁排泄阻害試験 ・脂肪肝誘導性試験が挙げられた。
本稿では、この研究班で得られた知見をもとに、特に脂肪肝誘導性試験へのiCell-hepの適用性を紹介する。また、iPS細胞由来肝細胞の創薬応用の可能性について最後に議論する。
iCell-hepを用いた脂肪蓄積評価
まず、CDI社が推奨する培養法にてiCell-hepを培養し、培養期間の最後1日の培地にオレイン酸を添加した(図1A)。得られた培養細胞を常法に従いOil Red O染色を行い、脂肪の蓄積を観察した(図1B)。その結果、オレイン酸未添加の細胞では脂肪の蓄積が観察されず、オレイン酸添加細胞で明瞭な脂肪蓄積が観察された。
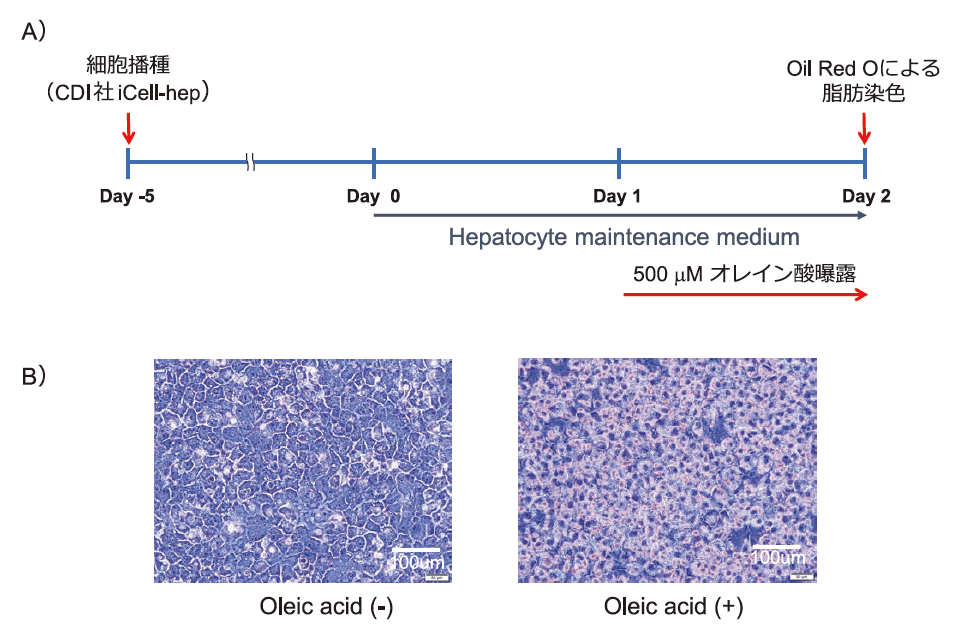
図1.脂肪蓄積評価
A) 培養スケジュール。B) iCell ヘパトサイトへの脂肪蓄積。オレイン酸を培地に添加し、1日間培養することによって全ての細胞で脂肪滴が観察された。
我々の研究室の培養経験では、ヒト凍結肝細胞などヒト組織に由来する肝細胞ではオレイン酸未添加でも脂肪蓄積が観察されることが多く、陰性対照を置きにくいという欠点があった。その点、iCell-hepでは陰性対照でOil Red O染色が低いため、脂肪蓄積の観察が容易になると考えられる。そこで次に脂肪蓄積のうちリン脂質の合成と蓄積について検討を行った。結果を図2Aに示す。
細胞を一定期間培養後、Propranololに2日間曝露した。Propranololはリン脂質蓄積を誘導することが知られている薬剤である。得られた細胞をLipidTOX(Thermo Fisher Scientific)を用いて染色し、中性脂肪とリン脂質を観察したところ、リン脂質の染色像が特異的に得られた。本結果はiCell-hepに脂肪蓄積性能があるだけでなく、リン脂質蓄積を誘導する薬剤によりリン脂質合成能を有していることを示唆している。
さて、AMED研究班での検討項目である反復投与細胞障害性試験の開発により、iCell-hepは培地を工夫することで30日間の長期の培養維持が可能であることが判明してきた1)。そこで、この培養法を用いて、反復投与によりリン脂質症を誘導することが知られているAmiodaroneの長期曝露を試みた。図2Bに示すように、長期曝露終了時にリン脂質の蓄積が確認できた。
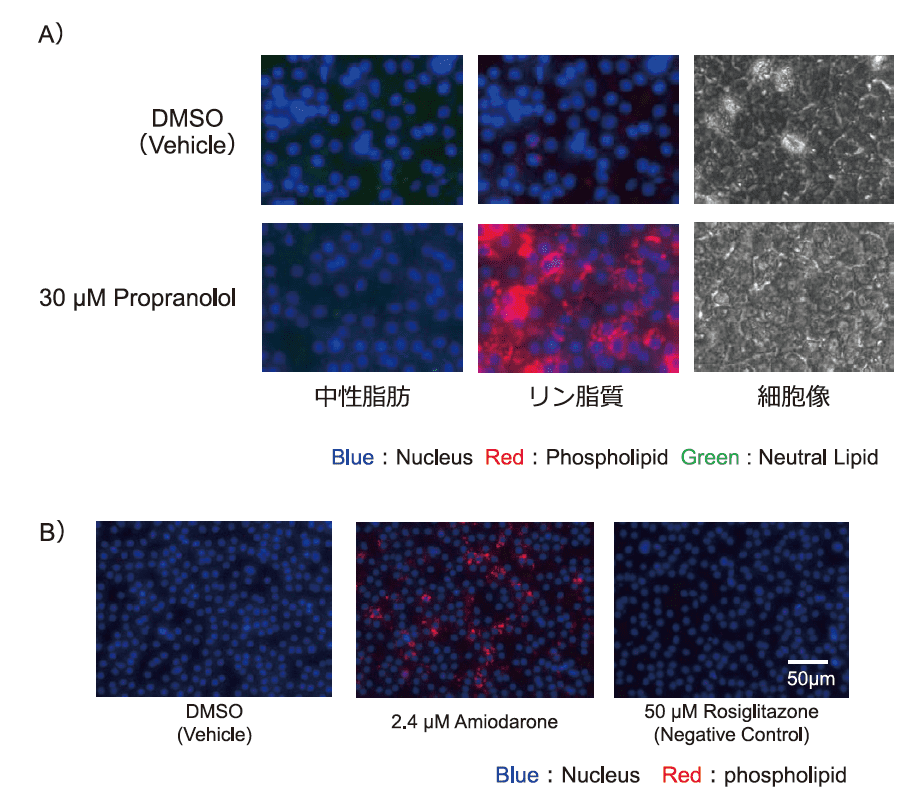
図2.化合物によるリン脂質の誘導
A) リン脂質蓄積を誘導することが知られているPropranolol に曝露することで、リン脂質が特異的に蓄積することが示された。LipidTOX(Thermo Fisher Scientific)による中性脂肪とリン脂質染色像。iCell ヘパトサイトがリン脂質の合成能を有していることを示唆している。Propranolol:リン脂質蓄積を誘導することが知られている。B) Amiodarone への反復暴露によるリン脂質の蓄積21 日間(播種後9日目から30 日目まで)のAmiodarone への反復暴露によりリン脂質が蓄積されていた。Amiodarone:反復投与によりリン脂質症を誘導することが知られている。Rosiglitazone : Negative Control
以上、二つの実験で示してきたように、iCell-hepは凍結肝細胞などでは観察しにくい脂肪蓄積の検証が容易なこと、また、長期間培養維持できるという特性を活かすことで反復投与によるリン脂質の蓄積を検討できる培養系である点で、冒頭に挙げたユーザーニーズのうち脂肪肝誘導性試験について有用な細胞であると考えられる。
非アルコール性脂肪肝炎:NASH
非アルコール性脂肪肝炎(nonalcoholic steatohepatitis:NASH)は、非アルコール性脂肪性肝疾患(nonalcoholic fatty liver disease:NAFLD)から進行した肝炎の一病態であり、その4人に1人は肝硬変や肝細胞癌を引き起こす可能性があるとされている2)。現在NAFLDの世界における罹患率は約25%に達し、増加の傾向にある。
2021年8-9月に開催されたthe World Congress on Alternatives and Animal Use in the Life Sciencesにおいて"NASH, the liver disease of the 21st century?"と題したシンポジウムが組まれた例が示すように医療や創薬の現場において注目を集める現代の疾患となっている。
NASHやそれに先立つNAFLDの引き金は肝臓における脂肪蓄積である。上記で述べたようなiCell-hepの脂肪蓄積性の易観察性はこのような疾患に対する治療薬開発にとって有益なin vitro細胞アッセイ系を提供できる可能性があると考えられる。
肝星細胞との共培養系:MPS への展開
NASHに伴う病態の進行は肝臓の線維化を伴い、肝硬変へと移行していく。肝臓の線維化において重要な役割を担うのが、肝星細胞である。肝星細胞は健常な肝臓においてはビタミンA貯留細胞として機能している(静止期星細胞)が、一旦肝障害が起こると、肝障害による刺激が引き金となり線維芽様細胞に変化し、コラーゲンを産生するようになる(肝星細胞の活性化)。その結果として肝臓の線維化が惹起される。
肝星細胞は生体環境から取り出しin vitro培養に供すると活性化してしまい、静止期星細胞を得るのが困難であることが知られている。我々の研究室では、一旦活性化してしまった星細胞を底面が多孔質膜の3次元培養カルチャーインサートで培養することで脱活性化し、静止期星細胞に近い形質を示すことを見いだしている3)。この星細胞の活性化-脱活性化をコントロールできる培養系は、脂肪蓄積を誘導できるiCell-hepと共培養することで、NAFLDやNASHの治療薬開発の試験系として有望であると考えている。このような共培養系には現在開発が進むMPS(microphysiological system:生体模倣システム4))が適すると考え、現在検討を進めている。
おわりに:iPSC-hepの適用範囲
冒頭で、iPS細胞由来の肝細胞は創薬応用への展開が進んでいないことを述べた。その一つの原因が、iPS細胞由来の肝細胞における薬物代謝酵素P450-CYPの活性が高くない点となっているのは否めない。しかし、一方で本稿で述べたように、iCell-hepは30日間の培養維持が可能であり、脂肪蓄積の易観察性や薬物によるリン脂質合成能も有している。また、本誌で以前紹介させていただいたように、毛細胆管の形成においては従来の凍結肝細胞のサンドイッチ培養より優れた能力を持っている1)。
本シリーズの主題である"ヒトiPS細胞由来分化細胞の創薬応用"について、特にiCell-hepの創薬応用を考えていく上では、in vitro細胞アッセイにおけるヒト肝細胞利用についてのContext of Useを十分に吟味し、細胞の適用範囲をしっかりと定めることで、その可能性を見直すことが出来ると考える。その議論を今一度することで、iCell-hepの創薬応用が拡がることを期待している。
参考文献
- 石田誠一:和光純薬時報,89,(1), 6 (2021).
- Loomba, R. et al. : Cell, 184, 2537 (2021). DOI: 10.1016/j.cell.2021.04.015
- Horiuchi, S. et al. : AATEX. 23, 53 (2018). DOI: 10.11232/aatex.23.53
- Ishida, S. : Academic Press, pp.181-213 (2020).








