【総説】高性能かつ高純度n型有機半導体BQQDI群の合成のための鍵前駆体
本記事は、和光純薬時報 Vol.90 No.1(2022年1月号)において、東京大学大学院 新領域創成科学研究科 物質系専攻 熊谷 翔平様、岡本 敏宏様に執筆いただいたものです。
はじめに
近年、軽くてフレキシブルな半導体デバイスが関心を集めており、ディスプレイ、センサー、電子タグなどの電子デバイスから薄膜太陽電池のような発電デバイスまで、多岐に渡る研究がおこなわれている。これらの中核材料の一つである半導体として、従来はシリコンが用いられていたが、最近ではより軽量性、フレキシビリティ、生体・環境適合性などに優れる有機半導体材料の開発や、有機電界効果トランジスタ(Organic Field-Eff ect Transistor : OFET)、有機発光ダイオード(Organic Light-Emitting Diode : OLED)、有機薄膜太陽電池(Organic PhotoVoltaic Cell : OPV)などへの応用研究が精力的に展開されている。
半導体の重要な電子的性質の一つに、主として伝導するキャリアの種類(正孔/電子)が挙げられる。シリコンの場合は、ホウ素やリンなどの不純物をドープすることで正孔伝導(p型)と電子伝導(n型)とが制御されている。一方で、有機半導体デバイスでは最高被占軌道(Highest Occupied Molecular Orbital : HOMO)や最低空軌道(Lowest Unoccupied Molecular Orbital : LUMO)が伝導に関わり、現実的な方法でHOMOやLUMOにキャリアをドープしなけ ればいけないため、その軌道準位がp型とn型の性質を決める重要な指標となる。
また、キャリアの流れやすさ(移動度)も半導体の重要な性質の一つであり、固体中での結合・集合体構造に影響される。有機半導体は、パイ共役系の構造により分子軌道準位や集合体構造を幅広く制御できるため、多彩な分子設計性に立脚した材料開発により、シリコンでは困難な半導体デバイスの開発が期待される。
我々は最近、主にOFETへの応用を指向し、3,4,9,10-ベンゾ[de]イソキノリノ[1,8-gh]キノリンテトラカルボン酸ジイミド(3,4,9,10-benzo[de]isoquinolino[1,8-gh]quinolinetetracarboxylic diimide: BQQDI)骨格(図1)からなる高性能n型有機半導体材料の開発を進めている1-3)。
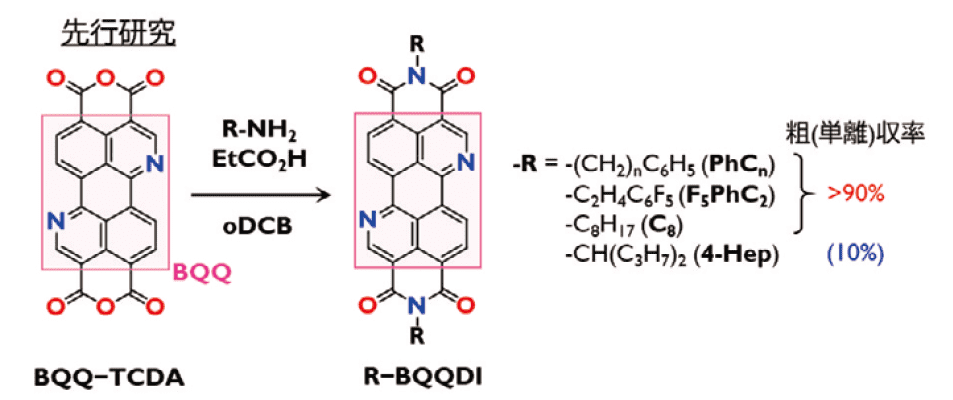
図1.BQQ 骨格と、先行研究におけるR-BQQDI の合成方法と代表的な収率
BQQDI骨格は、n型有機半導体や色素として広く知られるペリレンジイミド(3,4,9,10-perylenetetracarboxylic diimide : PDI)に類似した分子構造であるが、ペリレン骨格に電気陰性な窒素原子を置換することでLUMO準位を0.3 eV程度深められることが分かった。−4.0 eV(真空準位基準)より深いLUMOを持つ有機半導体は大気安定なn型OFETとして有用であるが4)、BQQDI誘導体のLUMO準位は、密度汎関数計算およびサイクリックボルタンメトリーによりそれぞれ−4.17 eVおよび−4.11 eVと見積もられ、有望なn型有機半導体として幅広い材料開発が期待される。
また、BQQDIやPDIなどイミド結合を持つ有機分子では、イミド窒素上に様々な置換基を導入することで集合体構造や電子状態を変えることが可能である。そこで、様々な置換基を持つBQQDI誘導体の合成に興味が持たれるが、従来の合成方法にはいくつかの課題が残されていた(詳細は次項で述べる)。本稿では、この課題を克服するためにおこなった合成研究で得られた知見を基に、BQQDI誘導体合成のための鍵前駆体と得られた誘導体の合成、集合体構造およびOFET特性について解説したい5)。
BQQDI の新規鍵前駆体と合成方法
これまでに報告されていたBQQDIのほとんどは、イミド置換基として直鎖アルキル基やフェニルアルキル基のような、イミド窒素にメチレン基が結合したものであった。一方、参考文献1)ではメチン基が結合した4-ヘプチル基置換BQQDI(4-Hep−BQQDI)を報告しているが、収率が10%と極端に低かった(図1)。
今後の研究展開においてこのような合成収率の低さは弊害であると考えたため、我々はBQQDI誘導体の合成方法について再考することとした。元々、BQQDIの合成には3,4,9,10-ベンゾ[de]イソキノリノ[1,8-gh]キノリンテトラカルボン酸二無水物(3,4,9,10-benzo[de]isoquinolino[1,8-gh]quinolinetetracarboxylic dianhydride : BQQ−TCDA)が用いられていた。これは、PDIで一般に用いられる前駆体(3,4,9,10-perylenetetracarboxylic dianhydride : PTCDA( CAS RN® 128-69-8))に倣っている。
なお、PTCDAは様々なPDI化合物に良好な収率で誘導することができるため、反応性に関してはBQQ−TCDAとの間に本質的な差異があると推察される。この詳細については追究の余地があるが、現在のところ、深いLUMOレベルおよび分子間相互作用の増強を目的として骨格に導入した電気陰性な窒素による、電子的な効果や溶解性の低下によるものと考えられる。さて、BQQ−TCDAは1,5-ジニトロアントラキノンを出発原料として7ステップで合成されている(図2)1)。
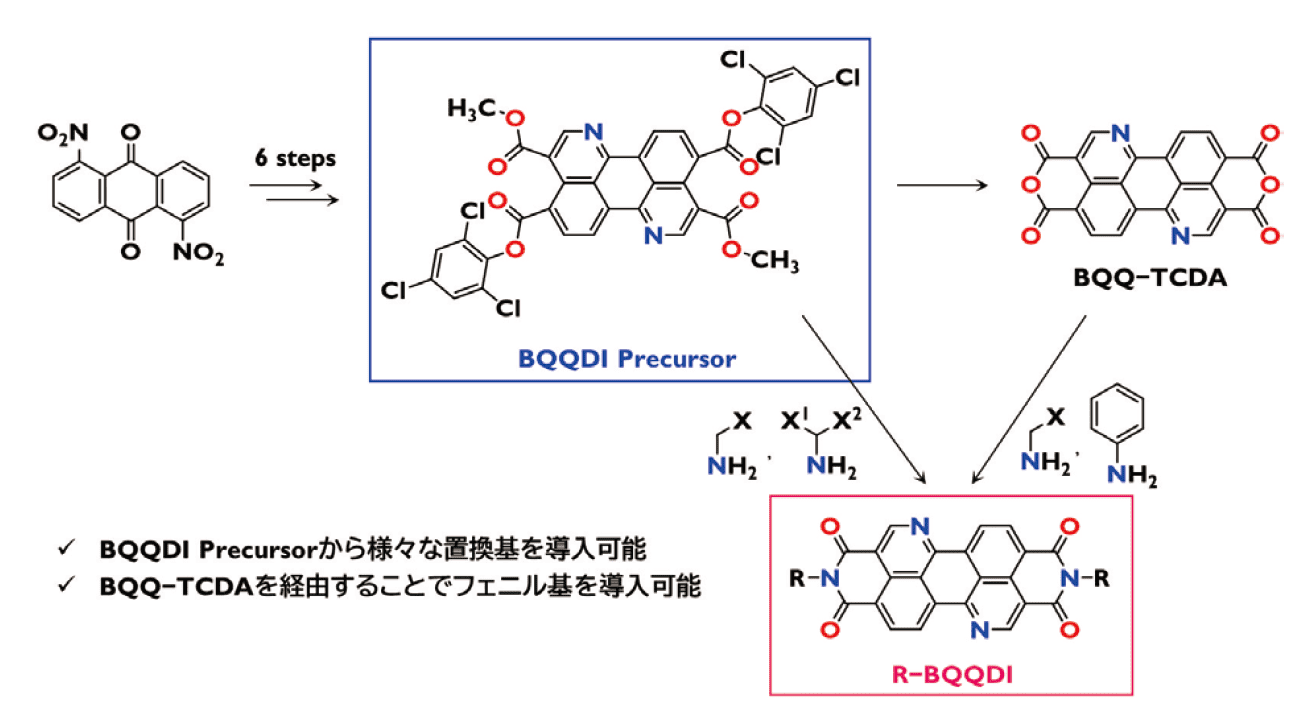
図2.BQQDI Precursor を鍵前駆体としたBQQDI 誘導体の合成スキーム
ここで、BQQ−TCDAの前駆体として得られる、BQQの3,9位にメチルエステル、4,10位に2,4,6-トリクロロフェニルエステルを有する(テトラエステル体)化合物に着目した(図2青枠)。すなわち、エステル−アミド交換反応によりテトラエステル体に目的置換基をアミドとして挿入し、続くアミドとエステルとの分子内閉環反応により、イミド結合ができないかと考えた。
この検証のため、テトラエステル体を用いて4-ヘプチル基の導入を試みたところ、収率86%で4-Hep−BQQDIを得ることができた(ここでは閉環反応を促進するために過剰量のプロピオン酸を用いた)。さらに、類似する分枝アルキル置換基として、シクロヘキシル基置換BQQDI(Cy6−BQQDI)の合成を試みたところ、94%の高収率で粗体が得られた。
この反応において重要なポイントの一つは、隣接するエステル部位が異なる置換基を持つことである。例えば、目的の分子内反応を進行させるためにはアミドとエステルが隣接する必要がある。すなわち、分子内反応が起こる前に両方のエステルがアミド交換されてしまうと、その後の反応が極端に進行し難くなる。テトラエステル体の場合、2,4,6-トリクロロフェニルエステルはメチルエステルに比べて求電子性が高いために6)、速やかにエステル−アミド交換が起こる。
一方でメチルエステルのアミド交換は有意に確認されていない。すなわち、はじめに2,4,6-トリクロロフェニルエステルのアミド交換が起こり、その後アミド窒素が分子内のメチルエステルを求核攻撃(分子内閉環反応)することで目的のBQQDIが生成される。したがって、テトラエステル体は高収率・高選択的なBQQDIの合成に適した前駆体と言える。
ところで、テトラエステル体とアニリンとの反応によりフェニル基置換BQQDI(Ph−BQQDI)の合成を試みたところ、目的物の生成はほとんど確認されなかった。今後の検証が必要であるものの、これはフェニル基の共鳴効果によるアミノ基の求核性低下に起因すると推察される。一方で、BQQ−TCDAを原料に用いると、粗収率91%でPh−BQQDIが得られた。求核性の低さにも依らず、なぜBQQ−TCDAとアニリンとの反応が進行したのか、これについても追究が必要だが、仮説の一つにイソイミドからイミドへの異性化反応を経由する機構が挙げられる7)。
反応機構の解明を含めて、BQQDIの合成や新規材料開発に関する今後の展開には高い関心と研究の余地がある。フェニル基や類縁体の導入には一度BQQ−TCDAに変換する必要があるものの、テトラエステル体はあらゆる置換基を持つBQQDIの最も重要な鍵前駆体であることから、以降は"BQQDI Precursor"と称したい。
新しいBQQDI誘導体 Cy6-BQQDIの結晶構造とOFET 特性
BQQDI Precursorを用いた合成経路の開拓により得られたBQQDI化合物について、単結晶構造解析やOFET特性の評価をおこなった。ここでは、特に興味深かったCy6−BQQDIについて、Ph−BQQDIと比較しながら述べる(図3)。
![図3.Ph−BQQDI とCy6−BQQDI の結晶構造とLUMO 間トランスファー積分(単位:ミリ電子ボルト[meV])](images/si34471_img04.png)
図3.Ph−BQQDIとCy6−BQQDIの結晶構造とLUMO間トランスファー積分(単位:ミリ電子ボルト[meV])
Cy6−BQQDIの単結晶は、ニトロベンゼンから再結晶をおこなうことで、茶色板状結晶として得られた。一方、Ph−BQQDIの単結晶は、物理気相輸送法8)により赤色板状結晶として得た。
単結晶X線回折装置を用い室温で結晶構造解析をおこなったところ、Ph−BQQDIはBQQDI化合物に典型的な隣接分子間相互作用によるアンバランスなレンガ塀型(ブリックワーク)集合体構造を有することがわかった。「典型的な」とはカルボニル基の酸素(O)とBQQ骨格中の窒素(N)を含むC−H...OおよびC−H...N相互作用を指し、直鎖アルキル基やフェニルアルキル基を置換基としたBQQDIでも広く共通する特徴である1-3)。一方で、Cy6−BQQDIにもC−H...OやC−H...N相互作用の効果が示唆されるものの、それぞれに寄与するC−Hの位置が異なった。
すなわち、Ph−BQQDIなどにおいてO・Nはそれぞれオルト位・ベイ位のHと相互作用するが、Cy6−BQQDIではいずれもオルト位のHと相互作用している。この違いにより、Cy6−BQQDIはバランスの良いブリックワーク構造に積み重なることができた。このようなバランスの取れた集合体構造は、効率の良い電子伝導に有利と考えられるため、単結晶による電子伝導性の検証を試みた。
Cy6−BQQDIは、塗布結晶化手法であるエッジキャスト法(図4a)9)により最薄で7−8 nm(約3分子層)の薄さの単結晶薄膜を成膜することができた。金(Gold)電極を用いた単結晶OFET評価により、Cy6−BQQDIは大気下で安定なn型OFET挙動を示し、平均1.8 cm2 V−1 s−1(最高2.3 cm2 V−1 s−1)の移動度が推定された(図4b-d)。BQQDIにおける我々の知見に基づくと、この値はフェネチル置換BQQDI(PhC2−BQQDI(CAS RN® 2170835-67-1))に次ぐ優良なものである1)。
一方、物理気相輸送法で得られた薄板状単結晶(厚さ約200 nm)を基板に貼り付けることで作製されたPh−BQQDIの単結晶OFETは、移動度1.0 cm2 V−1 s−1を示した。したがって、Cy6−BQQDIはプロセス性・OFET特性共に優れたn型有機半導体であると言え、これは前に述べたバランスの良い集合体構造に起因すると考えられる。また、Cy6−BQQDIは真空蒸着法を用いた多結晶OFETでも1.0 cm2 V−1 s−1の高移動度が観測されている。再現性に課題が残されているものの、材料開発・デバイス応用の両面から、今後の展開が期待される。
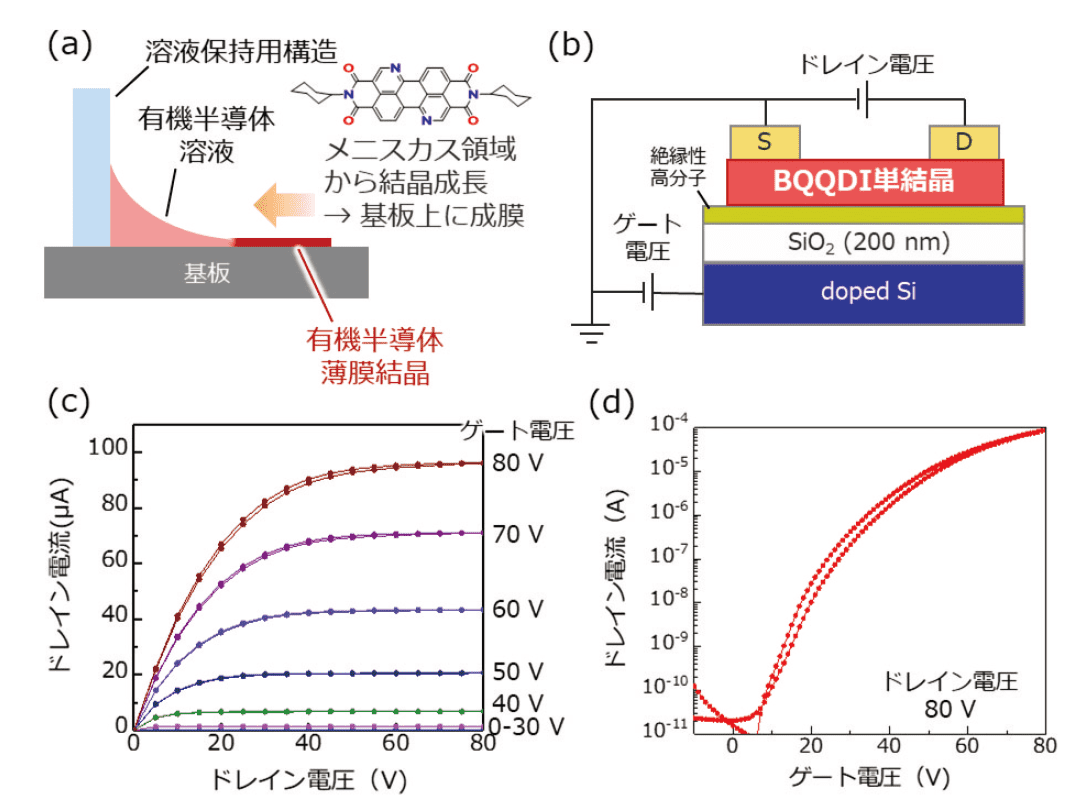
図4.塗布結晶化法を用いたCy6−BQQDI の単結晶OFET
(a) エッジキャスト法の模式図(b)OFET 構造の模式図 S : ソース電極 (Gold)D : ドレイン電極 (Gold)(c) 出力特性(d) 伝達特性おわりに
本稿では、高性能n型有機半導体BQQDIを合成するための鍵前駆体として、BQQの3,9位にメチルエステル、4,10位に2,4,6-トリクロロフェニルエステルを有するBQQDI Precursorの有用性について述べた。また、BQQDI PrecursorからBQQDIに誘導する合成経路を確立したことで、電子伝導に有望な、バランスの取れたブリックワーク構造を構築するCy6−BQQDIの発見に至ることができた。
今後、BQQDI Precursorを基盤とすることでさらにバラエティーに富んだ分子構造・集合体構造を有するBQQDI誘導体の発展が見込まれる。それによって、OFETに限らない、革新的な有機半導体デバイスの研究開発に繋がることが大いに期待される。
謝辞
本稿の研究成果は、竹谷純一教授(東大)、石井宏幸准教授(筑波大)、渡辺豪講師(北里大)をはじめとする多くの共同研究者の協力のもとに得られたものである。また本稿の一部は、科学研究費補助金基盤研究 B(No. 17H03104)、科学技術振興機構さきがけおよびCREST「微小エネルギーを利用した革新的な環境発電技術の創出」領域(谷口研二研究総括、秋永広幸研究副総括)(No.JPMJPR17R2,JPMJCR21Q1)、富士フイルム株式会社の支援により進められたものである。ここに深く感謝申し上げたい。
参考文献
- Okamoto, T. et al. : Sci. Adv., 6, eaaz0632 (2020). DOI: 10.1126/sciadv.aaz0632
- Kumagai, S. et al. : Chem. Mater., 32, 9115 (2020). DOI: 10.1021/acs.chemmater.0c01888
- Kumagai, S. et al. : J. Phys. Chem. Lett., 12, 2095 (2021). DOI: 10.1021/acs.jpclett.0c03012
- Usta, H. et al. : Acc. Chem. Res., 44, 501 (2011). DOI: 10.1021/ar200006r
- Yu, C. P. et al. : Commun. Chem., 4, 155 (2021). DOI: 10.1038/s42004-021-00583-2
- Konishi, H. et al. : Chem. Pharm. Bull., 66, 562 (2018). DOI: 10.1248/cpb.c18-00042
- Mochizuki, A. et al. : Polym. J., 26, 315 (1994). DOI: 10.1295/polymj.26.315
- Kloc, C. et al. : J. Cryst. Growth, 182, 416 (1997). DOI: 10.1016/S0022-0248(97)00370-9
- Uemura, T. et al. : Appl. Phys. Express, 2, 111501 (2009).




