【総説】マリモ状ナノ粒子集合体の簡便合成と応用展開
本記事は、和光純薬時報 Vol.90 No.1(2022年1月号)において、高知工科大学 大学院工学研究科 谷口 彩乃様、大谷 政孝様、小廣 和哉様に執筆いただいたものです。
はじめに
活性炭、シリカ、ゼオライト、金属―有機構造体(MOF)等に代表される多孔性材料は、広大な表面積や多数の細孔を有するため、物質吸着や物質貯蔵―放出等に極めて有利であり、多方面で利用される代表的な機能材料である。中でもシリカやマグネシア、アルミナ、チタニア、ジルコニア、セリア等の(金属)酸化物からなる酸化物多孔体は熱安定性や機械的強度に優れているため、貴金属ナノ粒子触媒の担体として重要である。また、ゼオライトやニオビアのように固体酸として用いる場合にも、反応を加速するには多孔形状は極めて有利である。
多孔体を得るため、液体燃焼合成法、脱合金、電気化学析出法、スプレー熱分解法、ゾル―ゲル法、鋳型合成法等の様々な手法がこれまでに開発されている。さらに近年では、高温の溶液反応である水熱法や高温の非水溶媒を用いるソルボサーマル法も盛んに用いられるようになっている。とりわけソルボサーマル法では、多数の反応パラメーターを精密に制御できるメリットがあり、反応溶媒の選択による極性、粘性、溶解度、溶媒和の制御、加熱スピードによる生成物核の発生速度の制御、加熱温度による結晶子サイズの制御および二次粒子サイズの制御等により、目的に応じて様々な粒子が作り分けられる。
我々もこのユニークなソルボサーマル法に着目し、TiO2の一次粒子が無数に集まった球状多孔体をワンポット・単工程反応で得ることに成功している1)。得られた多孔体の外見が阿寒湖に生育する毬藻(マリモ)にとても似ているので、Micro-/meso-porously Architected Roundly Integrated Metal Oxideの頭文字を取りMARIMO多孔体と名付けた。
本総説では、著者らが最近発表した各種金属酸化物からなるMARIMO多孔体の合成と応用について述べる。
著者らが用いるソルボサーマル法の手順について簡単に紹介する。チタンテトライソプロポキシドとフタル酸のメタノール溶液をSUS316反応管に封入し、約30秒で300℃まで急速加熱後、10分間300℃に保った。その後、反応管を氷浴に投入し反応を停止することでTiO2 MARIMO多孔体を得た(図1A)1a)。このように合成工程は「前駆体溶液を加熱する」のみであり、究極的に単純な反応操作である。
得られたTiO2 MARIMO多孔体は、約5 nmのアナターゼ型TiO2単結晶の一次粒子が無数に集まった約600 nmの粒径を持つ球状多孔体であり、300 m2 g-1を超える高い比表面積を有している。また、多孔体は微小な無数の一次粒子の集合体であるため、表面ナノ凹凸構造が形成されていることもMARIMO多孔体の大きな特徴である。さらに、加熱速度を下げるだけで中空多孔体も得られる(図1B)2)。

図1.各種MARIMO多孔体のTEMおよびSEM画像。
(A)TiO2中実粒子、(B)TiO2中空粒子、(C)SiO2、(D)ZrO2、(E)CeO2、(F)Nb2O5、(G)SiO2-TiO2、(H)CoMnOxこのように、金属化合物と補助剤を含むアルコール溶液を加熱するのみで目的物が得られるこのソルボサーマル反応は極めて汎用性があり、同様の手法でSiO22)、ZrO22, 3)、CeO2-x2, 4)、Nb2O55) MARIMO多孔体、およびそれらの複合体も容易に得られる(表1、図1)。さらに、この合成反応は容易にスケールアップ可能であり、高知県・地元企業・高知工科大学の産学官連携事業の成果により、現在、1日あたり1 kgのスケールで生産可能な商用プラントが稼働している6)。
表1.各種MARIMIO 多孔体の合成条件
| MARIMO | 金属化合物 | 補助剤 | 溶媒 | 文献 |
|---|---|---|---|---|
| TiO2 | Ti(OiPr)4 | phthalic acid | methanol | 1, 2 |
| SiO2 | Si(OEt)4 | phthalic acid | ethanol | 2 |
| ZrO2 | Zr(OnBu)4 | acetylacetone | ethanol | 3 |
| CeO2 | Ce(NO3)3 | triethylene glycol | acetonitrile | 4 |
| Nb2O5 | Nb(OEt)5 | formic acid | methanol | 5 |
| Al2O3-TiO2 | Al(OiPr)3 + Ti(OiPr)4 | phthalic acid | methanol | 7 |
| SiO2-TiO2 | Si(OEt)4 + Ti(OiPr)4 | phthalic acid | methanol | 8 |
| SiO2-ZrO2 | Si(OEt)4 + Zr(OnBu)4 | acetylacetone | ethanol | 未発表 |
| TiO2-Nb2O5 | Ti(OiPr)4 + Nb(OEt)5 | formic acid | methanol | 5, 9 |
| ZrO2-CeO2 | ZrO(NO3)2 + Ce(NO3)3 | formic acid | methanol | 10 |
| CoMnOx | Co(NO3)2 + Mn(NO3)2 | diethylene glycol | methanol | 11 |
| NiMnOx | Ni(NO3)2 + Mn(NO3)2 | diethylene glycol | methanol | 11 |
| CoFeMnOx | Co(NO3)3 + Fe(NO3)3 + Mn(NO3)2 | diethylene glycol | methanol | 11 |
遷移金属MARIMO 多孔体の合成
著者らのアルコールを溶媒とするソルボサーマル法は上記以外の金属酸化物の合成にも極めて有効である11)。通常、遷移金属イオンを出発物質とする金属酸化物の合成においては、溶液中での反応速度が極めて速いため、結晶サイズ・結晶外形・多孔構造の制御が難しい。また、2種以上の遷移金属元素を含む複合酸化物は、近年、燃料電池や人工光合成触媒などへの応用が期待される重要な物質群であるが、金属組成比の制御、均一性、多孔質化(大表面積化)の両立はさらにハードルが上がる。
従来、遷移金属酸化物系の反応では、高温高圧水を反応場とする水熱反応と鋳型となる界面活性剤の添加を組み合わせた手法がよく用いられてきた。しかしながら、高温高圧水中の反応では結晶成長が極めて速いこと、多孔質化のためには大量の界面活性剤の添加を要するなど、課題も多かった。著者らは、上記の急速加熱法と添加剤を加えたソルボサーマル法により、溶液中での遷移金属イオンからの結晶核生成と結晶成長の制御を試みた。様々な溶媒と添加剤の組み合わせを網羅的に検討した結果、溶媒としてはメタノールあるいはアセトニトリル、添加剤としてはジエチレングリコールの添加が最適であることを見出した。
著者らは、系中において添加剤が金属イオンあるいは反応初期に生成した結晶核表面と弱く配位し、適度な平衡状態にあることが鍵であると考えている。反応により得られた遷移金属複合酸化物は、アルコールによる簡単な洗浄のみで回収することができ、後処理として焼成などの鋳型除去は不要である。
上記のTiO2 MARIMOなどと同様に、粒子は表面に微細なナノ凹凸構造を有する多孔体であり、表面積はCo-Mn系複合酸化物としては極めて高い155 m2 g-1を示した。また、前駆溶液に用いる原料金属塩の組み合わせを変えるだけで、Ni-Mn複合酸化物、Co-Fe-Mn複合酸化物など様々な複合酸化物系の合成に適用可能であり、汎用的な合成法として有用であることを示した。
触媒、触媒担体、リチウムイオン電池負極材への応用
通常、貴金属ナノ粒子触媒は担体表面に分散・担持して使用される。しかし、貴金属ナノ粒子と担体表面の相互作用が弱い場合、貴金属ナノ粒子は自ら発する反応熱等で容易に移動し、シンタリング(ナノ粒子の凝集・焼結現象)を起こす。これを解決するために、ナノ粒子と担体表面の接触面積を増やす、あるいは担体の格子欠損上にナノ粒子を固定する等の方策がとられているが、その効果は限定的である。
そこで、我々は「表面ナノ凹凸間隙に貴金属ナノ粒子を挟み込み、かつ格子欠損上にナノ粒子を固定し、熱によるシンタリングを遅延する」という全く新しい概念を提案した(図2)3, 12)。
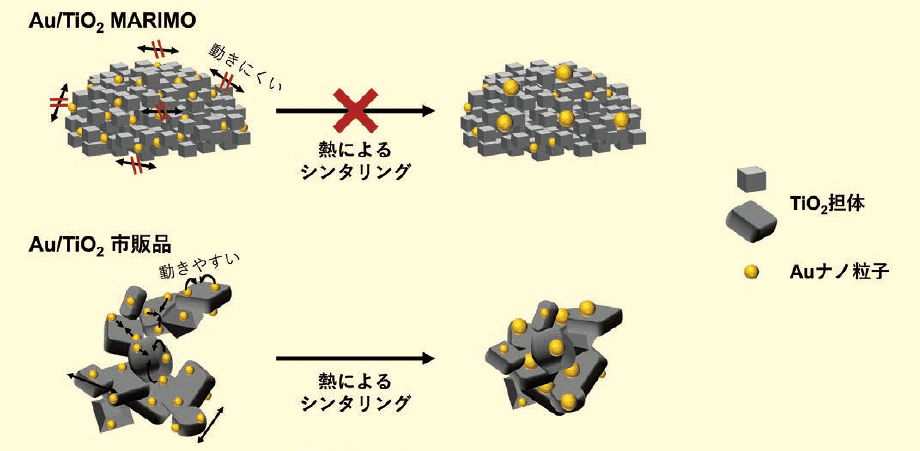
図2.貴金属ナノ粒子を担持した表面ナノ凹凸TiO2 多孔体の⾼温耐久性の概念図
TiO2 MARIMO多孔体に担持したAu触媒(Au/TiO2 MARIMOと略す)を大きな発熱を伴うCO酸化反応(式1)に用いたところ、反応開始温度がAu/TiO2市販品触媒に比べ50℃ も低温化すると同時に長時間に亘り触媒活性を維持した(図3)12)。
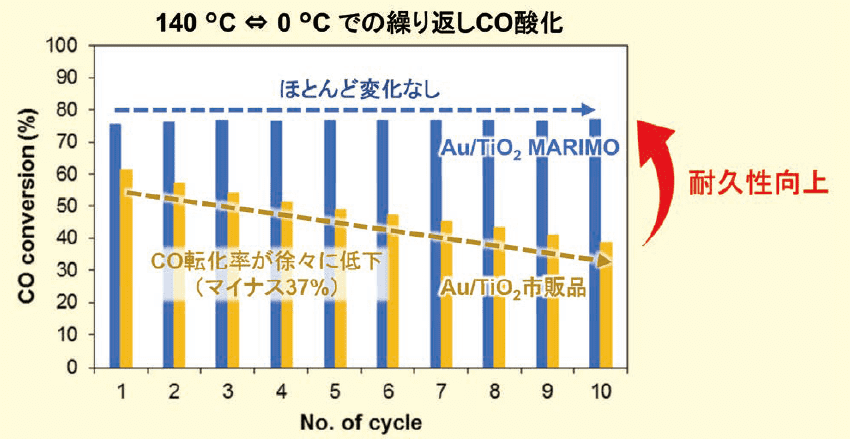
図3.Au/TiO2 MARIMO 触媒とAu/TiO2 市販品触媒によるCO 酸化反応のCO 転化率
また、CeO2-x MARIMO多孔体は、本来は大気中で不安定であるCe3+を安定に57.4 at%も含む比類のないCeO2-x球状多孔体であり、268μmol-O g-1(400℃)もの酸素貯蔵能を示した4)。さらに、Pt/CeO2-x MARIMOはCO酸化反応に対しPt/CeO2市販品より50℃も低い温度から触媒活性を示した。
同様に、Ni/ZrO2 MARIMO触媒を用いて発熱反応であるサバティエ反応(式2)を行ったところ、Niナノ粒子の長時間に亘るシンタリング耐性と、50℃もの反応開始温度の低温化が見られた3)。加えて、多孔体へのLiイオンの容易な移動を期待し、7 at%のNbをドープしたアナターゼ型TiO2 MARIMO多孔体(Nb2O5-TiO2 MARIMO多孔体)をリチウムイオン電池負極材に用いた。その結果、この多孔体は、1000サイクル目でさえ、147 mA h g-1の放電容量と、10 Cの高い電流率における110 mA h g-1の放電容量を示し、商用のLi4Ti5O12に勝るとも劣らない優れた負極材となることが判明した9)。
CO+1/2 O2=CO2−284 kJ/mol
式1
CO2+4H2=CH4+2H2O−165 kJ/mol
式2
高分子架橋剤
MARIMO多孔体の表面ナノ凹凸構造を生かす別の応用例として、高分子化合物の架橋剤への応用を考えた。ヒドロゲルを高分子化合物に選び、機械的強度および熱的強度の大きいZrO2 MARIMO多孔体を架橋剤とすることで、有機―無機ハイブリッド材料とした13)。多孔体の添加による高分子ヒドロゲル中の架橋ネットワーク構造の変化を評価するために、マクロスケールの引張試験を用いた。その結果、わずか0.02 wt%のZrO2 MARIMO多孔体を含む30 wt%のpoly(N-isopropylacrylamide)からなるヒドロゲルは、表面ナノ凹凸のない平滑表面を有するZrO2球体を架橋剤とするヒドロゲルと比較し、1.4倍の応力を示した。
このことは、MARIMO多孔体の表面ナノ凹凸構造が高分子ネットワークと複雑に絡みつき、ヒドロゲル中の効果的な架橋点として機能していることを示唆している。この特性を生かし、ZrO2 MARIMO多孔体を用いた歯科用接着用レジンセメントが開発され市販されている14)。また、このレジンセメントは、令和3年度四国地方発明表彰 四国経済産業局長賞を受賞している15)。
おわりに
以上のように我々は有機溶媒中でのワンポット・単工程ソルボサーマル反応を用い、各種酸化物ナノ粒子からなる球状多孔体の合成に成功した。反応は単純であるため、容易に工業化できることを示した。また、高比表面積と理想的な表面ナノ凹凸構造を有しているため、耐熱性に優れた触媒や触媒担体となることを見出した。さらに、リチウムイオン電池の負極材や高分子の架橋剤への応用展開の道も開けた。今後、新たな複合材料へと導きさらなる発展を図る予定である。
参考文献
- (a)Wang, P. et al. : Chem. Lett., 41, 264 (2012). DOI: 10.1246/cl.2012.264
(b)Wang, P. et al. : Pure Appl. Chem., 86, 785 (2014). DOI: 10.1515/pac-2013-1117
(c)大谷政孝 他 : 化学, 72, 70 (2017). - Wang, P. et al. : J. Supercrit. Fluids, 78, 124 (2013). DOI: 10.1016/j.supflu.2013.03.023
- Kan, K. et al. : Eur. J. Inorg. Chem., 4435 (2020). DOI: 10.1002/ejic.202000813
- Taniguchi, A. et al. : RSC Adv., 11, 5609 (2021). DOI: 10.1039/D0RA10186A
- Kumabe, Y. et al. : RSC Adv., 10, 14630 (2020). DOI: 10.1039/D0RA01704C
- 宇治電化学工業株式会社HP,MARIMOトップ
https://www.ujiden-net.co.jp/marimo/index.html(2021年11月16日 閲覧) - Pradeep, E. K. C. et al. : Eur. J. Inorg. Chem., 5621 (2015). DOI: 10.1002/ejic.201500964
- Nguyen, H. T. T. et al. : Eur. J. Inorg. Chem., 3015 (2017). DOI: 10.1002/ejic.201700521
- Tanaka, Y. et al. : ACS Appl. Energy Mater., 2, 636 (2019). DOI: 10.1021/acsaem.8b01656
- Pradeep, E. K. C. et al. : J. Supercrit. Fluids, 97, 217 (2015). DOI: 10.1016/j.supflu.2014.12.004
- Ohtani, M. et al. : Inorg. Chem., 56, 11546 (2017). DOI: 10.1021/acs.inorgchem.7b01192
- Duriyasart, F. et al. : ChemCatChem, 10, 3392 (2018). DOI: 10.1002/cctc.201800624
- Kan, K. et al. : Nanoscale Res. Lett., 15, 51 (2020). DOI: 10.1186/s11671-020-3282-6
- YAMAKIN株式会社HP,マリモセメントLC
https://www.yamakin-gold.co.jp/prdct_dental/product/marimo/(2021年11月16日閲覧) - 公益社団法人発明協会HP, 令和3年度四国地方発明表彰
http://koueki.jiii.or.jp/hyosho/chihatsu/R3/jusho_sikoku/detail/sikoku_miti.html(2021 年11月16日閲覧)
キーワード
ソルボサーマル反応
高温の溶媒を用いる合成反応。場合によっては溶媒の沸点を超える温度かつ高圧で反応を行う。
シンタリング
高温により複数の微粒子が移動,凝集し、焼結する現象。シンタリングにより触媒金属が肥大化すると、活性サイトが減少するため触媒活性は著しく失われる。
酸素貯蔵能
酸化雰囲気では酸素を貯蔵し、還元雰囲気では酸素を放出する能力を酸素吸蔵放出能という。酸素貯蔵能は、単位量の酸素貯蔵材料が貯蔵・放出できる酸素量を示す指標である。




