【総説】ステルス型RNAベクターの開発と次世代細胞リプログラミング技術への応用
本記事は、和光純薬時報 Vol.90 No.1(2022年1月号)において、ときわバイオ株式会社 中西 真人様に執筆いただいたものです。
はじめに
遺伝子導入による細胞リプログラミングは、マウスの線維芽細胞(真皮などの結合組織を構成する細胞)を筋肉の細胞に転換できるMyoD遺伝子の発見によりその端緒が開かれた1)。しかし、多くの研究者の懸命な努力にもかかわらず、単独で細胞の性質を転換可能な「マスター遺伝子」はMyoD以外には見つからなかった。
2006年に、OCT4、SOX2、KLF4、c-MYCの4個の遺伝子を導入することで末梢組織を構成する細胞を人工多能性幹細胞(iPS細胞)に初期化できることが山中らにより報告された2)。この発見により、細胞リプログラミングを誘導するためには複数の因子を組み合わせる必要があることが強く示唆され、再生医療の分野に大きな転機をもたらすことになった。現在では、iPS細胞を経ないで体細胞を直接、別種の体細胞に変換するDirect reprogrammingや、iPS細胞の分化を外来遺伝子の強制発現によって誘導するDirected differentiationについても、複数の因子を組み合わせて可能になったという報告が多数発表されている。
細胞リプログラミングにより作製した細胞を再生医療に使うためには、使用する遺伝子導入・発現ベクターに高度な性能が求められる。リプログラミングを均一に誘導するためには、複数の遺伝子を高効率で細胞に導入し、一定の比率で1〜3週間安定に発現した後、細胞から完全に除去しなくてはならないが、このような要求をすべて満たすことができる技術は極めて限られている。本稿では、現時点で細胞リプログラミングに最も適した技術として高く評価されているステルス型RNAベクターの開発の経緯と応用の現状について解説する。
RNA ウイルスを使った遺伝子導入・発現ベクター
1973年のリン酸カルシウム法の発見により、動物細胞への遺伝子導入は実用的な方法として研究現場で使われるようになった。その後、1980年代になると、現在でも広く使われているレトロウイルスベクター・アデノウイルスベクター・アデノ随伴ウイルス(AAV)ベクターなどの組換えウイルスベクターや、陽荷電脂質とDNAの複合体を使うLipofection法などの非ウイルスベクターによる遺伝子導入法が開発され、遺伝子治療への期待が高まった。
一方で、DNAの複製中間体を持たないRNAウイルスは、一般的に細胞障害性が強いため遺伝子導入ベクターには適していないと考えられてきた(レトロウイルスやレンチウイルスもRNAウイルスに分類されるが、逆転写により作られたゲノムcDNAが宿主のゲノムDNAに挿入されて転写される点が他のRNAウイルスとは異なる)。例えば、RNAウイルスの一種であるセンダイウイルスを基にしたベクターは、非常に強力に遺伝子発現を誘導できるものの、細胞障害性があるため持続的な発現には適していない。
筆者は、30年以上にわたり、動物細胞のゲノムDNAに遺伝情報を挿入することなく持続的な遺伝子発現を可能にするRNAベクターを開発してきた。センダイウイルスには、Clone 151(cl.151)株という37℃で持続感染を起こす変異株が存在する3, 4)。筆者はこの変異ウイルスに着目し、cl.151株を単離した吉田哲也博士(現・広島大学名誉教授)との共同研究を1988年に開始した。当時はまだPCR法もDNAシークエンサーも普及しておらず、約16キロ塩基と大きなゲノムを持つセンダイウイルス変異株の研究は難航したが、2007年にはcl.151株の全長ゲノムcDNAの単離と持続感染機構の解析を報告し5)、2011年には自律複製能を欠失すると共に4個の外来遺伝子を搭載して安定に発現できるSeVdp(Defective and persistent Sendai virus)ベクターの開発に成功した6)。
さらに、SeVdpベクターにOCT4、SOX2、KLF4、c-MYC遺伝子をすべて搭載すれば高効率で細胞を初期化できることが判り、持続発現型RNAウイルスベクターによる細胞リプログラミングの原理を確立することができた。また、iPS細胞で特異的に発現しているmiR-302を使ってベクターのゲノムRNAを自動的に消去する機構も導入され7)、多くの研究室でiPS細胞の樹立のために使われてきた。
ステルス型RNA ベクターの開発
SeVdpベクターの研究から、RNAゲノムを使った安定な遺伝子発現を実現するために必要な条件が明らかになった。最も重要なのはインターフェロン誘導の回避であり、cl.151株ではRNA polymeraseをコードするL遺伝子の変異によりインターフェロン誘導が低下し、細胞障害性の低減につながっていた5)。また、ウイルス粒子の構造を作るM、F、HNをコードする遺伝子をすべて欠失すると、細胞障害性が低減するだけでなく二次粒子の産生を完全に回避できることも判った6)。
一方、このベクターを使って遺伝子治療や細胞リプログラミングといった応用を進めるためには、さまざまな課題も残されていた。例えば、SeVdpベクターでは搭載できる遺伝子の構造に制限があり、ベクターの設計が複雑で製造も難しい。また、転写因子や各種レセプターを発現するためには転写レベルが高すぎることも解決すべき課題であった。そこで、SeVdpベクターの開発を通じて得られた教訓を元に、より汎用的に使えるRNAベクターの開発に着手した。その結果生まれたのが、ステルス型RNAベクター(SRV)である。
RNAウイルスがインターフェロンを強く誘導する理由の一つに、ウイルスが作るRNAの性状が動物細胞のmRNAと大きく異なるため、異物(病原体)として認識されやすいことが挙げられる。一般的にRNAウイルスのゲノムRNAのGC含量は低く、40%以下のものも少なくない。天然に存在するセンダイウイルスの遺伝情報をほぼそのまま使っているSeVdpベクターのゲノムRNAのGC含量は約46%であるのに対し、ヒトmRNAのGC含量は約60%である。GC含量が低いRNAは細胞に異物として認識されることが知られているので8)、コドン最適化によって人工的にGC含量を高めたRNAを使ってベクターを再構築することにした。
コドン最適化によってGC含量を高める試みはレンチウイルスなどで報告されているが、コードしているタンパク質の一次構造が同じであっても改変後はウイルスとしての機能が大きく損なわれるため、ウイルスゲノムRNAの大規模な塩基配列の変更は困難とされてきた。そのため、SRVの開発に当たっては、非コード領域をヒトmRNA由来の配列で置換すると共に、コード領域の最適化を1遺伝子ずつ慎重に進め、最終的に転写と複製に必要なすべてのベクター由来の遺伝子をコドン最適化することに成功した。
また搭載する遺伝子についても簡単なルールを設けて、どんな組み合わせや順番であってもカセット形式でSRVに搭載できるようにした。これらの改良の結果、より生理的なレベルの遺伝子発現をするベクターの作製に成功すると共に、搭載可能な遺伝子の数やサイズも、最大10個(最長14kbpまで)と既存の技術を大きく凌駕し、さまざまな目的に対応可能な汎用ベクターとすることができた9)。
iPS 細胞の作製に最適化したステルス型RNAベクターの概要
ときわバイオ株式会社が開発し、富士フイルム和光純薬が発売しているSRV™ iPSCベクターは、iPS細胞の作製を最適化するためにさまざまな工夫が施されている。例えば、作製効率が最大になるように、初期化の素材となる細胞に合わせてベクターの遺伝子発現のレベルを変えると共に、血液細胞の初期化に適したベクター(SRV™ iPSC-2、SRV™ iPSC-4)では、SeVdp-302Lで採用されたベクター自動消去用の配列をさらに改良して搭載している。また、標準的な初期化遺伝子の組み合わせ(OCT4、SOX2、KLF4、c-MYC)を搭載した4遺伝子搭載タイプに加えて、ウィスコンシン大学のグループが報告したNANOGとLIN28を追加した6遺伝子タイプも用意し、超高効率の初期化を実現した(図1)。
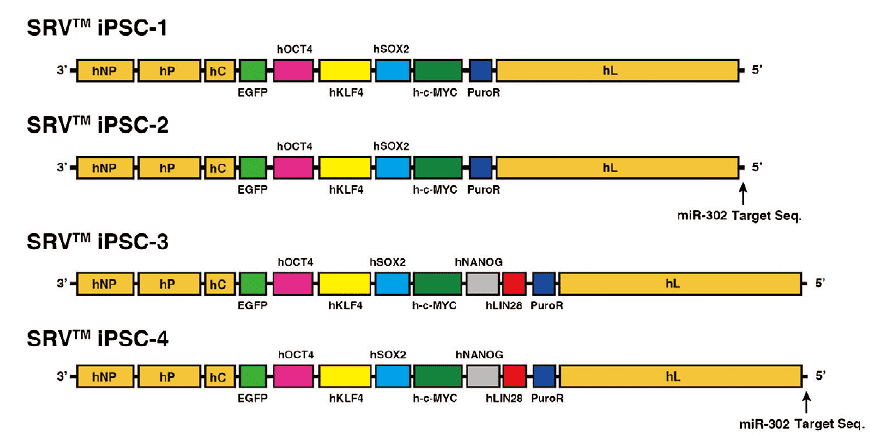
図1.SRV™ iPSC ベクターのゲノム構造
SRV™ iPSC-2 およびSRV™ iPSC-4 には、miR-302 に応答して⾃動的にベクターが消去されるシステムが搭載されている。この機構は、血液細胞からのiPS 細胞の樹⽴には非常に有効である。さらに、すべてのSRV™ iPSCベクターには遺伝子発現のマーカーとして緑色の蛍光を発するEGFP(Enhanced Green Fluorescent Protein)遺伝子が搭載されており、初期化過程での遺伝子発現を蛍光顕微鏡で簡単にモニターすることができる(図2)。
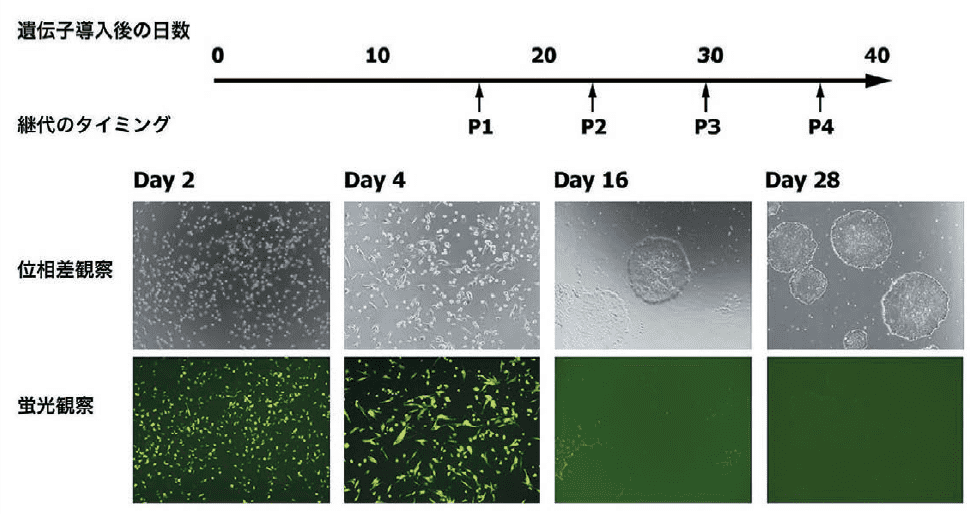
図2.SRV™ iPSC-2 ベクターを使った末梢血単球からのiPS細胞の樹⽴
遺伝子導入後4 日目ではEGFP の蛍光が観察され、ほとんどの細胞に遺伝子が導入されて発現していることが確認できる。一方、最初の継代直前の16 日目では、既にiPS 細胞のコロニーが出現しているが、EGFP の蛍光はほとんど見えなくなっており、ベクターが⾃動的に消去されているのが確認できる。このような改良により、SRV™ iPSCベクターは既存の技術を大きく超える初期化効率を実現し、Xenofree、Feeder-freeという厳しい条件下でも、誰でも確実に品質の高いiPS細胞を作製することができるようになった。特に、6因子搭載SRV™ iPSCベクターは高い品質のiPS細胞が必要とされる再生医療のツールとして最適だと考えられ、iPS細胞の自動作製等の応用に向けてさらなる改良が続けられている。また、SRVに搭載する遺伝子を替えるだけで、Direct reprogrammingやDirected differentiationなど高度な細胞リプログラミング技術にも対応が可能であり、将来は再生医療の領域で広く使われるツールとなると期待されている。
参考文献
- Davis, R. L. et al. : Cell, 51, 987 (1987). DOI: 10.1016/0092-8674(87)90585-x
- Takahashi, K. and Yamanaka, S. : Cell, 126, 663 (2006). DOI: 10.1016/j.cell.2006.07.024
- Yoshida, T. et al. : Virology, 92, 139 (1979). DOI: 10.1016/0042-6822(79)90220-4
- Yoshida, T. et al. : Virology, 120, 329 (1982). DOI: 10.1016/0042-6822(82)90034-4
- Nishimura, K. et al. : J. Biol. Chem., 282, 27383 (2007). DOI: 10.1074/jbc.M702028200
- Nishimura, K. et al. : J. Biol. Chem., 286, 4760 (2011). DOI: 10.1074/jbc.M110.183780
- Nishimura, K. et al. : Stem Cell Res., 23, 13 (2017). DOI: 10.1016/j.scr.2017.06.011
- Vabret, N. et al. : PLoS One, 7, e33502 (2012). DOI: 10.1371/journal.pone.0033502
- 中西真人, 飯島実: 特許公報, 特許第6770224号
- Yu, J. et al. : Science, 318, 1917 (2007). DOI: 10.1126/science.1151526
キーワード
細胞リプログラミング
血液細胞と神経細胞は共に、1個の受精卵が分裂し、後戻りできないように分化してできた細胞である。このように、私たちの体を構成する細胞はそれぞれ役割と性質が異なっていて、これまでは分化した細胞の性質が変化することは無いと考えられてきた。しかし、MyoDの発見はこの考え方を覆し、分化細胞の性質を人為的に変えられることが明らかになった。
持続感染
ウイルスが、感染した宿主細胞を殺すことなく共存している感染状態。
人工多能性幹細胞(iPS細胞)
多能性幹細胞というのは、外胚葉(皮膚や神経)・内胚葉(消化管・肺・肝臓など)・中胚葉(筋肉・血液など)のすべてに分化できる「多能性」を持った細胞で、iPS細胞の発見までは、ヒトや動物の発生過程の胚を壊して作られる胚性幹細胞(ES細胞)が知られていた。しかし、ES細胞は、胚を壊すという倫理的問題がある上、ES細胞を分化させた細胞は免疫抑制剤を使わないと移植できない。一方、患者本人の細胞から作製したiPS細胞は、免疫拒絶を受けずに移植できるため、再生医療への応用が期待されている。




