ベンジル保護基
本記事はWEBに混在する化学情報をまとめ、それを整理、提供する化学ポータルサイト「Chem-Station」の協力のもと、ご提供しています。
原理と測定法
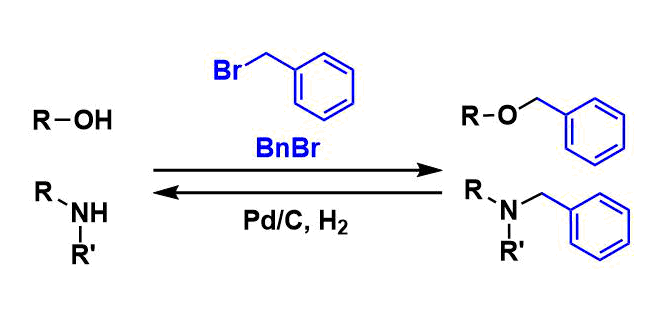
ベンジル (benzyl, Bn) 基は、汎用性の高いアルコールおよびアミンの保護基です。
強塩基条件・加水分解条件・強酸性条件・求核剤・ヒドリド還元など、各種条件に耐えることができます。最も安定な保護基の一つであるため、合成序盤で導入されることが多いです。
基本文献
- Czernecki, S., Georgoulis, C., Provelenghiou, C.: Tetrahedron Lett., 17, 3535 (1976). DOI:10.1016/S0040-4039(00)71351-7
- Bn-trichloroimidate: (a) Iversen, T., Bundle, D. R.: J. Chem. Soc. Chem. Commun., 23, 1240 (1981). DOI: 10.1039/C39810001240 (b) Wessel, H.-P., Iversen, T., Bundle, D. R.: J. Chem. Soc., Perkin Trans. 1, 2247 (1985). DOI: 10.1039/P19850002247
- TMS-I deprotection: Jung, M. E., Lyster, M. A.: J. Org. Chem., 42, 3761(1977). DOI: 10.1021/jo00443a033
反応機構
保護
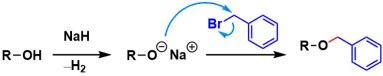
アルコールに対しては、臭化ベンジル(BnBr)・水素化ナトリウム(NaH)とTHFまたはDMFを溶媒とする組み合わせがよく用いられます。Williamsonエーテル合成と同様の機構で進行します。
またベンジルトリクロロイミデート(BnOC(=NH)CCl3)を用いると、強ブレンステッド酸条件下(TfOH)にベンジルエーテルを得ることができます。塩基性条件下が不安定な化合物に適用できます。

脱保護
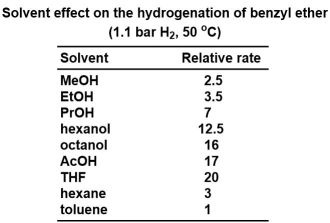
脱保護は還元条件が一般的です。最も典型的な方法はパラジウム/炭素触媒を用いる接触水素還元です。脱保護速度は溶媒に依存するといわれています(下図)。またBirch還元や電解還元などの1電子還元条件も使用可能です。
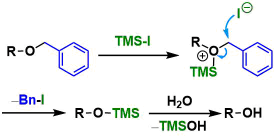
TMS-I、BCl3などの「ルイス酸+求核剤」条件もよく用いられます。酸素親和性の高いルイス酸が活性化剤として働き、ベンジル位との求核置換反応を促進します。
反応例
保護
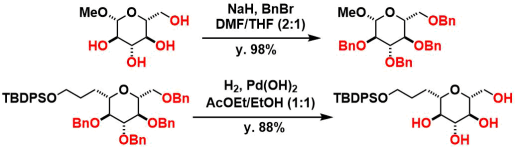
典型例1):比較的耐久性がある保護基なので、合成の初期段階で導入されることが多いです。
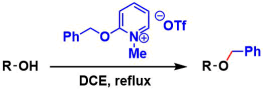
Dudley試薬によるベンジル化2):試薬は安定で取り扱いが容易です。中性条件で反応が進行します。
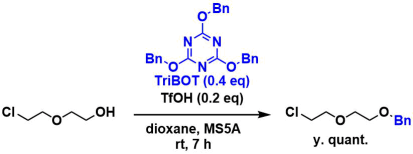
TriBOTを用いる酸性条件でのベンジル化3):3つのBn基全てが機能します。
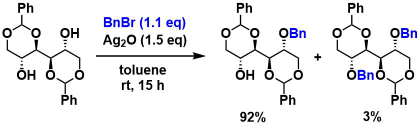
酸化銀(Ag2O)でBnBrを活性化すると、ジオールのモノベンジル化が効率良く進行します4)。
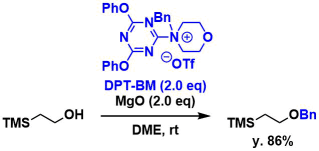
DPT-BM試薬を用いるベンジル化5):ほぼ中性条件かつ室温で実施できます。
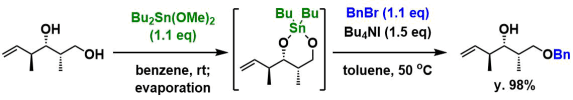
スズアセタール法による選択的ベンジル保護6)
脱保護
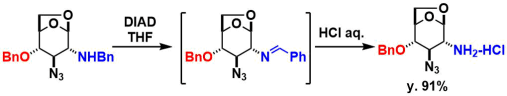
o-Bn共存下におけるN-Bn基の選択的脱保護7):イミンへの酸化を経由します。
アンモニア源はPd/C-H2条件でのベンジル除去に対して阻害剤として機能します8)。
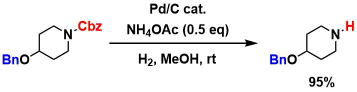
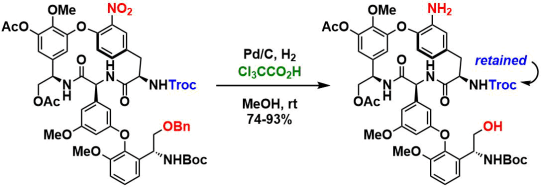
トリクロロ酢酸をダミー基質として加えることで、接触還元されてしまうTroc基を保ったまま、Bn基が除去できます9)。
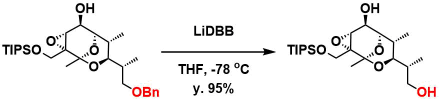
リチウム―di-tert-butylbiphenyl(LiDBB)によるBn基の除去10)
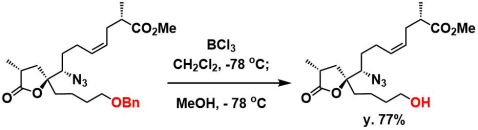
BCl3条件を用いる脱保護の例11)
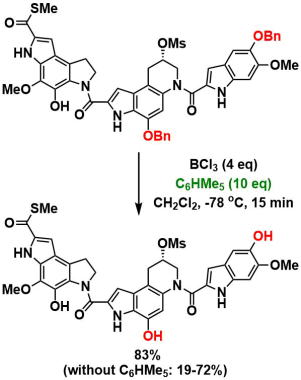
BCl3条件で発生するベンジルカチオンが引き起こす副反応を防ぐため、ペンタメチルベンゼンを捕捉剤として加える条件が開発されています12)。下記はYatakemycinの全合成への応用例です13)。
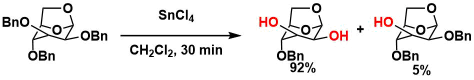
SnCl4条件を用いる選択的脱保護の例14)
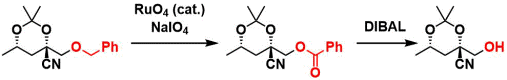
RuO4酸化によるベンゾイル基への変換を経由すると、ヒドリド還元条件もしくは加水分解条件でBn基を除去できます15)。
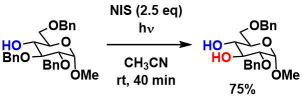
下記条件では、アルコール隣接位のBnだけを除去できます16)。
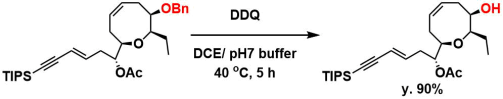
DDQによる酸化的除去も可能です。以下は(+)-Laurencin合成への応用例です17)。
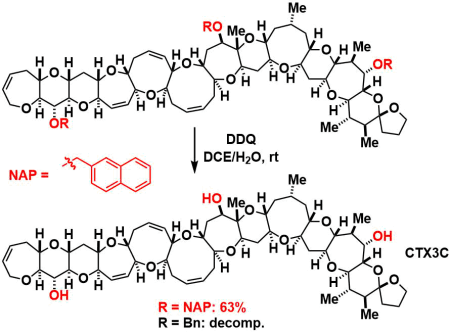
2-ナフチルメチル(NAP)基18)は、酸化条件でベンジル基よりも容易に切断できます。Ciguatoxin CTX3Cの全合成の例ではBn基からNAP基に変更して収率が改善しました19)。
テトラセノマイシン類の全合成20):重ベンジル基が酸化条件に強い保護基として活用されています。三級アルコール上のBn基はDDQ処理で外れやすい21)ため、この工夫が必要です。

実験のテクニック・コツ
- Bu4NI(TBAI)やNaIを触媒量加えておくと、保護反応が加速されます。BnClやBnBrが系中で高反応性のBnIに変換されるためといわれています。
- BnBrは催涙性物質ですので、必ずドラフト中で取り扱ってください。
- クエンチ時には直接水を加えず、炭酸カリウム-メタノールを加えてしばらく攪拌すると、催涙性のBnBrがうまく分解します。後処理が快適になるのでオススメです。
- 外れにくいBn基はしばしば水素添加によってシクロヘキシルメチル基に変換されてしまいます。
- DMF溶媒を使うと、展開時にスポットがテーリングしてTLCが見づらくなります。TLCプレートを数分真空引きしてから展開すると見やすくなります。
- 抽出操作の際は、低極性の溶媒(Et2Oやhexane-EtOAc混合溶媒系)で抽出し、水洗いするとDMFが除きやすいです。
- Pd/C触媒は試薬・溶媒を加えるときにしばしば発火するので注意しましょう。フラスコをアルゴン置換してから加えると発火しづらくなります。
- 反応が行きづらいからといって途中でPd/C触媒を足すのは厳禁です。発火するおそれがあります。一旦ろ過して仕込み直すのが正しい方法です。
参考文献
- Oguri, H., Hishiyama, S., Oishi, T., Hirama, M.: Synlett, 1252 (1995). DOI: 10.1055/s-1995-5259
- (a) Poon, K. W. C., Dudley, G. B.: J. Org. Chem., 71, 3923 (2006). DOI: 10.1021/jo0602773
(b) Poon, K. W. C., House, S. E., Dudley, G. B.: Synlett, 3142 (2005). DOI: 10.1055/s-2005-921898 - Yamada, K., Fujita, H., Kunishima, M.: Org. Lett., 14, 5026 (2012). DOI: 10.1021/ol302222p
- Bouzide, A., Sauvé, G.: Tetrahedron Lett., 38, 5945(1997). DOI: 10.1016/S0040-4039(97)01328-2
- Yamada, K., Tsukada, Y., Karuo, Y., Kitamura, M., Kunishima, M.: Chem. Eur. J., 20, 12274(2014). DOI:10.1002/chem.201403158
- (a) Cruzado, C., Bernabe, M., Martin-Lomas, M.: J. Org. Chem., 54, 465(1989). DOI: 10.1021/jo00263a038
(b) Simas, A. B. C., Pais, K. C., da Silva, A. A. T.: J. Org. Chem., 68, 5426 (2003). DOI: 10.1021/jo026794c
(c) Boons, G.-J., Castle, G. H., Clase, J. A., Grice, P., Ley, S. V., Pinel, C.: Synlett, 913(1993). DOI: 10.1055/s-1993-22650 - Kroutil, J., Trnka, T., Cerny, M.: Synthesis, 446(2004). DOI: 10.1055/s-2004-815937
- (a) Czech, B. P., Bartsch, R. A.: J. Org. Chem., 49, 4076(1984). DOI: 10.1021/jo00195a045
(b) Sajiki, H.: Tetrahedron Lett., 36, 3465(1995). DOI:10.1016/0040-4039(95)00527-J
(c) Sajiki, H., Hirota, K.: Tetrahedron, 54, 13981(1998). DOI:10.1016/S0040-4020(98)00882-5 - Boger, D. L., Kim, S. H., Mori, Y., Weng, J.-H., Rogel, O., Castle, S. L., McAtee, J. J.: J. Am. Chem. Soc., 123, 1862(2001). DOI: 10.1021/ja003835i
- Shimshock, S. J., Waltermire, R. E., DeShong, P.: J. Am. Chem. Soc., 113, 8791(1991). DOI: 10.1021/ja00023a029
- Williams, D. R., Brown, D. L., Benbow, J. W.: J. Am. Chem. Soc., 111, 1923 (1989). DOI: 10.1021/ja00187a081
- (a) Yoshino, H., Tsuchiya, Y., Saito, I., Tsujii, M.: Chem. Pharm. Bull., 35, 3438.(1987). DOI:10.1248/cpb.35.3438
(b) Yoshino, H., Tsujii, M., Kodama, M., Komeda, K., Niikawa, N., Tanase, T., Asakawa, N., Nose, K., Yamatsu, K.: Chem. Pharm. Bull., 38, 1735(1990). DOI:10.1248/cpb.38.1735
(c) Okano, K., Okuyama, K., Fukuyama, T., Tokuyama, H.: Synlett, 1977 (2008). DOI: 10.1055/s-2008-1077980 - (a) Okano, K., Tokuyama, H., Fukuyama, T.: J. Am. Chem. Soc., 128, 7136 (2006). DOI: 10.1021/ja0619455
(b) Okano, K., Tokuyama, H., Fukuyama, T.: Chem. Asian J., 3, 296 (2008). DOI:10.1002/asia.200700282 - Hori, H., Nishida, Y., Ohrui, H., Meguro, H.: J. Org. Chem., 54, 1346 (1989). DOI: 10.1021/jo00267a022
- (a) Schuda, P. F., Cichowicz, M. B., Heimann, M. R.: Tetrahedron Lett., 24, 3829 (1983). DOI:10.1016/S0040-4039(00)94286-2
(b) Ritter, T., Zarotti, P., Carreira, E. M.: Org. Lett., 6, 4371(2004). DOI: 10.1021/ol0480832 - (a) Madsen, J., Bols, M.: Angew. Chem. Int. Ed., 37, 3177(1998). DOI:10.1002/(SICI)1521-3773(19981204)37:22<3177::AID-ANIE3177>3.0.CO,2-A
(b) Madsen, J., Viuf, C., Bols, M.: Chem. Eur. J., 6, 1140(2000). DOI: 10.1002/(SICI)1521-3765(20000403)6:7<1140::AID-CHEM1140>3.0.CO,2-6 - Baek, S., Jo, H., Kim, H., Kim, H., Kim, S., Kim, D.: Org. Lett., 7, 75 (2005). DOI: 10.1021/ol047877d
- (a) Gaunt, M. J., Yu, J., Spencer, J. B.: J. Org. Chem., 63, 4172(1998). DOI: 10.1021/jo980823v
(b) Wright, J. A., Yu, J., Spencer, J. B.: Tetrahedron Lett., 42, 4033 (2001). DOI: 10.1016/S0040-4039(01)00563-9
(c) Xia, J., Abbas, S. A., Locke, R. D., Piskorz, C. F., Alderfer, J. L., Matta, K. L. : Tetrahedron Lett., 41, 169 (2000). DOI:10.1016/S0040-4039(99)02046-8 - Inoue, M., Uehara, H., Maruyama, M., Hirama, M.: Org. Lett., 4, 4551(2002). DOI: 10.1021/ol027105m
- Sato, S., Sakata, K., Hashimoto, Y., Takikawa, H., Suzuki, K.: Angew. Chem. Int. Ed., 56, 12608 (2017). DOI: 10.1002/anie.201707099
- (a) Oikawa, Y., Horita, K., Yonemitsu, O.: Tetrahedron Lett., 26, 1541(1985). DOI: 10.1016/S0040-4039(00)98547-2
(b) Oikawa, Y., Tanaka, T., Yonemitsu, O.: Tetrahedron Lett., 27, 3647(1986). DOI: 10.1016/S0040-4039(00)84871-6




