【連載】遺伝子解析 新技術とその応用 「第1回 Stilla 社 Naica System を用いたデジタル PCRによる超微量ウイルスDNAの定量解析の一例」
本記事は、和光純薬時報 Vol.88 No.3(2020年7月号)において、熊本大学 ヒトレトロウイルス学共同研究センター 佐藤 賢文様に執筆いただいたものです。

はじめに
ヒト免疫不全症ウイルス(human immunodeficiency virus type 1:HIV-1)は世界に 3,000 万人超、日本に約 3 万人の感染者がいる。このウイルスに感染した人は、適切な治療を受けなければ、その名前の通り後天性免疫不全症候群(acquired immunodeficiency syndrome, AIDS, エイズ)を引き起こし、免疫不全症による重篤な感染症や悪性腫瘍によって致死的な状態となる。
近年の抗ウイルス薬の進捗によって、HIV-1 感染者体内におけるウイルス複製を極めて効率的にブロックすることが可能となり、適切な治療を受けることが出来ればエイズ発症を阻止することが出来るようになってきた。しかしながら、抗ウイルス薬による治療でも感染者体内からウイルスを完全に排除させることは極めて困難で、薬剤を中止すると再び高いレベルのウイルス血症を示すようになり、それが続けばエイズを発症してしまう。したがって、感染者はほぼ一生涯の長期にわたる服薬を余儀なくされている状況にある。
そのような中、治療下で残存するウイルスリザーバを減少させることで、休薬してもウイルスが再活性化せずにコントロール出来る状態、更にはウイルス排除を目指した様々な研究が世界的に展開されている。ところが、ウイルスリザーバが感染者体内でどのように成立し、そして維持されているのか、まだまだ不明な点が多く残されており、ウイルスリザーバを減少させる有効な治療法は確立出来ていない。
ウイルスリザーバの評価方法
その HIV-1 ウイルスリザーバ研究において、大きな技術的障壁となっているのが、そのリザーバサイズが極めて小さいという問題である。抗ウイルス療法を受けている感染者や感染動物モデルにおいては、血中のウイルス量は検出限界以下となる。そのような状況でウイルスリザーバの評価はどのようになされるのであろうか?
レトロウイルスの生活環を考えてみると、抗ウイルス薬投与下の感染者においては、ウイルス複製サイクルは薬によって遮断される。しかしそのような状況下でも、宿主ゲノム内に組み込まれた HIV-1 プロウイルス DNA は宿主細胞が生存する限り残存し、ウイルスリザーバの原因となる。そのウイルスリザーバの 1 つの様式である宿主細胞ゲノムに組み込まれたプロウイルス DNA を定量することが、ウイルスリザーバ定量の 1 つの方向性と考えられている。
定量的 PCR とデジタル PCR
では、HIV-1 のプロウイルス DNA はどのように定量されるのであろうか?
これまでは、ウイルスの特定の領域を標的とした PCR 反応による定量的 PCR (quantitative PCR : qPCR) で DNA コピー数を定量することが行われてきた 1)。我々の研究グループでも、長期間抗ウイルス療法を受けた日本の感染者での末梢血液中プロウイルス DNA 量の推移を qPCR で定量し、報告してきた 2)。
qPCR の原理は PCR サイクル数とその産物の生成速度をもって、試料中に含まれる鋳型の DNA 量を推計することである。PCR 反応の原理から考えると2倍の DNA 量の差があれば、PCR サイクル数が 1 サイクル分異なることになる。qPCR は理論上定量的であるものの、PCR 増幅効率や増幅の立ち上がりなどが必ずしも 100%でないことなど、その定量性を低下させる要因がいくつか知られている。従って、極めて微量の DNA 定量や、微妙な量的差異を検出する場面においては、難点があるとされる。
そのような中で登場してきたのが、デジタル PCR といわれる方法である。デジタル PCR は、PCR を数千個から数万個の個別のコンパートメントに分けて反応させることで、サンプル中の鋳型 DNA 量を絶対定量するものである。最近我々の研究室で導入した、Stilla 社 Naica System を用いたプロウイルス DNA 定量の例を紹介する。
HIV-1 DNA 定量の実際
前述のように、以前は我々の研究室でも qPCR による HIV-1 DNA の定量を行ってきた。図 1 にその例を示すが、qPCR の方法では標的 DNA が少ない検体の時は増幅してくるサイクル数が 30 サイクルを大きく超えてしまい、陰性コントロールでもしばしば認める非特異的な増殖と近いパターンを示す(図 1)。抗ウイルス治療中の HIV-1 患者の末梢血液リンパ球中感染細胞は 0.1% 以下であり、その微量のウイルス DNA を定量することは容易ではない。
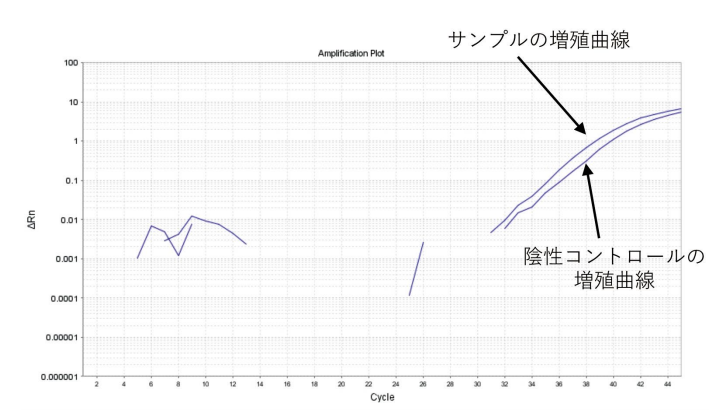
図1.HIV-1DNA を定量する qPCR の1例
従って、現在では多くのウイルス研究者が正確な定量のためにデジタル PCR を導入しており、我々の研究室でも今は qPCR ではなくデジタル PCR で HIV-1 の DNA 定量を行っている 3)。
図2に Stilla 社のクリスタル PCR の実際の解析例を示すが、HIV-1 感染者の微量のウイルス DNA が増幅された陽性のドットが低頻度であるが、はっきりと検出されているのが分かる(図2B)。この大きな S/N 比(signal-noise ratio)を示す点において、デジタル PCR は qPCR に比べて優れており、微量な標的 DNA を正確に定量することが可能となる。また、Stilla 社のクリスタル PCR は増幅反応後の蛍光シグナル検出画像を直接確認することが出来る利点がある(図2C,D)。
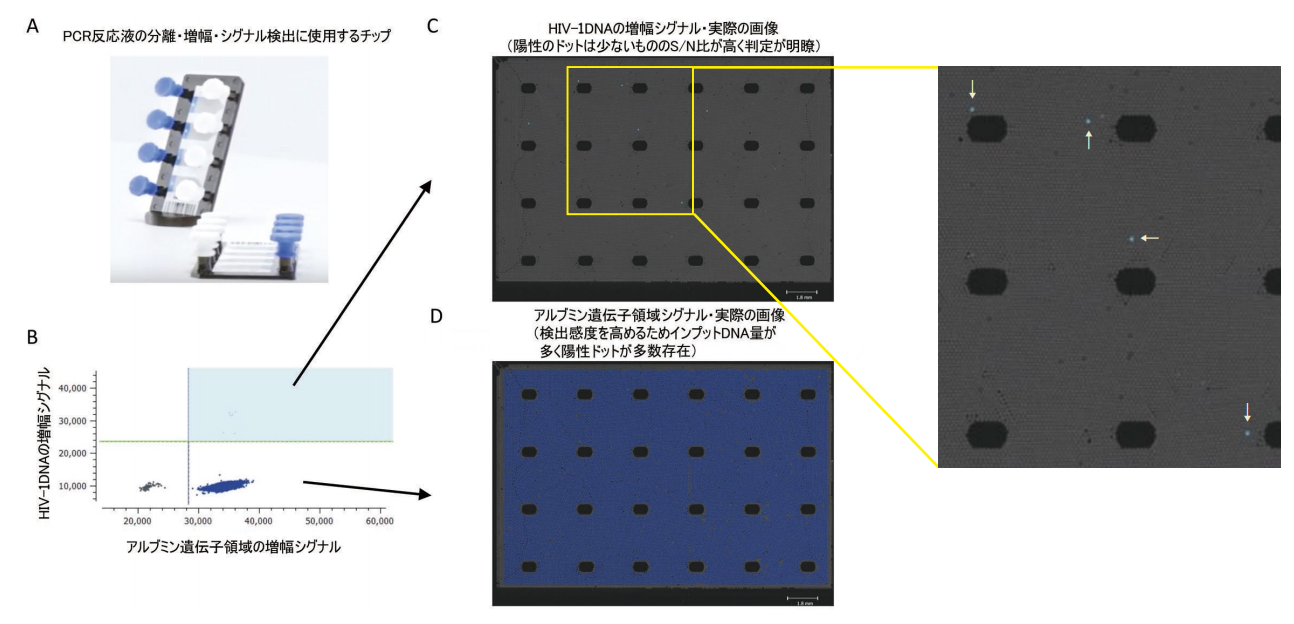
図2.Stilla 社 Naica System による HIV-1DNA 定量の1例
今後の展開
Stilla 社のクリスタル PCR 装置は3つの蛍光を同時に検出することが可能であり、ウイルスの複数の領域を増幅することで、ウイルスの欠損度合いなど質的な情報も取得出来ると考えられる 4)。また、図2C,Dに示した増幅反応後のドロップを回収することが出来るため、陽性ドロップから DNAライブラリーを作製して、そこに含まれる DNA の配列を網羅的に調べることも不可能ではない。
このように、クリスタル PCR 装置は、高精度な DNA 定量もちろんであるが、増幅後のアプリケーションにも応用出来る可能性を含んでおり、今後の様々な研究の場での活用が期待される。
参考文献
- Douek, D. C., Brenchley, J. M., Betts, M. R., Ambrozak, D. R., Hill, B. J., Okamoto, Y. et al. : Nature, 417 (6884), 95 (2002). DOI: 10.1038/417095a
- Stanoeva, K. R., Konig, A., Fukuda, A., Kawanami, Y., Kuwata, T., Satou, Y. et al. : J. Acquir. Immune. Defic, Syndr., 78 (2), 239 (2018). doi: 10.1097/QAI.0000000000001662
- Iwase, S. C., Miyazato, P., Katsuya, H., Islam, S., Yang, B. T. J., Ito, J. et al. : Sci. Rep., 9 (1), 12326 (2019). DOI: 10.1038/s41598-019-48681-5
- Bruner, K. M., Wang, Z., Simonetti, F. R., Bender, A. M., Kwon, K. J., Sengupta, S. et al. : Nature, 566 (7742), 120 (2019). DOI: 10.1038/s41586-019-0898-8
−シリーズ開始にあたって−
「遺伝子解析 新技術とその応用」は、遺伝子研究分野における新しい研究手法を研究者ご自身にご紹介頂く全4回(予定)のシリーズです。
1953 年に DNA の二重らせん構造が提唱され、2003 年にヒトゲノム配列の解読が完了しました。その後、ポストゲノム時代に入り、個々の遺伝子の機能を解析する研究が盛んになりました。その過程において、遺伝子解析手法は、驚くほど進化を遂げ、現在も新たな手法が生まれ続けています。
本シリーズでご紹介する新たな研究手法が読者の皆様のご研究の一助になりましたら幸いです。








