【連載】遺伝子解析 新技術とその応用 「第2回 Cas9 タンパク質と gRNA のトランスフェクション試薬 GenomONE®-GE」
本記事は、和光純薬時報 Vol.88 No.4(2020年10月号)において、石原産業株式会社 近藤 由隆様に執筆いただいたものです。

はじめに
ゲノム編集では、Cas9とgRNAをコードするプラスミドをトランスフェクションするケースが多いが、それらの発現量やオフターゲットが課題となる。それを回避するために Cas9タンパク質とgRNAを細胞内に導入するケースが増えている。しかし、カチオン性のトランスフェクション試薬では、十分なゲノム編集効率が得られない細胞種も少なくない。
GenomONE®-GE はエンドサイトーシス経路ではなく、膜融合を介して Cas9タンパク質とgRNAを細胞内に直接導入することができるトランスフェクション試薬である。エンドサイトーシス経路を回避することで、細胞内への導入過程におけるCas9タンパク質とgRNA の分解を最小限に抑えることができるため、高いゲノム編集効率を達成できる。本稿では、GenomONE®-GE が T 細胞のようなトランスフェクション困難な細胞に対しても適用できること、ノックインにも適用できることを紹介する。
GenomeONE®-GE に付属するHVJ-Eの特徴
1.カチオン性のトランスフェクション試薬及びウイルスベクターの特徴
これまでに、様々なカチオン性のトランスフェクション試薬が市販されている。これらは安全性が高く、また、特定の細胞種に対しては高効率で物質を細胞内へ導入することが可能だが、必ずしもすべての細胞種に対して有効ではなく、特に浮遊系の免疫細胞では低効率であることが知られており、汎用性に問題がある。ウイルスベクターは、ウイルスの感染能力を利用するため、カチオン性のトランスフェクション試薬と比較して圧倒的に優れた遺伝子導入・発現効率を有しているものの、安全性に問題がある。
従って、これまでに開発されたトランスフェクション試薬、ウイルスベクターにはいずれも一長一短があり、安全かつ高効率で物質を細胞内へ導入できる新たな技術開発が望まれている。このような背景のもと、全く新しい発想に基づいて大阪大学の金田安史先生によって開発された、高い安全性と高効率で物質を細胞内へ導入できる能力を兼ね備えた高性能ベクターが HVJ-E(Hemagglutinating virus of Japan envelope ; HVJ-E)である1)。
2.HVJ-Eは安全性の高いトランスフェクション試薬である
HVJ-E はセンダイウイルスのゲノムを破壊した不活化センダイウイルスである。本来センダイウイルスが有する感染性・増殖性を完全に喪失しているため、特殊な設備を必要とせず、バイオセーフティーレベル 1(BSL1)の実験室で使用することができる(図1(a))。
HVJ-E が付属する研究用試薬 GenomONE® シリーズは2002 年から販売されているが、これまでに外部施設でウイルスの感染被害が生じた報告は全くない。これは、HVJ-E の製造過程・製造後に、鶏卵・培養細胞を用いたウイルスの感染性・増殖性が完全に喪失していることの確認を含め、徹底的な品質管理を行っている結果である。
3.HVJ-Eのエンベロープ内に様々な物質を封入することができる
HVJ-E のエンベロープ内に siRNA、miRNA、プラスミドDNA、タンパク質など様々な物質を封入できることが確認されている。本稿で紹介するGenomONE®-GE には Cas9タンパク質とgRNAをHVJ-Eエンベロープ内に効率よく封入するために必要な専用の試薬が付属されており、簡便な操作で容易に封入することができる。
4.HVJ-Eは膜融合を介して物質を細胞内へ導入する
一般的に、カチオン性のトランスフェクション試薬はエンドサイトーシス経路で細胞内に取り込まれ、リソソームで分解を受けるため、エンドソームから細胞質に脱出する過程が障壁となる。一方、HVJ-Eの外膜には、センダイウイルス同様に膜融合に関わるFタンパク質とHNタンパク質が存在しており、センダイウイルス同様の非常に高い膜融合能が保持されている。HVJ-E は膜融合を介してエンベロープ内に封入した物質を細胞内へ直接導入することで、エンドサイトーシス経路を回避することができる。そのため、細胞内への導入過程において Cas9 タンパク質 や gRNA などの細胞内へ導入したい物質の分解を最小限に抑えることができるので、高い導入効果が期待できる(図1(b))。
5.HVJ-Eは様々な細胞種に適用可能な汎用性の高いトランスフェクション試薬である
HVJ-E はシアル酸を認識して細胞に結合するため、細胞特異性が低く、哺乳類から鳥類まで幅広い細胞種で利用することができる。驚くべきことに、カチオン性のトランスフェクション試薬では物質を細胞内に導入することが難しい B 細胞、T 細胞のような免疫細胞においても適用可能で 2, 3)、多数の研究者から多様な細胞種においてトランスフェクションの成功例が報告されている(図1(c))。
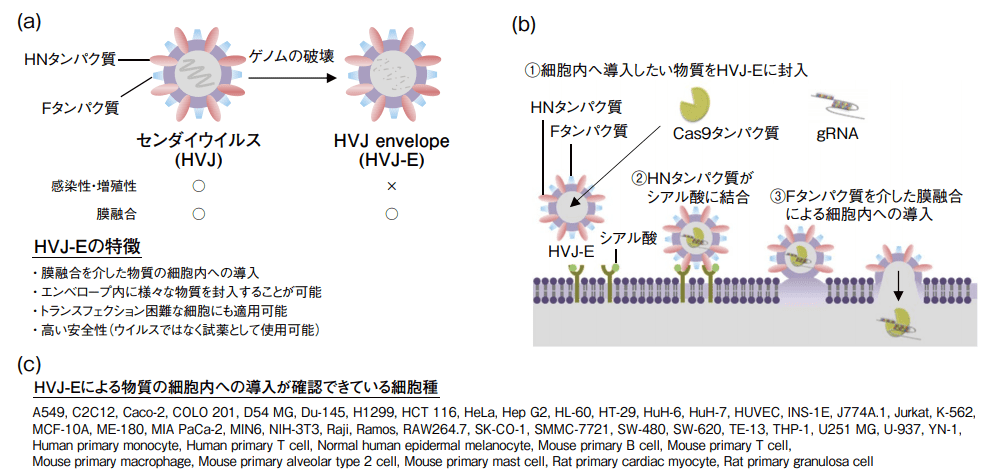
図1.HVJ-E の概要
(a)センダイウイルスと HVJ-E の特徴(b)膜融合を介した物質の細胞内への導入
(c)HVJ-E による物質の細胞内への導入が確認できている細胞種
GenomeONE®-GE を用いたゲノム編集の実験結果
1.トランスフェクション困難なマウスT細胞にCas 9タンパク質と gRNAを導入できる
PMA/ionomycin 刺激したマウス脾臓由来の T 細胞に、Cas9タンパク質とマウス Ppib 遺伝子を標的とした sgRNA(2'OMe+PS 修飾)をGenomONE®-GE、他社試薬 C、他社試薬 Tを用いてトランスフェクションした(96-well プレート)。2日後、標的部位の PCR 増幅を行い、T7 endonuclease I 処理後の電気泳動のバンドパターンからノックアウト効率を算出した。GenomONE®-GE では高いノックアウト効率が得られた一方、他社試薬C、他社試薬 T では全くゲノム編集が確認できなかった(図2(a))。
2.ssODN(ドナー DNA)を用いたノックインにも適用可能
HeLa 細胞に Cas9タンパク質、ヒトPPIB 遺伝子を標的とした sgRNA(2'OMe+PS 修飾)、制限酵素 BamHI認識配列をインサート配列として含むssODN(PS 修飾)を GenomONE®-GEを用いてトランスフェクションした(48-wellプレート)。2日後、標的部位の PCR 増幅を行い、制限酵素 BamHI 処理後の電気泳動のバンドパターンからノックイン効率を算出した。GenomONE®-GE は高いノックイン効率を達成し、さらに非相同末端結合(NHEJ)経路において重要な役割を担っているDNA-PK の阻害剤で、相同組換え修復(HDR)効率を向上することが知られているNU 7441を使用することでノックイン効率は一層高まった(図2(b))。
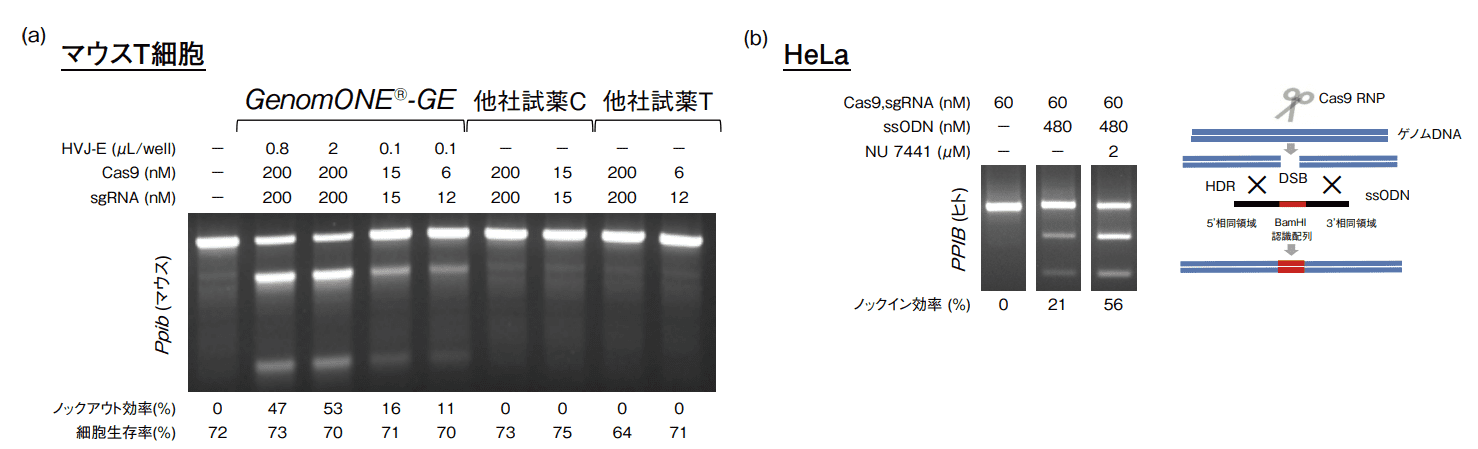
図2.GenomONE®-GE を用いたゲノム編集の実験結果
(a)マウス T 細胞における Cas9 タンパク質と gRNA の導入によるノックアウト(b)ssODN(ドナー DNA)を用いたノックイン
おわりに
GenomONE®-GE は、本稿で紹介したマウス T 細胞、HeLa 細胞以外にも Jurkat、THP-1、U-937、RAW264.7、HEK-293 細胞などトランスフェクションが難しい細胞を含む多様な細胞種において高いゲノム編集効率を達成しており、これらの結果はGenomONE®-GE が汎用性の高い Cas9タンパク質とgRNA のトランスフェクション試薬であることを証明している。
一般的に、カチオン性のトランスフェクション試薬を用いてプラスミド DNAを細胞内へ導入する際の障壁として、エンドソームから細胞質への脱出、転写・翻訳効率などが挙げられ、トランスフェクション困難な細胞においては、これらの要因が関わっていることが考えられる。一方、本稿で紹介した GenomONE®-GEを用いて Cas9タンパク質とgRNAを細胞内に導入する際は、上記の障壁は問題にならない。即ち、膜融合を介して物質を細胞内へ導入するためエンドサイトーシス経路を回避できること、転写・翻訳の必要が無いことから、トランスフェクション困難な細胞においても高いゲノム編集効率を達成できる。
本稿を読んだ研究者の方には、ユニークな特徴をもつ高性能の HVJ-E ベクターが付属した GenomONE®-GE を是非試していただきたい。
参考文献
- Kaneda, Y. et al. : Mol. Ther., 6, 219 (2002). DOI: 10.1006/mthe.2002.0647
- Hatano, R. et al. : J. Immunol., 194, 960 (2015). DOI: 10.4049/jimmunol.1402143
- Akamatsu, M. et al. : Sci. Immunol., 4, eaaw2707 (2019). DOI: 10.1126/sciimmunol.aaw2707








