【テクニカルレポート】STQ法を用いた動物用医薬品一斉分析
本記事は、ChemGrowing Vol.13 (2020年8月号)において、株式会社アイスティサイエンス技術営業部 島 三記絵様に執筆いただいたものです。
1.はじめに
食品の安心・安全への関心が高まる中、食品中に残留する動物用医薬品の分析は重要である。しかしながら動物用医薬品には物性の異なる様々な種類がありこれらを同時に分析するのは容易ではない。また分析精度とともに「迅速性」と「簡便性」も求められる。本アプリケーションでは「迅速・簡便・高精製」の残留農薬分析法であるSTQ法(Solid phase extraction Technique with QuEChERS method)を動物用医薬品分析に応用した結果を紹介する。
2.STQ法の概要
STQ法の概要を図1に示す。
STQ法は予冷式ドライアイス凍結粉砕法により均一化した試料を用いて、抽出はQuEChERS法を参考とし、精製は充填量が数十mgと少ない固相カラムSmart-SPEを使用する。
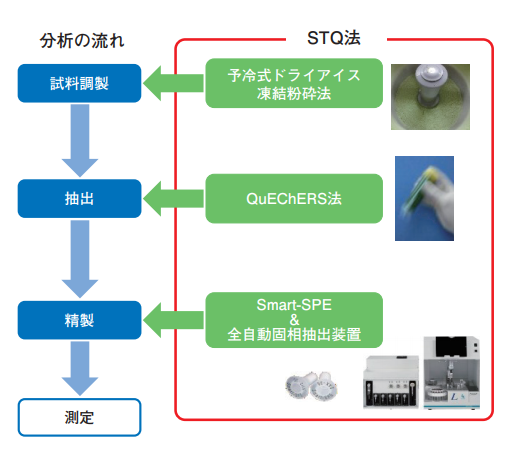
図1. STQ法の概要
予冷式ドライアイス凍結粉砕法では試料をパウダー状に細かく粉砕可能なため、少量サンプリングでも均一性を確保できる。そしてQuEChERS法の抽出及び固相カラムSmartSPEと組み合わせることで分析系のスケールダウンを図り、迅速、操作性の向上、コスト低減を可能にしている。
更にSTQ法の精製工程では「固相カラム」を使用することで高い精製効果を得ている。QuEChERS法に代表されるバルク(粉末)を用いた精製である分散固相抽出は「分配作用のみ」であるため精製が不十分で農薬も吸着されてしまう。一方、STQ法で採用している固相カラム抽出は「分配・分離作用」で夾雑成分を吸着させつつ農薬を効率よく回収することができる。固相カラムを使用する際の操作性については、専用の全自動固相抽出装置ST-L400や前処理キットを用いることで作業の簡易・効率化を実現している。精製効果は解析時のピークの定性・定量における信頼性や測定機器のメンテナンス頻度にも影響するため、精製効果を高めることは前処理における重要な要素の一つである。
STQ法はこのように試料の均一化から解析までトータルバランスを考慮した「迅速・簡便・高精製」の方法である。
3.分析方法
3-1.分析試料
本アプリケーションでは食肉(筋肉)として鶏ささみ、豚ヒレ肉、牛ヒレ肉を、その他の畜水産物として鶏卵、牛乳を、食肉加工品の一例として冷凍鶏唐揚を用いた。いずれも市販品である。
3-2.標準溶液
富士フイルム和光純薬株式会社製の下記標準溶液を使用した。
①動物用医薬品混合標準液(キノロン剤)(Code No. 227-02051)
②動物用医薬品混合標準液(サルファ剤+葉酸代謝拮抗剤)(Code No. 228-02081)
③動物用医薬品混合標準液(マクロライド)(Code No. 225-02091)
④動物用医薬品混合標準液(ホルモン剤)(Code No. 220-02203)
3-3.試料調製
試料の均一化は分析精度を保つ上で重要である。食肉試料についても同様であるが常温粉砕の場合は繊維質が残ったり、試料が団子状になって均一に粉砕できない場合がある。一方、予冷式ドライアイス凍結粉砕法では試料をドライアイスで予冷し、凍結した状態でドライアイスとともに粉砕することでパウダー状に均一化することができる(図2)。今回の添加回収試験では大容量凍結粉砕機(Code No. 387-17711)を用いて鶏ささみ、豚ヒレ肉、牛ヒレ肉、冷凍鶏唐揚を予冷式ドライアイス凍結粉砕法にて粉砕した(図3)。
鶏卵はフードプロセッサーで全卵を攪拌し、均一化した。
-

図2. 常温粉砕と予冷式ドライアイス凍結粉砕の比較 (鶏ささみ)
-

図3. 大容量凍結粉砕機
3-4.抽出
添加回収試験に使用するキノロン剤は4-キノロンを基本骨格にもつ化合物でその骨格の中にカルボキシル基(-COOH)が含まれる。この部分は中性では解離し極性が高く、酸性では非解離となり極性が低くなる(図4)。
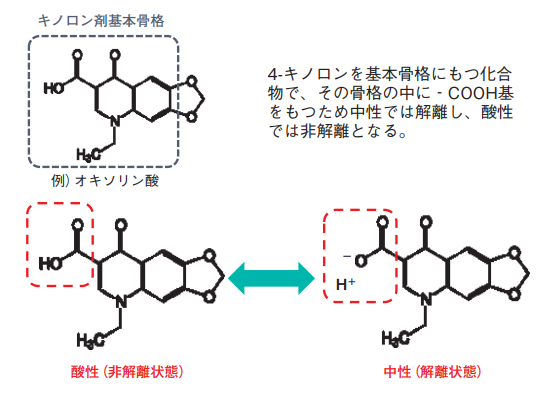
図4. キノロン剤
そこでまずはアセトニトリル(中性)でキノロン剤以外の成分を抽出しアセトニトリル層に移行させる。このときキノロン剤は解離しているため水層に移行する。引き続き残さにギ酸含有の酸性アセトニトリルを添加し、非解離にしたキノロン剤を抽出し、ギ酸含有アセトニトリル層に移行させ、これらの両抽出液を合算し定容する。このように中性とギ酸添加で酸性にしたアセトニトリルを用いた「繰り返し抽出定容法」により中性では解離状態で水層にあったキノロン剤を溶媒層に移行させ他の成分と合算し、定容操作により定量的に精度を確保することが可能である(図5)。
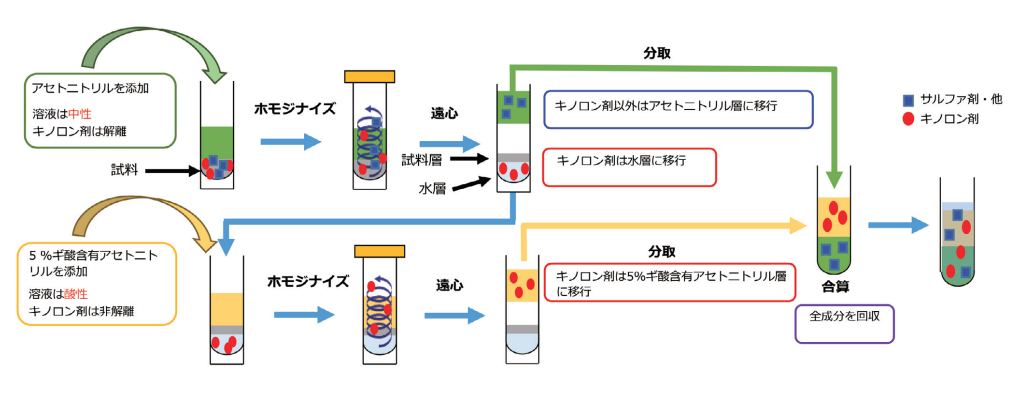
図5. 繰り返し抽出定容法
各試料とも5 g秤量後、3-2.の標準溶液を試料中0.01 ppmになるように添加した。その後水分含量が80%未満である鶏ささみ、豚ヒレ肉、牛ヒレ肉、冷凍鶏唐揚については水分量が5 g相当になるよう水を添加した。アセトニトリル10 mLを加えた後、1分間ホモジナイズを行った。塩化ナトリウム0.5 g、無水硫酸マグネシウム2 gを添加し、1分間手で激しく振とうした。遠心分離後アセトニトリル層(①)を目盛付き試験管に移した。引き続き残さに5 %ギ酸含有アセトニトリル10 mLを添加し、キノロン剤の抽出を行った。1分間ホモジナイズを行い、1分間手で激しく振とうした。遠心分離後、5%ギ酸含有アセトニトリル層(②)を目盛付き試験管に移し①と合算した。アセトニトリルで20 mLに定容し抽出液とした(図6)。
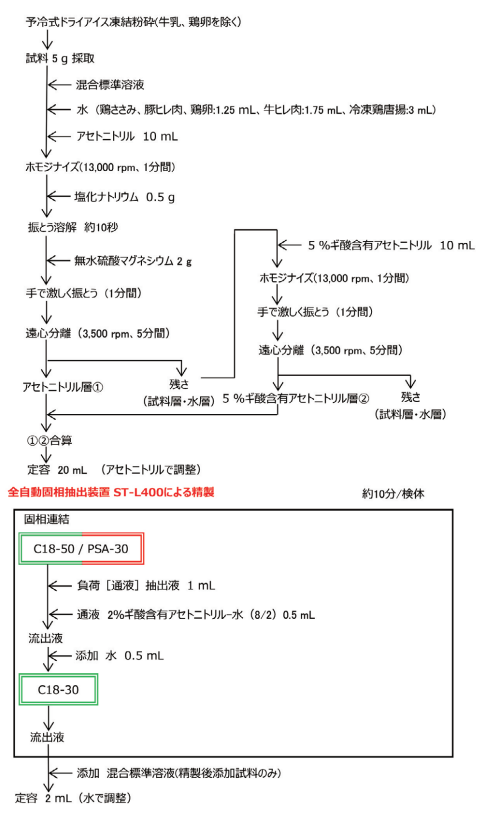
図6. 前処理フロー
3-5. 精製
精製はSmart-SPE C18-50(Code No. 304-94981)、C18-30(Code No. 307-94971)、PSA-30(Code No. 301-94991)の3種類の固相カラムを用いて全自動固相抽出装置ST-L400で行った(図7)。

図7. 全自動固相抽出装置ST-L400及びSmart-SPE固相カラム
全自動固相抽出装置ST-L400では各固相カラムを図8のように連結し通液を行う。C18は無極性固相であり試料中の無~低極性の成分を保持する。PSAは酸性物質やイオン性物質を保持する。図8において①C18-50では、試料負荷により無~低極性夾雑成分を保持し、目的成分を通過させる。
C18-50の下に連結した②PSA-30では脂肪酸等の酸性物質やイオン性夾雑成分を保持し、目的成分を通過させる。この際これらの物質とともにキノロン剤も保持されてしまうため、試料負荷後に酸性溶液を通液し、キノロン剤を非解離状態にしてPSAから溶出させる。この連結した2種類の固相カラムからの流出液に①②の固相カラムの下に連結したノズルから水を添加し、アセトニトリルの比率を下げて③C18-30に通液する。流出液に水を添加しアセトニトリル比率を下げることで①C18-50で除去できなかった低極性夾雑成分を③C18-30で除去する。これにより分析カラム(ODS)への夾雑成分の負担を軽減することができる。
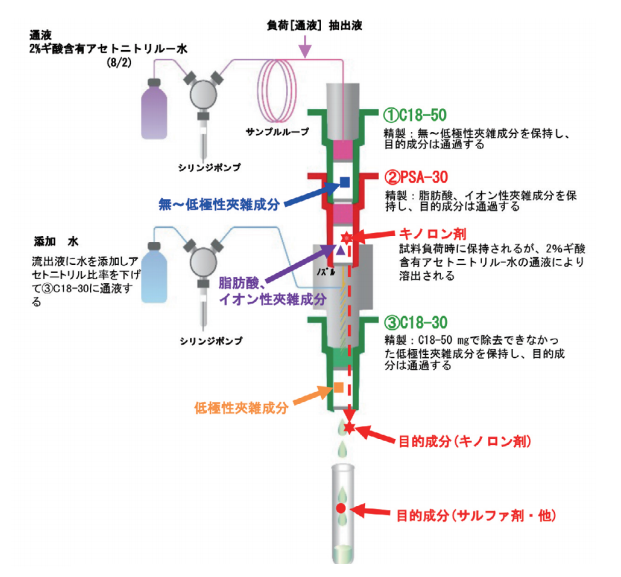
図8. 全自動固相抽出装置ST-L400 における精製工程
C18-50(50 ㎎)とPSA-30(30 ㎎)を連結したところに3-4. で得られた抽出液を1 mL負荷し2%ギ酸含有アセトニトリル‐水(8/2)0.5 mLを通液した。C18-50とPSA-30からの流出液に水を0.5 mL加えながらC18-30(30 ㎎)に通液した。流出液は全て試験管に受け、水で2 mLに定容した(図6)。
また測定時のイオン化阻害の影響を確認するため標準溶液未添加の試料を上記と同様に前処理し定容前に試料中0.01 ppmとなるよう精製後添加を行った。
3-6. 測定条件
得られた試料はLC-MS/MSで測定した。測定条件を表1に示す。
表1. 測定条件
| 測定装置 | |
|---|---|
| :Nexera X2 (島津製作所) | |
| :LCMS-8045 (島津製作所) | |
| LC条件 | |
| :YMC-Triart C18(150 × 2.1 mmI.D., S-3 μm, 12 nm) | |
| :移動相 A液:0.1%ギ酸水溶液 B液:0.1%ギ酸アセトニトリル溶液 |
|
| :0.2 mL/min | |
| :B.Conc1%(0 min)→15%(1 min)→40%(6 min)→100%(10-15 min)→1%(15.01-18 min) | |
| :5 μL(+水10 μL共注入) | |
| :40℃ | |
| MS条件 | |
| :ESI positive and negative | |
| :MRM | |
4. 結果
混合標準溶液の46成分について添加回収試験の結果を表2に、代表的なクロマトグラムを図9に示す。添加回収率は添加回収試験試料の各成分のピーク面積値を同濃度の標準溶液の面積値と比較して算出した。なお、添加回収試験試料のバイアル中濃度は1.25 ppbである。また測定時のイオン化阻害の影響を確認するため以下の2種類の回収率を算出した。
A:溶媒stdを用いた場合の添加回収率(%)
溶媒std
3-2.の標準溶液を溶媒で1.25 ppbに希釈した混合標準液(希釈溶媒はアセトニトリル、5%ギ酸含有アセトニトリル、水、2%ギ酸含有アセトニトリル-水(8/2)を1:1:1:1で混合した溶液)
計算式
添加回収試料の面積値÷溶媒std1.25 ppbの面積値×100
B:マトリクスstdを用いた場合の添加回収率(%)
マトリクスstd
3-5.で精製後添加を行った溶液(バイアル中濃度は1.25 ppb)
計算式
添加回収試料の面積値÷マトリクスstd1.25 ppbの面積値×100
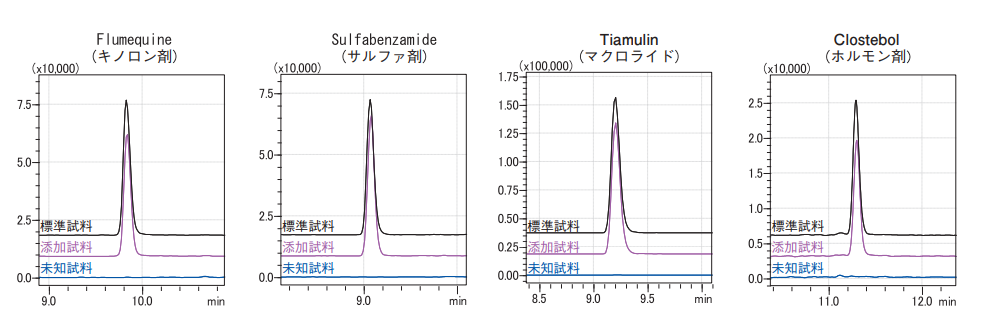
図9. 代表的なクロマトグラム
表2. 添加回収試験結果
添加濃度:試料中0.01 ppm(n=3)
| No. | 化合物名 | 分類 1) |
イオン 化モー ド2) |
保持 時間3) (分) |
鶏ささみ | 豚ヒレ肉 | 牛ヒレ肉 | 牛乳 | 鶏卵 | 冷凍鶏唐揚 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
溶媒std を用いた 場合4) |
マトリクス stdを用い た場合 5) |
|||||
| 回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
回収率 (%) |
|||||
| 1 | alpha-Trenbolone | H | P | 10.108 | 95 | 92 | 119 | 100 | 83 | 83 | 96 | 89 | 85 | 87 | 82 | 111 |
| 2 | beta-Trenbolone | H | P | 10.110 | 106 | 92 | 88 | 95 | 94 | 86 | 100 | 111 | 101 | 100 | 77 | 85 |
| 3 | Ciprofloxacin | Q | P | 5.912 | 72 | 63 | 70 | 72 | 65 | 70 | 74 | 77 | 73 | 70 | 68 | 94 |
| 4 | Clostebol | H | P | 11.337 | 86 | 94 | 87 | 95 | 84 | 90 | 87 | 86 | 74 | 85 | 87 | 96 |
| 5 | Danofloxacin | Q | P | 6.064 | 76 | 72 | 75 | 82 | 74 | 68 | 71 | 82 | 67 | 80 | 57 | 83 |
| 6 | Diaveridine | S | P | 5.486 | 69 | 94 | 69 | 96 | 59 | 91 | 70 | 87 | 84 | 85 | 61 | 104 |
| 7 | Difloxacin | Q | P | 6.969 | 88 | 80 | 85 | 81 | 77 | 73 | 86 | 90 | 67 | 80 | 85 | 85 |
| 8 | Enrofloxacin | Q | P | 6.308 | 81 | 83 | 78 | 85 | 79 | 75 | 103 | 87 | 82 | 69 | 75 | 92 |
| 9 | Flumequine | Q | P | 9.880 | 88 | 84 | 85 | 93 | 87 | 84 | 91 | 85 | 77 | 74 | 90 | 88 |
| 10 | Marbofloxacin | Q | P | 5.661 | 89 | 85 | 80 | 78 | 78 | 74 | 81 | 83 | 77 | 79 | 100 | 86 |
| 11 | Methylprednisolone | H | P | 9.435 | 107 | 102 | 88 | 109 | 88 | 78 | 97 | 87 | 112 | 83 | 91 | 82 |
| 12 | Nalidixic Acid | Q | P | 9.809 | 87 | 85 | 84 | 91 | 87 | 82 | 89 | 87 | 74 | 77 | 105 | 91 |
| 13 | Norfloxacin | Q | P | 5.762 | 74 | 65 | 69 | 70 | 59 | 48 | 84 | 75 | 75 | 76 | 72 | 93 |
| 14 | Ofloxacin | Q | P | 5.820 | 73 | 74 | 85 | 74 | 75 | 74 | 83 | 79 | 82 | 72 | 81 | 88 |
| 15 | Orbifloxacin | Q | P | 6.524 | 79 | 79 | 80 | 71 | 75 | 73 | 85 | 83 | 73 | 67 | 78 | 82 |
| 16 | Ormetoprim | S | P | 6.081 | 88 | 96 | 83 | 96 | 79 | 86 | 79 | 91 | 88 | 87 | 76 | 95 |
| 17 | Oxolinic Acid | Q | P | 8.866 | 86 | 93 | 82 | 98 | 88 | 82 | 88 | 96 | 77 | 82 | 63 | 93 |
| 18 | Piromidic acid | Q | P | 10.405 | 84 | 84 | 89 | 79 | 82 | 76 | 86 | 84 | 74 | 68 | 88 | 87 |
| 19 | Prednisolone | H | P | 8.941 | 92 | 107 | 92 | 92 | 93 | 89 | 99 | 97 | 89 | 95 | 69 | 95 |
| 20 | Pyrimethamine | S | P | 7.715 | 87 | 94 | 83 | 99 | 84 | 89 | 90 | 87 | 98 | 91 | 109 | 99 |
| 21 | Sarafloxacin | Q | P | 6.846 | 92 | 75 | 74 | 74 | 65 | 62 | 91 | 81 | 77 | 62 | 85 | 77 |
| 22 | Sulfabenzamide | S | P | 9.120 | 101 | 97 | 98 | 99 | 85 | 82 | 87 | 89 | 78 | 89 | 91 | 95 |
| 23 | Sulfabromomethazine Na | S | P | 9.898 | 99 | 98 | 108 | 111 | 87 | 91 | 91 | 97 | 87 | 98 | 84 | 87 |
| 24 | Sulfacetamide | S | P | 5.747 | 98 | 105 | 87 | 95 | 92 | 102 | 96 | 89 | 88 | 89 | 76 | 103 |
| 25 | Sulfachlorpyridazine | S | P | 8.119 | 96 | 94 | 99 | 94 | 92 | 88 | 93 | 96 | 80 | 95 | 98 | 98 |
| 26 | Sulfadiazine | S | P | 6.056 | 92 | 94 | 86 | 93 | 78 | 90 | 81 | 91 | 88 | 88 | 57 | 96 |
| 27 | Sulfadimethoxine | S | P | 9.171 | 105 | 105 | 89 | 100 | 91 | 93 | 92 | 92 | 91 | 86 | 94 | 96 |
| 28 | Sulfadimidine | S | P | 7.234 | 98 | 99 | 93 | 100 | 88 | 85 | 89 | 86 | 98 | 91 | 92 | 98 |
| 29 | Sulfadoxine | S | P | 8.429 | 98 | 98 | 90 | 105 | 93 | 92 | 91 | 89 | 91 | 89 | 91 | 96 |
| 30 | Sulfaethoxypyridazine | S | P | 8.398 | 94 | 99 | 84 | 99 | 88 | 82 | 90 | 94 | 89 | 91 | 100 | 99 |
| 31 | Sulfamerazine | S | P | 6.718 | 97 | 95 | 81 | 98 | 88 | 98 | 109 | 94 | 91 | 88 | 77 | 96 |
| 32 | Sulfamethoxazole | S | P | 8.472 | 99 | 103 | 88 | 99 | 93 | 105 | 85 | 84 | 96 | 90 | 91 | 93 |
| 33 | Sulfamethoxypyridazine | S | P | 7.165 | 98 | 102 | 90 | 99 | 87 | 86 | 88 | 92 | 89 | 104 | 92 | 100 |
| 34 | Sulfamonomethoxine | S | P | 7.726 | 96 | 92 | 93 | 100 | 90 | 88 | 96 | 98 | 89 | 90 | 99 | 95 |
| 35 | Sulfanitran | S | N | 9.736 | 108 | 104 | 108 | 93 | 103 | 91 | 98 | 96 | 101 | 86 | 110 | 92 |
| 36 | Sulfapyridine | S | P | 6.326 | 92 | 92 | 90 | 96 | 83 | 85 | 69 | 91 | 82 | 96 | 69 | 99 |
| 37 | Sulfaquinoxaline | S | P | 9.154 | 97 | 98 | 88 | 98 | 88 | 88 | 90 | 86 | 97 | 90 | 98 | 97 |
| 38 | Sulfathiazole | S | P | 6.047 | 88 | 94 | 85 | 99 | 72 | 76 | 84 | 91 | 76 | 90 | 61 | 94 |
| 39 | Sulfatroxazole | S | P | 8.597 | 93 | 87 | 100 | 105 | 99 | 95 | 89 | 87 | 92 | 90 | 79 | 95 |
| 40 | Sulfisomidine | S | P | 5.250 | 79 | 91 | 85 | 96 | 80 | 84 | 79 | 88 | 81 | 92 | 65 | 96 |
| 42 | Sulfisozole | S | P | 7.600 | 96 | 101 | 88 | 93 | 91 | 89 | 86 | 90 | 86 | 98 | 78 | 96 |
| 43 | Tiamulin | M | P | 9.210 | 99 | 98 | 95 | 99 | 86 | 89 | 89 | 89 | 96 | 95 | 79 | 97 |
| 44 | Tilmicosin (isomers) | M | P | 7.629 | 98 | 100 | 92 | 99 | 86 | 88 | 82 | 86 | 91 | 96 | 105 | 96 |
| 45 | Trimethoprim | S | P | 5.751 | 79 | 98 | 87 | 96 | 91 | 93 | 80 | 93 | 78 | 91 | 114 | 105 |
| 46 | Zeranol | H | P | 10.340 | 80 | 105 | 119 | 98 | 119 | 106 | 96 | 89 | 95 | 94 | 107 | 119 |
- Q:キノロン剤、S:サルファ剤または葉酸代謝拮抗剤、M:マクロライド、H:ホルモン剤
- イオン化モード P:Positive N:Negative
- 弊社での実測値
- 添加回収サンプル÷溶媒std×100
- 添加回収サンプル÷マトリクスstd×100
食肉3種、牛乳、鶏卵については42成分以上で70~120%の良好な回収率が得られた。冷凍鶏唐揚では70~120%の回収率の成分は39成分であり、残りの7成分の回収率は70%未満であったが、これらのマトリクスstdで算出した回収率はいずれも70~120%の回収率となった。これは精製工程では回収されていたが測定時にマトリクスによりイオン化阻害の影響を受けたためと推測される。
キノロン剤の一部の成分では回収率が70%付近であった。これらは抽出時の溶媒層への移行が不十分だったと推測される。また牛肉でこの傾向が顕著であったことから試料による夾雑成分の違いも影響していると思われる。
5. おわりに
アセトニトリルと5%ギ酸含有アセトニトリルの2種類の溶媒で繰り返し抽出を行い、抽出液を合算することで物性の異なる成分を同時に前処理することが可能であった。また両抽出液を合算後、定容することで定量性も確保することができた。精製では全自動固相抽出装置ST-L400を使用することで煩雑な精製工程を迅速・簡便に行うことができた。本試験では食肉のみだけでなく牛乳、鶏卵、加工食品(冷凍鶏唐揚)においても一律基準濃度の添加回収試験で概ね良好な結果を得ることができた。
本アプリケーションではSTQ法を用いて各種の試料に対して「迅速・簡便・高精製」に分析できることが示された。
参考文献
- 島三記絵, 朝野夏世, 宇野由紀, 佐々野僚一 : "STQ法とLC/MS/MSを組み合わせた食肉中の動物用医薬品高速一斉分析(前処理編)"第114回日本食品衛生学会学術講演会要旨集, p.124 (2018).
- 島三記絵, 井本英志, 佐々野僚一, 斎藤勲 : "STQ法とLC/MS/MSを組み合わせた食肉中の動物用医薬品高速一斉分析(第2報)"第115回日本食品衛生学会学術講演会要旨集, p.110 (2019).




